铜(Ⅱ)配合物{[Cu(OMBA)2]2·(DMF)2}的合成、CT-DNA结合及细胞毒性
2022-01-13曾振芳蔡杰慧黄秋萍韦友欢陈丽苗黄秋婵
曾振芳,蔡杰慧,黄秋萍,韦友欢,陈丽苗,黄秋婵
(广西民族师范学院化学与生物工程学院,崇左 532200)
0 引 言
金属配合物被广泛应用于催化[1-3]、磁性[4-6]、杀虫[7-9]和药物释放[10-12]等领域。金属有机配合物兼具无机和有机特性,随着越来越多配合物的合成,新型配合物的性质如生物活性引起人们的关注[13]。过渡金属铜离子为生物体内源性元素,在生命体中拥有许多重要的生理功能,与配体形成配合物时,具有抗肿瘤等活性[14-16]。DNA是向生物体传达遗传信息的一种高分子物质,DNA对许多抗癌药物目标细胞的转录和翻译起作用,药物可以通过共价键和非共价干扰DNA的复制,使其生理功能受到影响[17]。为了研究新型铜配合物的抗肿瘤能力,为铜金属配合物作为抗癌药物研究领域提供基础数据,本文合成了一个新型的邻甲苯甲酸铜(Ⅱ)配合物{[Cu(OMBA)2]2·(DMF)2},通过红外、元素分析及 X射线单晶衍射等方法对配合物进行表征及结构分析,研究了配合物与CT-DNA的相互作用方式以及配合物对胃癌细胞A549、宫颈癌细胞Hela和肝癌细胞HepG2的细胞抗增殖能力。
1 实 验
1.1 实验主要仪器、试剂
实验仪器:XTL-220型显微镜(中国上海天省),Spectrum 65型傅里叶变换红外光谱仪(美国PerkinElmer),HERA cell CO2型细胞培养箱(美国Thermo),Smart ApexII CCD X 型X-射线单晶衍射仪(德国 Bruker),Multiskan Spectrum型酶标仪(美国Thermo),RF-5301 PC型荧光分光光度计(日本岛津),VarioEL Ⅲ元素分析仪(德国艾乐曼),常数毛细管黏度计(中国上海申谊),UV-8000型紫外可见分光光度计(中国上海元析仪器)。
实验试剂:邻甲基苯甲酸(上海阿拉丁生化科技股份有限公司),三水合硝酸铜(天津市光复科技发展有限公司),小牛胸腺DNA(CT-DNA,Sigma),三羟甲基氨基甲烷(Tris,武汉市恒沃科技有限公司),DMEM培养液(Hyclone),F12K培养液(Gibco),胎牛血清(Gibco),CCK-8试剂(Biosharp),0.25%胰酶溶液(索来宝),胃癌细胞A549、宫颈癌细胞Hela和肝癌细胞HepG2(中国科学院细胞库)。
1.2 配合物{[Cu(OMBA)2]2·(DMF)2}的合成
取1 mmol的邻甲基苯甲酸溶于4.0 mL DMF和2.0 mL水制得邻甲基苯甲酸溶液。往4.0 mL水中加入1 mmol三水合硝酸铜制得硝酸铜水溶液,搅拌下将硝酸铜水溶液滴加至邻甲基苯甲酸溶液中,滴加完毕,搅拌30 min,封膜置于阴凉处,10 d后析出细小的淡青色晶体,过滤后50 ℃下烘干3 h,收率54.3%。{[Cu(OMBA)2]2·(DMF)2}的分子式为C38H42Cu2N2O10,相对分子质量MW=813.82。元素分析理论值(%):C 56.08,H 5.20,N 3.44;实验值(%):C 56.21,H 5.24,N 3.35。
1.3 配合物的晶体结构测定
将尺寸为 0.21 mm× 0.18 mm× 0.15 mm 的晶体置于CCD X 射线面探衍射仪上,晶体在296(2)K时使用Mo-Kα射线 (λ=0.071 073 nm)衍射收集数据。扫描角度θ范围为2.08°~25.00°,衍射区为(12≤h≤11,-11≤k≤12,-11≤l≤13),收集4 585个衍射点,其中独立衍射点有3 304个。全部数据经Lp因子和经验吸收校正。结构分析工作采用OLEX2和 SHEXTL-97 软件完成。晶体结构由重金属法解出,氢原子均为理论加氢。对非氢原子采用各向异性热参数进行全矩阵最小二乘法修正。配合物的金属配合物的晶体学数据列于表1。CCDC:1888907。R(int)=0.027 1,R1=0.051 5,wR2=0.140 4。
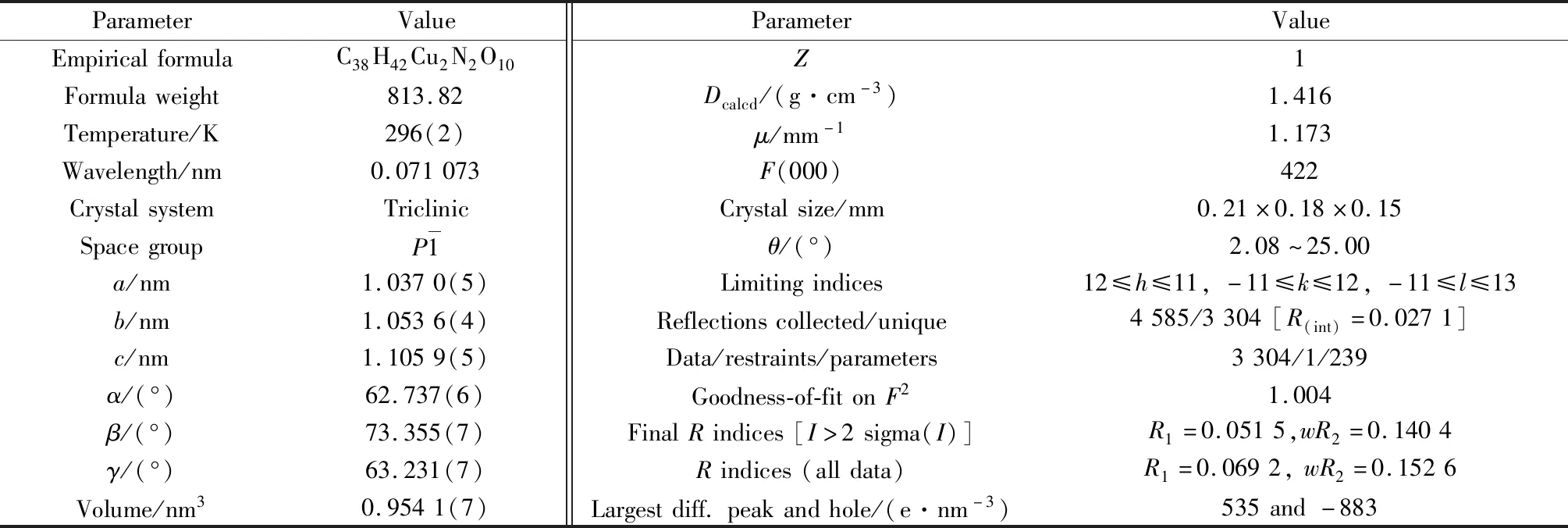
表1 配合物的晶体学数据Table 1 Crystallographic data of the complex
1.4 配合物与CT-DNA的相互作用
1.4.1 溶液配制
缓冲溶液(Tris-HCl/NaCl):称取0.605 7 g (5 mmol)的Tris和2.910 2 g (50 mmol)的氯化钠置于烧杯中,搅拌溶解,将缓冲液的pH值调整为7.2。
CT-DNA溶液:称取10.0 mg小牛胸腺DNA溶解于缓冲溶液中。在260 nm及280 nm处测量其吸光度A,若A260/A280=1.8~1.9,说明其中没有蛋白质,不需进一步处理。由公式(1)计算其浓度[18]:
[DNA]=K×A260/6 600 (mol/L)
(1)
式中:K为稀释倍数,[DNA]是DNA的浓度。将配制的CT-DNA贮备液放置于4 ℃的冰箱内,且放置时间不超过3 d。
1.4.2 电子吸收光谱
用缓冲溶液扫描基线,扣除空白背景。参比池和样品池中分别加入3.0 mL缓冲溶液和浓度为50 μmol·L-1的配合物溶液,用移液枪往两池中滴加等量(80 μL)的CT-DNA (2 mmo/L)溶液,使CT-DNA与配合物的浓度比值不断增加,每次加CT-DNA溶液后,吹打混匀,静置5 min,在200~400 nm波长范围内进行扫描。
1.4.3 荧光光谱
将8 μmol·L-1溴化乙啶(EB)与10 μmol·L-1的CT-DNA溶液等体积混匀,反应12 h。将3.0 mL的EB-CT-DNA溶液加入样品池中,于激发波长为565 nm、扫描速度为240 nm·s-1下,测定540~700 nm波长范围内的发射光谱。向EB-CT-DNA体系中滴加40 μL浓度为1 mmol·L-1的配合物溶液,待其反应5 min后,测定其发射光谱。
1.4.4 黏度实验
在温度为(29.0±0.1)℃的恒温水槽中,使用乌式黏度计测定CT-DNA溶液的黏度。使配合物与CT-DNA的浓度比值[Complex]/[DNA]=0、0.05、0.10、0.15、0.20、0.25、0.30。将20.0 mL的200 μmol·L-1的CT-DNA溶液放入黏度计中,用移液枪加入1 × 10-3mol·L-1的200 μL配合物,记录通过毛细管的CT-DNA溶液的有效刻度的时间(s),平行3次实验,取得平均值,由公式η=(t-t0)/t0进行计算CT-DNA溶液的相对黏度,其中t0是缓冲溶液流经有效刻度所需时间,t是不同浓度的配合物作用于CT-DNA溶液时流经有效刻度所需时间。以(η/η0)1/3(η0为未加配合物时CT-DNA溶液的相对黏度)对[Complex]/[DNA]作图,得到配合物对CT-DNA黏度影响的变化图。
1.5 细胞毒性
将HepG2、HeLa和A549细胞消化、计数、配制成浓度为5×104个/mL的细胞悬液,在96孔细胞培养板中每孔加入100 μL 细胞悬液(每孔5×103个细胞),将细胞培养板置于37 ℃、5%CO2培养箱中培养过夜,使用完全培养液(90%培养液+10%胎牛血清)分别配制含不同浓度配合物的工作液,混合均匀,每孔加入100 μL相应工作液,每种浓度设置3重复,细胞在37 ℃、5%CO2培养箱中培养24 h、48 h、72 h或96 h 后弃上清液,培养液洗涤细胞1次,将96孔板进行CCK-8染色,波长λ=450 nm下,用酶标仪测定OD值。
2 结果与讨论
2.1 配合物的红外光谱分析
在4 000~500 cm-1范围内测试了原料及配合物的红外光谱,如图1和图2所示。由图1可以看出,配合物在3 527 cm-1为苯环质子伸缩振动吸收峰,1 667 cm-1为羰基的伸缩振动吸收峰,1 600 cm-1为苯环的骨架振动吸收峰,1 432 cm-1为苯环上甲基伸缩运动吸收峰,1 040 cm-1为OH…O的面外变形运动吸收峰,742 cm-1为苯环质子的面外变形运动吸收峰。由图2可以看出,与原料相比,配合物红外光谱中某些谱带发生了明显位移,相对强度也有所变化,由此推断铜离子与配体之间有键合作用,形成了配合物。

图1 配合物红外光谱图Fig.1 Infrared spectrum of the complex

图2 原料与配合物红外光谱对比图Fig.2 Infrared spectra of raw materials and complex
2.2 配合物晶体结构解析
配合物部分键长、键角列于表2,50%的分子结构如图3所示,分子堆积图如图4所示。

表2 配合物的主要键长和键角Table 2 Selected bond lengths and bond angles of the complex

图3 配合物的椭球率50%的晶体结构图Fig.3 Crystal structure of the complex with 50% thermal ellipsoids
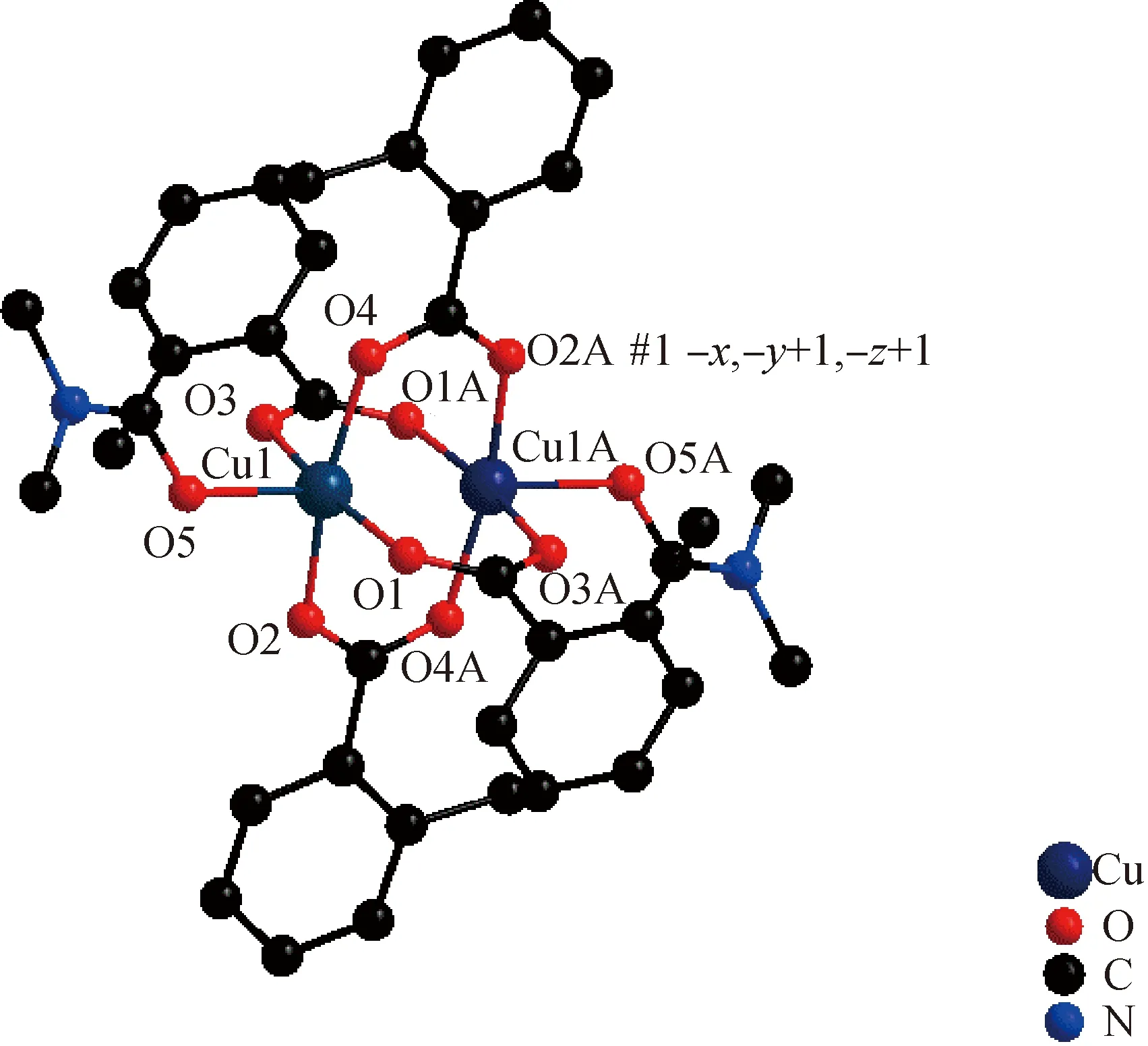
图4 配合物的晶胞堆积图Fig.4 Packing structure of the complex
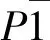
2.3 配合物与CT-DNA相互作用
2.3.1 电子吸收光谱分析
由图5可看出,随着CT-DNA的浓度增大,配合物在228 nm处具有减色效应,吸收峰位置发生轻微紫移,由此推测配合物对 CT-DNA 具有插入作用。配合物和DNA的结合常数由公式(2)[19]计算得到:

图5 配合物与CT-DNA作用的电子吸收图Fig.5 Electron absorption spectra of the complex interacting with DNA
[DNA] /(εa-εf)=[DNA] /(εb-εf)+1/Kb(εb-εf)
(2)
式中:εa是游离配合物的摩尔吸光系数;εf是没有与DNA作用时配合物的摩尔吸光系数;εb是DNA与配合物相互作用饱和时的摩尔吸光系数;Kb是结合常数;[DNA]是DNA的浓度。以C(DNA)/(εa-εf)对C(DNA)作图,由公式(2)计算得到配合物与DNA的结合常数Kb=939.61 L·mol-1。
2.3.2 荧光光谱分析
如图6所示,EB-CT-DNA在596 nm处有很强的荧光吸收峰。随着配合物的浓度增大,荧光强度逐渐减小,初始荧光强度从96.43%降到68.11%。配合物与CT-DNA作用模式与EB相似,为经典的插入模式。通过公式F0/F=1+Ksv[C](式中F0表示未加入配合物时EB-CT-DNA体系的荧光强度,F分别表示加入配合物时EB-CT-DNA体系的荧光强度,Ksv表示猝灭常数,[C]表示配合物浓度),计算得到Ksv=3.00×103L·mol-1,猝灭速率常数Kq=3.00×1011L·mol-1·s-1,远大于机理动态猝灭速率常数(2×1010L·mol-1)[19],故配合物对EB-DNA的荧光猝灭是静态猝灭。通过公式lg[(F0-F)/F]=lgKa+nlg[C](式中Ka是结合常数,n是结合位点)计算得到静态猝灭时配合物和CT-DNA结合速率常数Ka=5.38×103L·mol-1,结合位点n=1。

图6 配合物作用下DNA的荧光图Fig.6 Fluorescence spectra of DNA interacting with complex
2.3.3 黏度分析
CT-DNA与配合物有经典插入和静电或沟面作用的方式,前者使CT-DNA双螺旋结构改变而增加其黏度,后两者对CT-DNA黏度几乎不改变[20]。由图7可看出,随着配合物浓度增大,CT-DNA的黏度增大,表明配合物以经典插入的方式与CT-DNA结合。

图7 配合物作用下CT-DNA的黏度图Fig.7 Viscosity of CT-DNA interacting with complex
2.4 细胞毒性
由图8(a)可计算出,配合物{[Cu(OMBA)2]2·(DMF)2}对胃癌细胞A549、宫颈癌细胞Hela及肝癌细胞HepG2作用48 h后细胞的IC50值分别为156.2 μmol/L、187.8 μmol/L、62.93 μmol/L。由表3可知,配合物对A549、Hela和HepG2细胞具有抗增殖作用,但是在相同条件下,抗增殖作用比顺铂差,但是比文献报道的非铜配合物效果好[21]。抗增殖程度具有浓度和时间依赖性,即剂量越大、药物作用时间越长,则对三种癌细胞的抑制率越高。
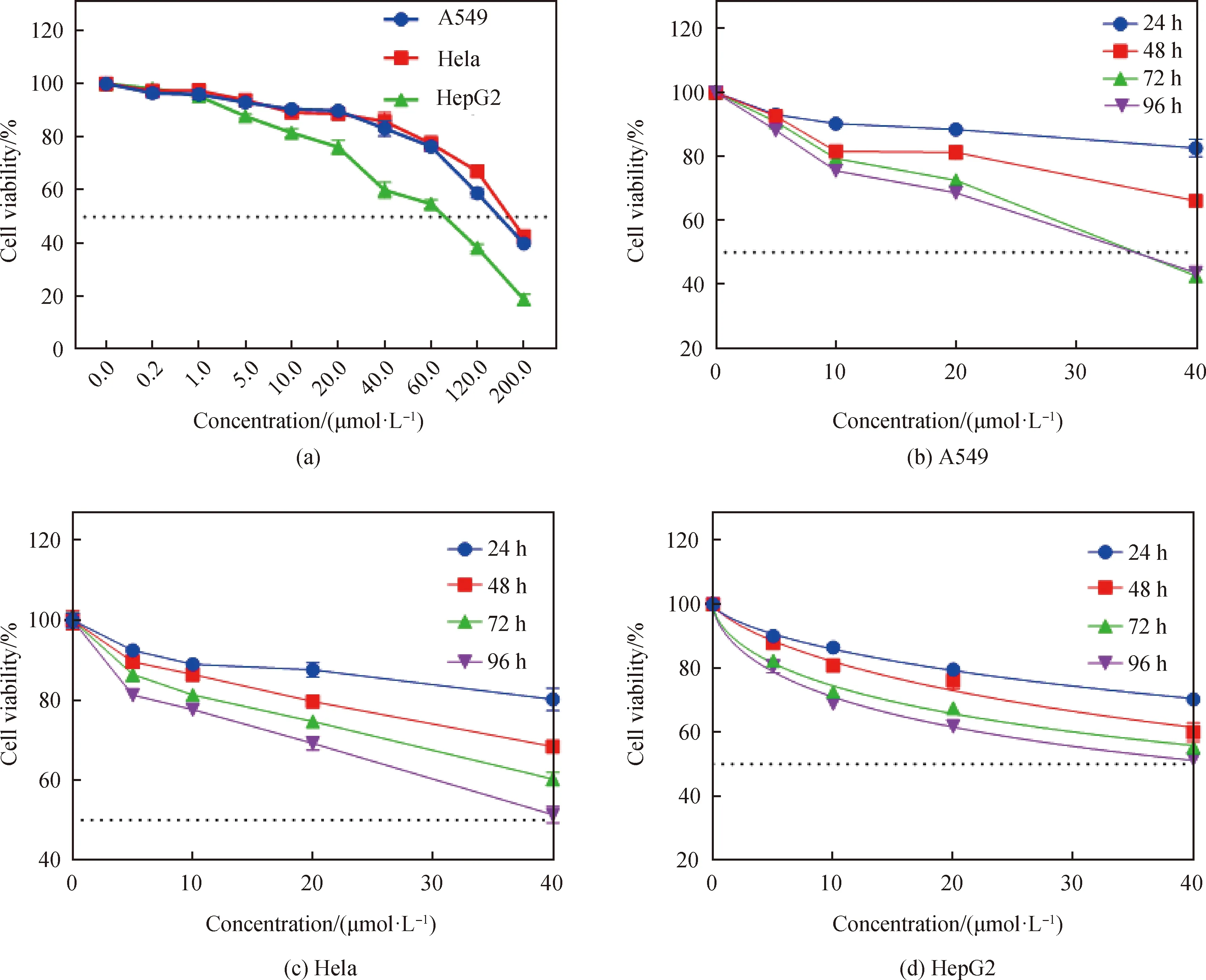
图8 (a)配合物作用48 h后对HepG2、HeLa、A549细胞增殖的影响;(b)~(d)配合物对A549、Hela、HepG2在不同时间下对细胞增殖的影响Fig.8 (a)Effects of the complex on HepG2,HeLa,and A549 cell viability and proliferation after 48 h exposure;(b)~(d)time gradient of effects of the complex on A549,HeLa,and HepG2 cell viability and proliferation
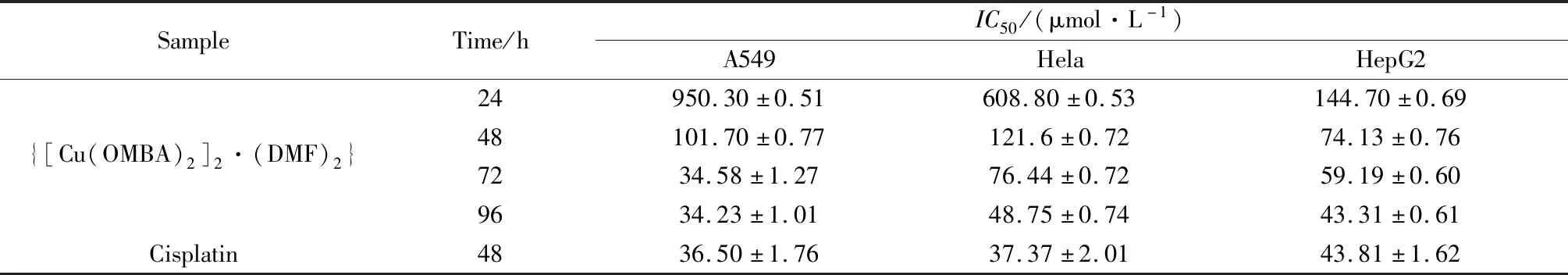
表3 配合物的对A549、Hela和HepG2细胞的毒性Table 3 IC50 of the complex against A549,Hela,and HepG2 cell
3 结 论