喷雾冷冻干燥对卵白蛋白和卵黏蛋白互作的影响
2022-01-13刘丽莉王浩阳郝威铭苏克楠卢玉婷
刘丽莉,王浩阳,郝威铭,苏克楠,卢玉婷
(1.河南科技大学 食品与生物工程学院,河南 洛阳 471023;2.食品加工与安全国家级教学示范中心,河南 洛阳 471023;3.河南省食品加工与质量安全控制国际联合实验室,河南 洛阳 471023)
0 引言
蛋清粉作为鲜蛋的替代品,兼备鲜蛋的营养功能,又能解决鲜蛋不易保存、不易运输的难题,被广泛应用于食品等多种行业。干燥方式是影响蛋清粉功能特性的重要因素之一。目前,常见的干燥方式有热风干燥、喷雾干燥(spray drying,SD)等方法。而喷雾冷冻干燥(spray freeze drying,SFD)在低温下进行,解决了喷雾干燥温度过高的缺点,对蛋白质产品破坏较少,且产品具有良好的稳定性和复水性[1]。因此,对喷雾冷冻干燥后的蛋白结构变化进行研究,对蛋白互作后的品质控制意义重大。
目前,已有不少学者对蛋粉进行了研究。文献[2]以鸡蛋粉为研究对象,采用真空冷冻与喷雾对其进行干燥,研究了不同干燥条件下其功能特性的变化,研究结果表明:不同干燥条件制备的鸡蛋粉颗粒形状存在明显不同,且真空冷冻干燥(freeze dried,FD)条件下制备的鸡蛋粉品质更优。文献[3]以蛋清粉为研究对象,用不同的干燥温度对蛋清蛋白进行喷雾干燥,研究结果表明:当温度为160 ℃时,可以促使蛋白质分子发生断裂,发生一定程度的聚集,表观黏度下降,可更好地改善其流变特性,从而拓展其在食品等领域的应用。文献[4]研究了蛋清粉凝胶结构的表征及其与干热预处理影响凝胶性能的关系,研究结果表明:通过干热预处理蛋清粉,蛋清粉凝胶的强度、透明度和保水能力提高。文献[5]研究了不同的干热时间对蛋清粉水流动性及其凝胶之间的分子间相互作用的影响,随着干加热时间的增加,凝胶硬度和持水量显著增加(P<0.05),并且两个参数都与凝胶透明度呈正相关。
本团队已比较分析了不同干燥方法[6]对蛋清的干燥、二级结构和功能性质的影响,以及蛋清蛋白喷雾干燥工艺优化[7]。但对于复杂的鸡蛋蛋白质而言,不同蛋白之间如何发生相互作用,以及这些作用对结构功能特性的影响报道较少。因此,本文以喷雾干燥和真空冷冻干燥为对照,系统研究了喷雾冷冻干燥对卵白蛋白(ovalbumin,OVA)和卵黏蛋白(ovomucin,OVM)相互作用的结构和功能特性的影响,可为蛋清粉的精深加工提供参考。
1 材料与设备
1.1 材料与试剂
新鲜鸡蛋,河南洛阳大商新玛特超市;溴化钾(分析纯),天津市光复经济化工研究所;卵白蛋白(分析纯),上海生物工程有限公司;卵黏蛋白(分析纯),上海生物工程有限公司;大豆油(市售),河南洛阳大商新玛特超市;溴酚蓝(分析纯),上海一研生物有限公司;二硫硝基苯(分析纯),Sigma-Aldrich公司;Tris-HCl(分析纯),苏州亚科科技有限公司。
1.2 仪器与设备
MQC型核磁共振仪,英国Oxford Instruments 公司;VERTEX70型傅里叶红外光谱仪,德国 Bruker 公司;VERTEX70型荧光光度计,美国Aglient公司;Q10型差示扫描量热仪,美国TA公司;S-4800型扫描电镜(scanning electron microscope,SEM),日本Hitachi公司;8420型台式离心机,日本 KUBTY公司;692型pH计,美国JENCO 公司;AR214型电子天平,美国Mettler Toledo公司;DHR-1型流变仪,美国TA 公司。
2 试验方法
2.1 蛋白粉的制备
将卵白蛋白(OVA)和卵黏蛋白(OVM)按照鸡蛋中的比例混合,配制质量浓度为0.1 mg/mL的蛋白质溶液,试验过程中所用到的水均为蒸馏水。将上述配置好的溶液分别进行喷雾干燥、真空冷冻干燥和喷雾冷冻干燥,得到蛋白粉,备用。
2.2 SFD对OVA和OVM互作后结构的影响
低场核磁共振(low field nuclear magnetic resonance,LF-NMR)测定。参考文献[8]的方法,对OVA和OVM互作后的蛋白粉进行LF-NMR测定。
傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)测定。参考文献[9]的方法,对OVA和OVM互作后的蛋白粉进行FT-IR测定。
荧光光谱(fluorescence spectroscopy,FS)测定。参照文献[10]的方法对OVA和OVM互作后的蛋白粉进行FS测定。将样品溶于Tris-HCl(pH7.4)缓冲液,配成0.5 mg/mL的蛋白溶液,扫描绘制光谱图。
差式扫描量热(differential scanning calorimetry,DSC)测定。参考文献[11]中的DSC法,对蛋白的热变性进行测定。取6~8 mg样品,以空坩锅作为对照,10 ℃/min的速率,将氮气的流速设置为20 mL/min,温度设置为20~150 ℃,扫描得出曲线。
扫描电镜测定。根据文献[12]的试验方法,对OVA和OVM互作后的蛋白粉进行SEM测定,用来分析干燥后的微观结构变化。在溅射电压1.1~1.2 kV下,选择有代表性的区域进行观察拍摄。
2.3 SFD对OVA和OVM互作后功能特性的影响
乳化性的测定。参照文献[13]的方法,分别测定不同干燥方式制备的蛋白粉的乳化性。
溶解性的测定。采用文献[14]的方法,将在不同干燥方式下制备的蛋白粉溶于去离子水中,制成质量浓度为1 mg/mL的溶液(pH7),并在室温环境下,通过磁力搅拌30 min,以1 000 r/min的速度离心20 min。取上清液并测定溶解性。
起泡性和泡沫稳定性的测定。采用文献[15]的方法,把制得的样品溶于蒸馏水,蛋白粉质量分数为12.2%,然后搅拌,时间为1 h,制得样品溶液。取150 g样品溶液,加入混合器搅拌器中搅拌,搅拌速率为10,时间为5 min,测量溶液和泡沫的溢出量。
流变特性的测定。将不同干燥方式制得的蛋白粉配制成蛋清液,将蛋清液均匀涂抹于流变仪上(间隙为1 050 μm)进行扫描,研究不同冷风风量对蛋清蛋白溶液表观黏度(ηa)的影响。在25 ℃下,将动态频率扫描参数设置为1%,频率变化设置为0.1~300 rad/s,测定蛋清储能模量G′和损耗模量G″随频率的变化规律。
2.4 数据处理
利用Origin 8.5软件进行数据分析;DPS 7.05软件进行方差分析(显著水平P<0.05);每组试验平行进行3次。
3 结果与分析
3.1 SFD对OVA和OVM互作后结构的影响
3.1.1 LF-NMR分析
不同干燥方式下OVA和OVM互作蛋白均有3个峰,这3个峰则代表着样品中水分的不同存在状态,当弛豫时间为0.01~5 ms时,表示结合水的信号强度;当弛豫时间为5~20 ms时,表示吸附水的信号强度;当弛豫时间为20~1 000 ms时,表示自由水的信号强度[16]。图1为不同干燥方式对OVA和OVM互作的横向弛豫时间瀑布图。由图1可知:与SD处理的样品相比,FD和SFD处理的样品信号幅值提高,两者信号强度差距不大,说明干燥方式使蛋白互作过程中水合作用加强,蛋白与水的结合更加紧密。同时,经过SFD处理的样品自由水减少[17],表明OVA和OVM相互作用后的蛋白结构在干燥过程中结合水的数量加大,保水性更高。
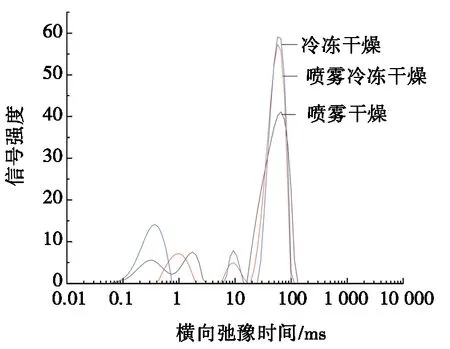
图1 不同干燥方式对OVA和OVM互作的 横向弛豫时间瀑布图
表1为不同干燥方式对蛋白弛豫时间T2变化的影响。由表1可知:SFD条件下的互作蛋白结合水(T21)和吸附水(T22)峰比例高于SD和FD,这可能是因为低温条件下能更好地保持蛋白的特性,导致互作后蛋白质的水结合位点能更好地结合水分子,而喷雾干燥条件下蛋白受到高温的影响,水结合位点的蛋白质变性[18],导致结合水降低。SFD条件下的互作蛋白自由水(T23)峰比例小于SD条件,这表明水分受热蒸发和干燥介质导致水分迁移。这与文献[19]研究结果相一致。此外,SFD条件下的互作蛋白T2峰面积总和大于SD和FD条件,证明SFD能更好地保持蛋白互作后的保水性。
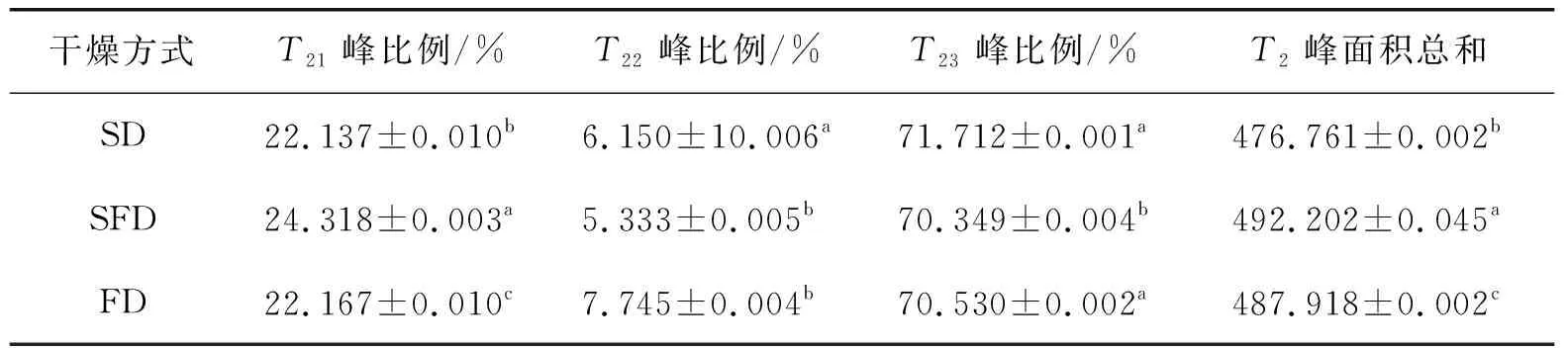
表1 不同干燥方式对蛋白弛豫时间T2变化的影响
3.1.2 FT-IR分析

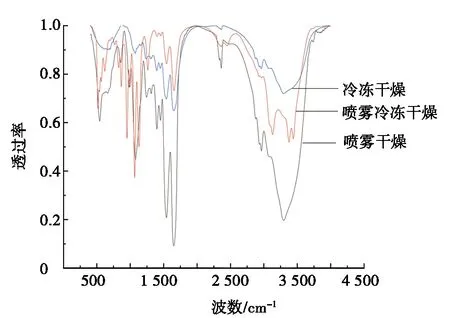
图2 不同干燥方式对OVA和OVM互作的FT-IR谱图
通过Peakfit Version 4.2分别对图2中1 600~1 700 cm-1处的不同干燥方式制得的3种蛋白样品的峰谱图进行去卷积、二阶求导和高斯拟合处理[22],得到表2。由表2可知:SFD条件下蛋白β-折叠大于SD和FD,而β-转角却小于SD和FD,主要原因是SD条件下的OVA和OVM在高温作用下发生了热变性并促进分子间的聚集,β-折叠和β-转角含量增加,且β-折叠在高温下易变成β-转角结构;SD和SFD两种方式的α-螺旋结构基本相同;SFD无规卷曲大于SD和FD,说明其结构的随机性增强。
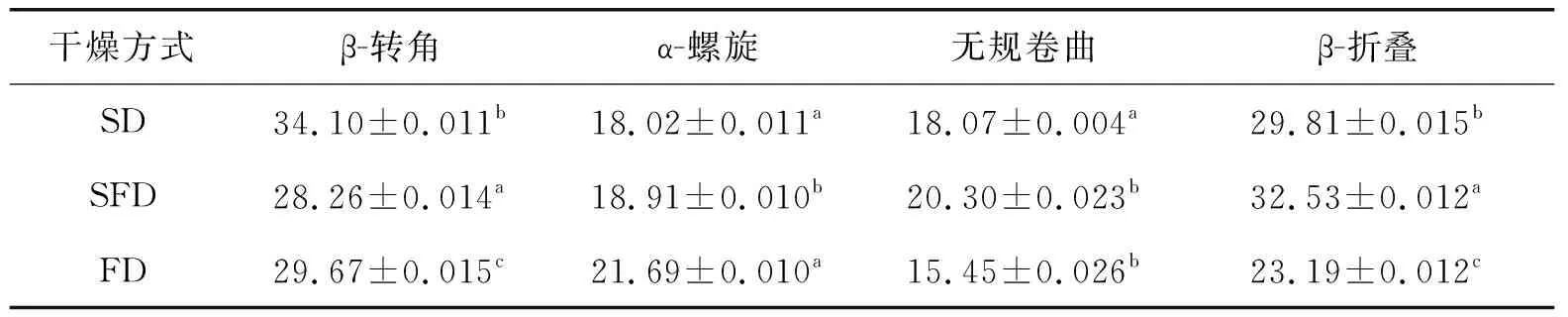
表2 OVA和OVM不同干燥条件下的二级结构含量(红外光谱) %
3.1.3 FS分析
蛋白质大分子具有酪氨酸(Tyr)、色氨酸(Trp)等小分子结构,这些蛋白质可以产生较强的内源性荧光。图3为不同干燥方式对OVA和OVM互作的荧光光谱图。从图3可以看到:OVA和OVM互作后,在SFD条件下,波长336 nm处荧光强度最大为156.80;在SD条件下,波长339.07 nm处荧光强度最大为79.38;在FD条件下,波长336 nm处荧光强度最大为125.79。在波长340nm处荧光峰强度为SFD>FD>SD。SFD条件下蛋白的荧光强度大于FD,SD条件下荧光强度最低,且SD条件下蛋白荧光发射波长出现了轻微红移,其二级结构再次发生改变,可能是干燥的温度会使蛋白质荧光发生猝灭,影响OVA和OVM之间的相互作用。
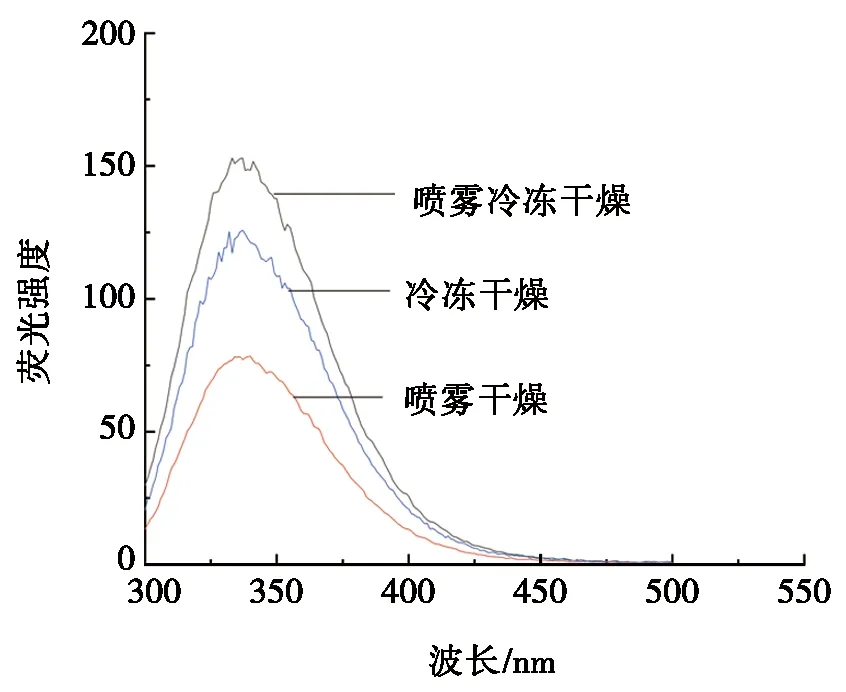
图3 不同干燥方式对OVA和OVM互作的荧光 光谱图
3.1.4 DSC分析
表3为不同干燥方式对OVA和OVM互作的热力学影响。由表3可知:SD、SFD和FD对OVA和OVM互作后热变形温度分别为100.31 ℃、48.94 ℃、46.46 ℃,热焓值分别为161.01 J/g、15.47 J/g、17.95 J/g,SFD蛋白的峰值温度比SD低51.37 ℃,与FD接近,热稳定性为:SD>SFD≈FD,其聚集程度大小顺序为:SD>SFD≈FD,这可能是因为经过不同的干燥方法处理后,两种蛋白之间的结构断裂,非共价键数目不同[23],导致其热稳定性发生变化,干燥温度使蛋白的氢键结构发生变化,导致其热焓值发生变化。
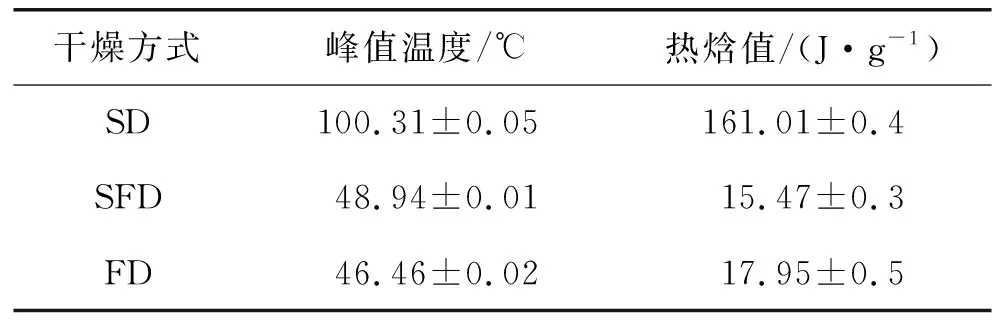
表3 不同干燥方式对OVA和OVM互作的热力学影响
3.1.5 SEM分析
图4为不同干燥方式对OVA和OVM互作的SEM图。由图4可知:SD蛋白的表面出现许多孔隙,且大小不一,凹凸不平,蛋白分子排列较紧密,成条、成簇,加深了其聚集程度[24];SFD蛋白呈现外形完整、颗粒大小较为不规则的球状圆形外部结构,内部空间呈网络结构;FD蛋白结构断面不平整,多层结构,大小不一,聚集成条、成片。这是因为雾化过程中,微小的液滴被瞬间冻结,在喷雾塔飘落的过程中,其中的水分被瞬间冻干形成冰晶,并由于升华的作用被移除,同时也会使样品产生一些微孔通道,正是因为这些结构,使比表面积增大,大大提高蛋清蛋白的起泡性[25]。

(a) SD
3.2 SFD对OVA和OVM互作后功能特性的影响
3.2.1 乳化性、溶解性、起泡性和泡沫稳定性的变化
表4显示了不同干燥方式对OVA和OVM互作后乳化性、溶解性、起泡性和泡沫稳定性的影响。乳化性代表了蛋白乳化的程度,SFD蛋白乳化性要优于SD,这可能是因为SD处理下温度作用引起较高水平的蛋白质展开所致[26]。FD处理下温度较低,对蛋白结构破坏较大,使其乳化性降低。溶解度反映冲调性能的好坏,SFD蛋白溶解度大于SD,略大于FD,这是在低温环境下,SFD蛋白无法聚集或聚集遭到破坏,使得蛋白质与其他物质形成的复合物分散开来,这样溶液中可溶性蛋白质的含量增加[27]。起泡性反映泡沫的发泡程度,SFD蛋白起泡性和泡沫稳定性大于SD,接近FD,这可能是因为SFD使蛋清蛋白变得更加分散,折叠蛋白能更好地打开,可溶性蛋白含量增加,而不溶解的蛋白质能在气泡周围形成厚黏性层,使泡沫不易破碎,增大泡沫的稳定性[28]。
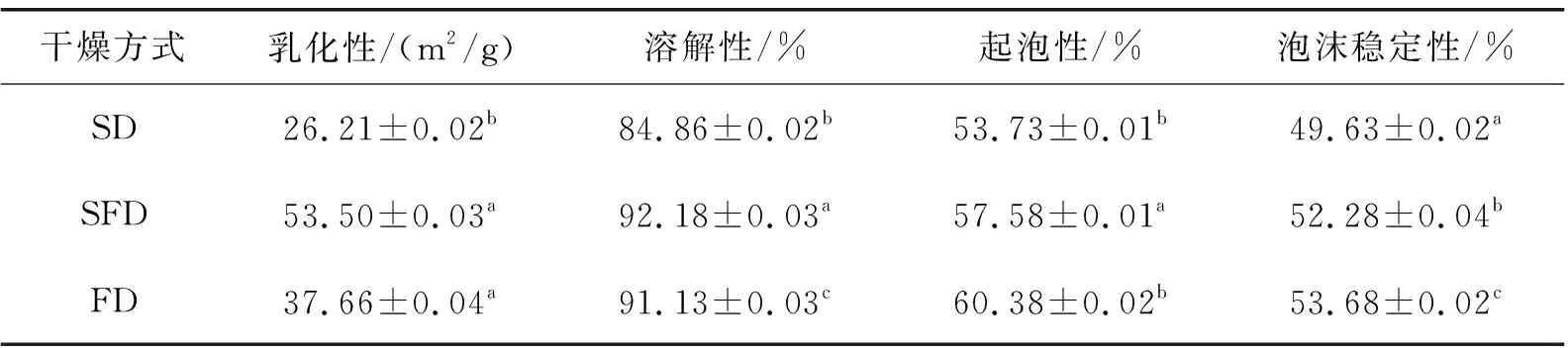
表4 不同干燥方式对OVA和OVM互作后乳化性、溶解性、起泡性和泡沫稳定性的影响
3.2.2 静态流变扫描分析
图5为不同干燥方式对OVA和OVM互作表观黏度(ηa)的影响。由图5可知:不同干燥条件下OVA和OVM的表观黏度均随着剪切速率的增大而降低,当剪切速率大于110 s-1时,表观黏度反而有轻微上升幅度。总体上,FD蛋白和SFD蛋白变化趋势一致,SD蛋白比SFD蛋白和FD蛋白的表观黏度大,这是因为SD处理后,温度较高,蛋白质分子发生热变性聚集,原来规则有序的分子结构也变得混乱无序,分子之间的摩擦阻力增大,流动阻力大,所以表观黏度比其他两种样品大[29]。
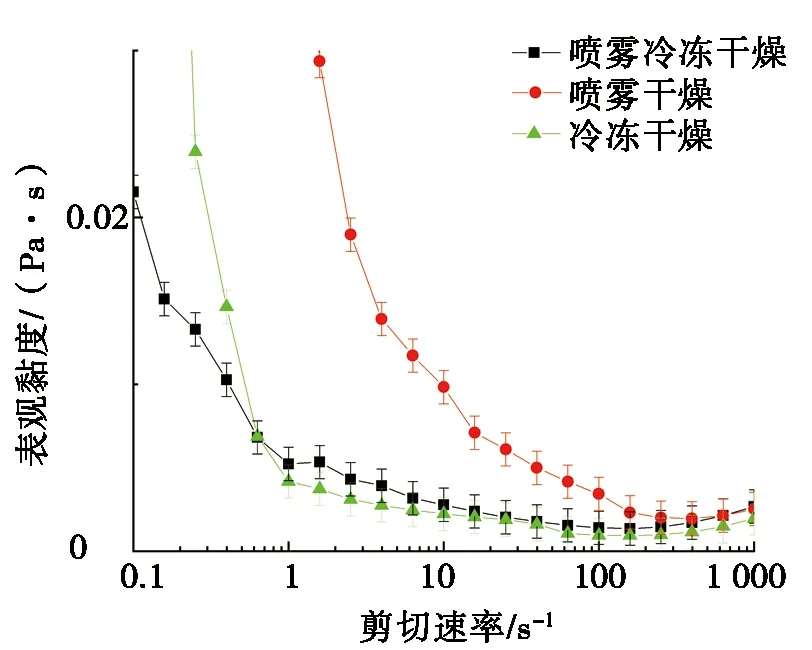
图5 不同干燥方式对OVA和OVM互作表观 黏度的影响
3.2.3 动态频率扫描分析
图6为不同干燥方式下OVA和OVM互作后G′、G″随频率变化关系。由图6可知:随着角频率逐渐上升,不同干燥方式下OVA和OVM的储能模量G′和损耗模量G″也表现出逐步上升的趋势,且在同频率下G′值都高于G″值,这说明两种干燥方式下的蛋白溶液都有凝胶状的性质,网络结构良好[30]。3个样品在0~10 Hz的低频率内,G′和G″缓慢上升,达到10 Hz后上升的趋势变快。在频率增大的过程中,3个样品的G′和G″的变化基本趋向一致。在高频区G′的稳定性大小为SFD>FD>SD,可能是因为干燥温度的变化,使蛋白质变成凝胶网络结构,产生切流变行为,进一步验证干燥方式影响蛋白质的凝胶网络结构[31]。
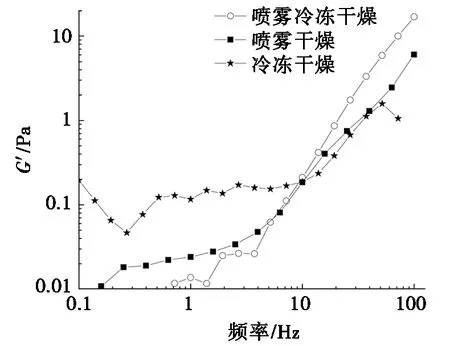
4 结论
与SD和FD相比,SFD对OVA和OVM互作的蛋白结构和功能特性有很大影响。OVA和OVM互作蛋白自由水减少,结合水增加,保水性增强;二级结构发生改变,随机性更强;在波长340 nm处荧光峰强度为SFD>FD>SD;热稳定性为SD>SFD≈FD;在结构上更加规则,呈颗粒较大的球状结构,内部空间网络结构,蛋白聚集程度小。
SFD蛋白的乳化性、溶解性和起泡性与FD蛋白接近,优于SD蛋白,且SFD蛋白比SD蛋白的表观黏度小,SFD蛋白储能模量最大。考虑到FD成本过高,所以SFD更适合加工生产。通过了解OVA和OVM相互作用,可以为蛋清蛋白在干燥过程中功能特性的变化提供一定的理论基础,未来将进一步研究蛋清中其他蛋白质的相互作用,从而为实际生产提供相应的理论及技术支撑。
