原发性肺黏液腺癌的临床特征及其预后的影响因素研究
2022-01-10赵文艳刘红陈红杰张国瑞余亚丽
赵文艳,刘红,陈红杰,张国瑞,余亚丽
统计数据显示,肺癌发病率位居全球恶性肿瘤第二位,是全球癌症相关死亡的首要原因;2020年,中国新发肺癌81.6万例,占中国新发癌症总病例的17.9%;肺癌死亡71.5万例,占中国癌症死亡总病例的23.8%,肺癌仍位居中国癌症新发及死亡首位[1]。目前,肺腺癌是最常见的肺癌病理分型,约占肺癌患者总数的40%[2]。原发性肺黏液腺癌(primary pulmonary mucinous adenocarcinoma,PPMA)是一种少见的肺腺癌亚型,与非黏液型肺腺癌相比,其具有独特的病理表现,但尚无规范的方案指导其治疗。目前,关于PPMA有许多新观点、新成果,但涉及预后的研究报道较少。本研究回顾性分析2015—2019年郑州大学第一附属医院收治的105例PPMA患者的临床资料及随访资料,总结其临床特征并探讨其预后的影响因素,以期为PPMA患者的临床诊治和预后判断提供一定参考依据。
1 对象与方法
1.1 研究对象 收集郑州大学第一附属医院2015—2019年收治的105例PPMA患者,均经病理学检查确诊。纳入标准:(1)初次诊断为PPMA;(2)既往未接受抗肿瘤治疗;(3)临床资料完整。排除标准:(1)转移性肺黏液腺癌,如原发于消化系统的黏液腺癌转移至肺脏;(2)合并其他类型恶性肿瘤。本研究通过郑州大学第一附属医院伦理委员会审核批准(伦理审批编号:KY-2021-00521)。
1.2 研究方法 回顾性分析所有患者的临床资料,记录患者的性别、年龄、有无吸烟史、有无肿瘤家族史、临床表现、TNM分期、肿瘤标志物表达情况〔包括癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)-125、CA-199、CA72-4、CA-153、细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)及神经元特异性烯醇化酶(neuron specific enolase,NSE)〕、影像学检查结果(包括肿瘤位置、肿瘤大小、肿瘤数目、肿瘤大体形态、CT征象)、淋巴结转移情况、免疫组化染色结果〔包括甲状腺转录因子1(thyroid transcription factor-1,TTF-1)、Napsin A、细胞角蛋白(cytokeratin,CK)7、CK20、CDX2〕、分子表型〔包括表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变、KRAS基因突变及间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因重排情况〕及治疗方式。TNM分期参考国际肺癌研究协会(the International Association for the Study of Lung Cancer,IASLC)第八版肺癌分期标准[3-5]。本研究通过复诊和电话随访等方式随访患者的生存状态,终点事件为死亡,随访截止时间为2021年5月。
1.3 统计学方法 应用SPSS 23.0统计学软件进行数据处理。计数资料以相对数表示;采用Kaplan-Meier法计算累积生存率,并绘制生存曲线,累积生存率的比较采用log-rank检验;PPMA患者预后的影响因素分析采用多元Cox比例风险回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征 105例PPMA患者中男42例(40.0%),女63例(60.0%)。中位年龄60岁,其中<60岁52例(49.5%),≥60岁53例(50.5%)。有吸烟史25例(23.8%),无吸烟史80例(76.2%)。有肿瘤家族史21例(20.0%),无肿瘤家族史84例(80.0%)。临床表现:有临床表现83例(79.0%),其中咳嗽、咳痰39例,胸闷、胸痛19例,咯血15例,发热10例;无临床表现22例(21.0%)。TNM分期:Ⅰ期20例(19.0%),Ⅱ期15例(14.3%),Ⅲ期24例(22.9%),Ⅳ期46例(43.8%)。肿瘤标志物表达情况:升高51例(48.6%),其中CEA升高(>5 μg/L)23例、CA-125升高(>35 U/ml)23例、CA-199升高(>37 U/ml)25例、CA72-4升高(>6.9 U/ml)17例、CA-153升高(>25 U/ml)6例、CYFRA21-1升高(>3.3 μg/L)24例、NSE升高(>25 μg/L)5例;正常54例(51.4%)。肿瘤位置:下叶55例(52.4%),中上叶50例(47.6%);肿瘤大小:≤3 cm 46例(43.8%),>3 cm 59例(56.2%);肿瘤数目:单发病灶91例(86.7%),多发病灶14例(13.3%);肿瘤大体形态:结节或团块样阴影68例(64.8%),大片状实变影37例(35.2%),其中23例误诊为肺炎、2例误诊为肺结核。CT征象:支气管充气征27例(25.7%),空洞18例(17.1%),毛刺征17例(16.2%),分叶征13例(12.4%),血管造影征8例(7.6%),胸膜凹陷征7例(6.7%)。有淋巴结转移33例(31.4%),无淋巴结转移72例(68.6%)。免疫组化染色结果:TTF-1表达阳性39例(37.1%),Napsin A表达阳性39例(37.1%),CK7表达阳性65例(61.9%),CK20表达阴性93例(88.6%),CDX2表达阴性97例(92.4%)。分子表型:EGFR基因突变3例(2.9%),KRAS基因突变36例(34.3%),ALK基因重排13例(12.4%)。治疗方式:全身化疗75例(71.4%),手术治疗45例(42.9%),靶向治疗29例(27.6%),介入治疗10例(9.5%),放疗6例(5.7%),免疫治疗4例(3.8%)。
2.2 PPMA患者预后及其影响因素 105例PPMA患者1、3、5年累积生存率分别为80.8%、62.9%、42.1%,中位生存时间为56个月,见图1。不同性别、有无吸烟史、有无肿瘤家族史、有无临床表现、不同肿瘤位置、不同肿瘤数目、不同肿瘤大体形态、不同TTF-1表达情况、不同Napsin A表达情况、不同CK7表达情况、不同CK20表达情况、不同CDX2表达情况、有无KRAS基因突变及有无ALK基因重排患者5年累积生存率比较,差异无统计学意义(P>0.05);不同年龄、TNM分期、肿瘤标志物表达情况、肿瘤大小及有无淋巴结转移的PPMA患者5年累积生存率比较,差异有统计学意义(P<0.05),见表1。将表1中差异有统计学意义的指标及KRAS突变、ALK重排作为自变量,将PPMA患者的预后(赋值:生存=0,死亡=1)作为因变量,进行多元Cox比例风险回归分析,结果显示,年龄、TNM分期、肿瘤大小、淋巴结转移是PPMA患者预后的独立影响因素(P<0.05),见表2。
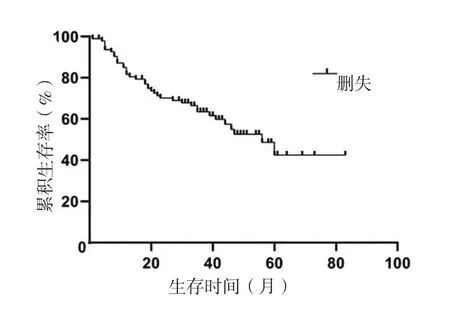
图1 PPMA患者的生存曲线Figure 1 Survival curve of patients with PPMA
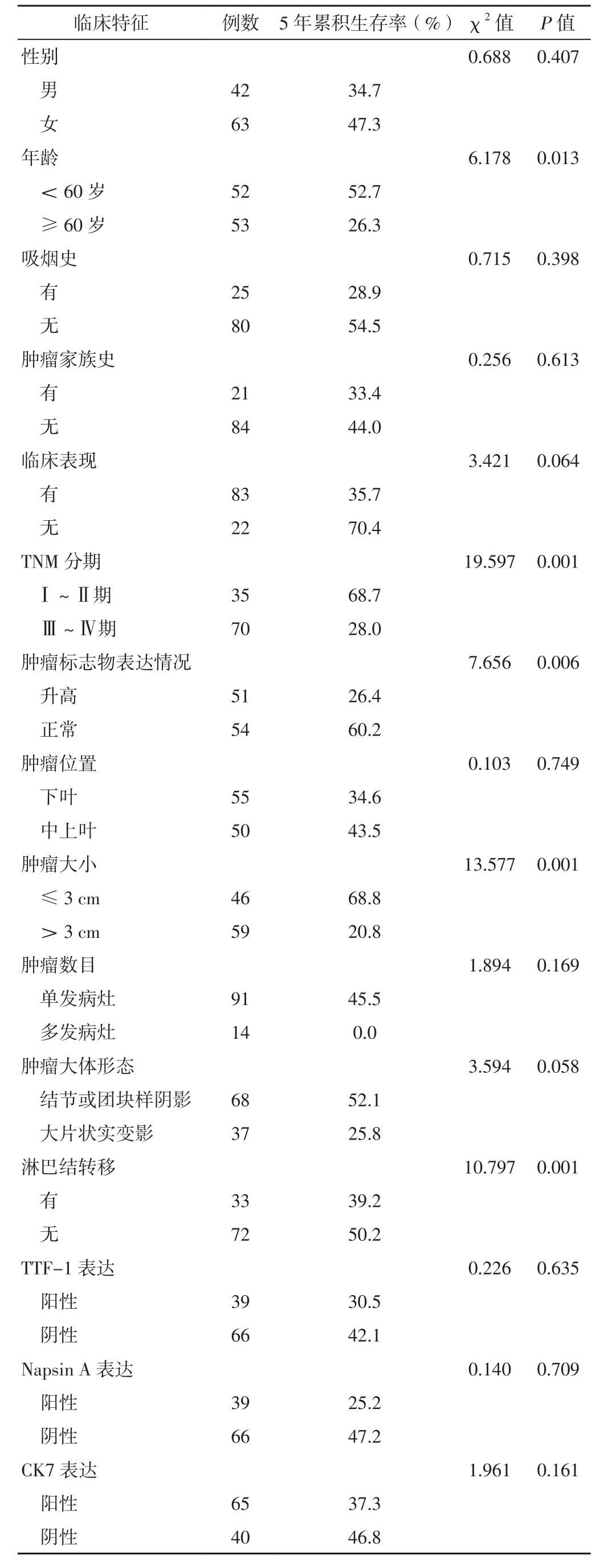
表1 不同临床特征的PPMA患者5年累积生存率比较Table 1 Comparison of 5-year cumulative survival rate in PPMA patients with different clinical characteristics
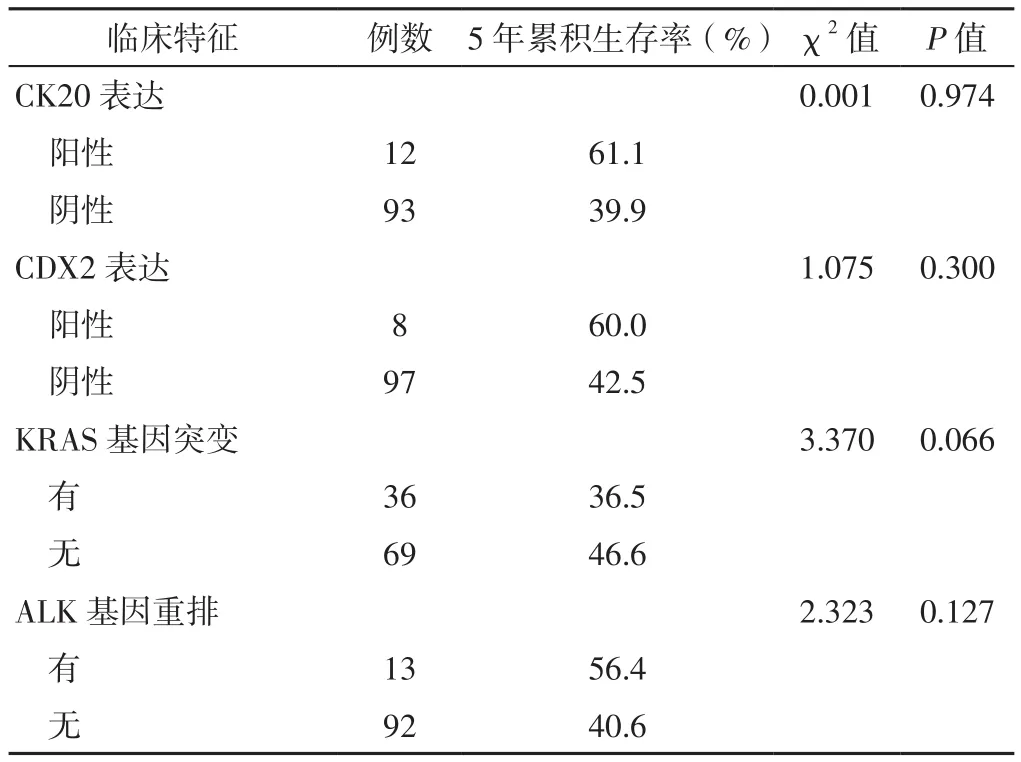
(续表1)
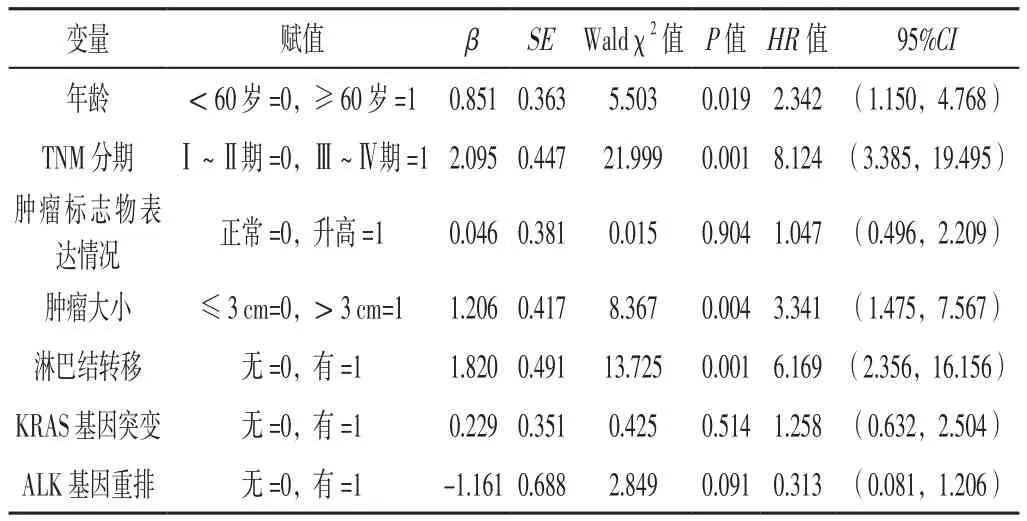
表2 PPMA患者预后影响因素的多元Cox比例风险回归分析Table 2 Multivariate Cox proportional hazards regression analysis of prognostic factors in patients with PPMA
3 讨论
PPMA是一种特殊的肺腺癌病理亚型,其发病率较低,占原发性肺腺癌患者总数的2%~10%[6]。与非黏液型肺腺癌相比,PPMA具有不同的临床病理表现及预后,但目前关于PPMA的大样本量临床研究较少,故临床医生对PPMA的认识尚不足。本研究结果显示,本组PPMA患者中女性多于男性,中位发病年龄为60岁,与既往文献报道一致[7];本研究76.2%的PPMA患者无吸烟史,PPMA与吸烟是否有关目前尚不明确,仍需要大量临床资料证实[8];PPMA与非黏液型肺腺癌的临床表现相似[9],常见的临床表现有咳嗽、咳痰、胸闷、胸痛、咯血、发热等,提示PPMA患者无特异性临床表现;本研究48.6%的PPMA患者肿瘤标志物升高,常见的肿瘤标志物有CEA、CA-125、CA-199、CA72-4、CA-153、CYFRA21-1,肿瘤标志物升高虽然对PPMA的诊断具有一定提示作用,但并无特异性;PPMA在影像学上主要表现为肺部结节或团块样阴影,可有支气管充气征、空洞、毛刺征、分叶征、血管造影征、胸膜凹陷征;少数患者表现为大片状实变影,容易误诊为肺炎、肺结核等良性疾病[10]。因此,在临床工作中,对长期咳嗽、咳大量白色泡沫痰且抗感染治疗效果不佳的肺部大片实变影的中老年患者,应仔细鉴别诊断,积极完善气管镜或肺穿刺活检,以警惕PPMA的发生。本研究下叶和中上叶PPMA患者占比相似,提示PPMA可发生于各个肺叶,无明显规律性,与既往文献报道结果一致[11-12]。
目前,PPMA主要通过病理学检查确诊,大体上肿瘤组织呈灰白色或灰褐色、界限不清、质软、半透明胶冻样;镜下可见柱状或杯状细胞沿肺泡壁生长,肺泡及腺腔内充满黏液,大量肿瘤细胞漂浮在黏液中。PPMA的免疫表型与非黏液型肺腺癌不同,非黏液型肺腺癌患者可见CK7、TTF-1、Napsin A高表达,而PPMA患者可见CK7高表达,部分患者可见TTF-1和Napsin A高表达[13],本研究结果与之相似。此外,还有研究报道,不同亚型PPMA患者TTF-1、Napsin A表达不同,提示不同亚型PPMA的组织学起源可能不同[14],但本研究未进一步分析不同亚型PPMA患者的免疫表型。
黏液腺癌常发生于胃肠道,肺部原发少见,因此,需要行免疫组化检查以鉴别诊断PPMA与转移性胃肠道黏液腺癌。转移性胃肠道黏液腺癌患者CK20、CDX2呈高表达,TTF-1、Napsin A表达阴性。但有研究报道,部分PPMA患者可表达CK20、CDX2[15-16],这就使TTF-1、Napsin A表达阴性的PPMA患者与转移性胃肠道黏液腺癌鉴别困难,需结合影像学、胃肠镜等检查以排除胃肠道肿瘤。本研究中61.9%的PPMA患者CK7表达阳性,37.1%的PPMA患者TTF-1、Napsin A表达阳性,88.6%的患者CK20表达阴性。本研究结果显示,PPMA患者EGFR基因突变发生率为2.9%,而KRAS基因突变发生率为34.3%,与既往文献报道结果相符[17]。KRAS基因突变者对EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)类药物耐药,且目前暂无针对KRAS基因突变的靶向药物,故针对KRAS基因突变的PPMA患者优先选择早期手术治疗或全身化疗。ALK基因重排者可应用克唑替尼、阿来替尼等ALK-TKI类药物进行治疗[18]。近年来,随着分子生物学不断发展,新的治疗靶点、靶向药物正在研究,有望在未来为PPMA患者的治疗带来新的希望。
本研究对105例PPMA患者进行随访,结果显示,1、3、5年累积生存率分别为80.8%、62.9%、42.1%,中位生存时间为56个月,且年龄、TNM分期、肿瘤大小、淋巴结转移是PPMA患者预后的独立影响因素,与既往文献报道结果一致[10],究其原因可能与高龄患者常合并其他基础疾病及晚期、肿瘤较大、合并淋巴结转移的PPMA患者不能行手术治疗等相关。SHIMIZU等[19]、WANG等[20]研究表明,肺炎型PPMA患者较结节肿块型PPMA患者预后更差,这可能与肺炎型PPMA患者淋巴结转移发生率较高有关[21]。TTF-1在人胚胎肺组织及成年人肺组织中持续表达,在维持肺正常发育及功能中发挥着重要作用[22-24]。HWANG等[6]、KUEI-PIN等[25]研究表明,TTF-1表达阴性与PPMA患者预后不良相关,其原因为TTF-1表达缺失提示肿瘤分化差,发生种植及转移的能力更强。但本研究并未发现肿瘤大体形态、TTF-1与PPMA患者预后相关,究其原因可能与研究人群及样本量不同有关。KRAS基因突变与肺腺癌预后的关系目前仍存在争议。DAQUAN等[26]研究表明,KRAS基因突变是早期肺腺癌患者预后不良的危险因素;而 PETRA 等[27]、MACERELLI等[28]研究表明,KRAS基因突变不影响肺腺癌患者的预后。本研究结果显示,KRAS基因突变对PPMA患者生存状况无明显影响,与YANG等[29]研究结果一致。
综上所述,PPMA好发于中老年女性,无特异性临床表现,主要影像学表现为结节或团块样阴影。本组PPMA患者1、3、5年累积生存率分别为80.8%、62.9%、42.1%,中位生存时间为56个月,且年龄、TNM分期、肿瘤大小、淋巴结转移是PPMA患者预后的独立影响因素。但本研究为单中心、回顾性研究,未来仍需要进行多中心、前瞻性的随机对照研究进一步证实本研究结论。
作者贡献:赵文艳、陈红杰进行文章的构思与设计,负责文章的质量控制及审校;赵文艳、刘红、张国瑞、余亚丽进行研究的实施与可行性分析;赵文艳、刘红、陈红杰、张国瑞、余亚丽进行数据收集、整理、分析;赵文艳进行结果分析与解释,负责撰写、修订论文;刘红对文章整体负责,监督管理。
本文无利益冲突。
