侵袭性功能性垂体腺瘤患者低氧诱导因子 1α诱导血管生成相关基因的表达及临床意义
2022-01-10岳成石文健刘永亮李景武张于董桂兰张欢董伟
岳成,石文健,刘永亮,李景武,张于,董桂兰,张欢,董伟
垂体瘤是仅次于胶质瘤和脑膜瘤的第三大中枢神经系统原发肿瘤,约占脑肿瘤的15%,且约1/3的垂体瘤具有侵袭性,可向周围组织侵袭[1-2]。功能性垂体腺瘤是垂体瘤的最常见病理亚型,主要包括泌乳素腺瘤、生长激素腺瘤及促性腺激素腺瘤,其是由激素分泌过多引起的一系列症状,可增加心脑血管疾病、呼吸系统疾病发生风险,进而严重影响人们的生命健康[3]。垂体腺瘤常会侵袭蝶窦、海绵窦或硬膜上,并表现出较高的侵袭性、增殖率,且短期内复发风险较高[4]。肿瘤微环境在实体肿瘤的发生发展及转移过程中具有重要作用,低氧环境作为肿瘤微环境的特征之一,与多种肿瘤侵袭性和预后不良相关,原因可能为低氧环境影响血管生成、基因组不稳定和药物抵抗[5-6]。低氧诱导因子 1α(hypoxia inducible factor 1 alpha,HIF-1α)是肿瘤细胞生长过程中的重要调控因子,具有非氧依赖调控通路,可增加血管生成生长因子的转录活性及血管内皮生长因子(vascular endothelial growth factor,VEGF)和表皮生长因子(epidermal growth factor,EGF)的表达[7-8]。研究表明,大部分垂体腺瘤患者均有HIF-1α表达且其水平与肿瘤的侵袭性密切相关[9]。本研究旨在分析侵袭性功能性垂体腺瘤患者HIF-1α诱导血管生成相关基因的表达及临床意义,以期为侵袭性功能性垂体腺瘤的药物治疗提供新的思路和理论依据。
1 资料与方法
1.1 一般资料 选取2016年1月至2020年9月唐山市人民医院神经外科门诊收入院并接受手术治疗的功能性垂体腺瘤患者58 例,其中生长激素腺瘤26例、泌乳素腺瘤32例、促性腺激素腺瘤0例。根据Hardy-Wilson分级和Knosp分类方法[10-11]将其分为侵袭性组(n=28)和无侵袭性组(n=30)。排除标准:(1)合并精神障碍者;(2)妊娠期妇女;(3)近3个月内参加过其他临床试验者;(4)合并其他肿瘤者。本研究经唐山市人民医院伦理委员会审核批准(批件编号:RMYY-LLKS-2020-004)。
1.2 诊断标准 功能性垂体腺瘤必须满足(2)、(4),且(3)中至少一项,具体如下:(1)临床症状和体征:①占位症状:头痛、视力下降、视野缺损。②内分泌症状。包括内分泌亢进症状:肢端肥大、面容改变、骨质疏松、肥厚型心肌病、打鼾或睡眠呼吸暂停、高血压、糖尿病、高脂血症;高泌乳素血症症状:男性阳痿、性欲下降、不育,女性闭经、溢乳;内分泌功能低下症状;甲状腺功能低下症状:怕冷、黏液性水肿、毛发粗;肾上腺功能低下症状:直立性低血压,易疲倦;性腺功能低下症状:女性停经、无性欲、不孕,男性阳痿、性欲下降。(2)影像学检查:强化MRI证实为垂体瘤。(3)内分泌功能检查:①口服葡萄糖耐量试验显示生长激素>1 μg/L;②胰岛素样生长因子1(insulin-like growth factors 1,IGF-1)高于参考范围上限(以临床检验参考范围为准);③生长激素>2 μg/L;④静息泌乳素(prolactin,PRL)>150 μg/L。(4)免疫组化染色显示PIT-1阳性,生长激素阳性或PRL阳性。并根据血激素水平、临床症状、PIT-1染色结果采用Aperio AT2高通量快速扫描系统(徕卡生物系统)扫描玻片成像。
1.3 临床资料收集 收集所有患者的临床资料,包括年龄、性别、病理类型、有无头痛、有无视野缺损、肿瘤体积、切除程度及肿瘤复发情况。
1.4 免疫组化操作方法
1.4.1 免疫组化试剂和抗体 免疫组化染色工作液购自德国徕卡生物系统有限公司,包括脱蜡液(AR9222)、抗原修复液(AF9640)、 二抗检测系统(DS9800);HIF-1α(兔单克隆抗体,AB263460)、 VEGF-A(兔单克隆抗体,AB52917)、表皮生长因子受体(epidermal growth factor receptor,EGFR)( 兔 单 克 隆 抗 体,AB40815)、CD31(兔单克隆抗体,AB134168)及Ki-67(兔单克隆抗体,ab197234)均购自英国Abcam公司,均为一抗。
1.4.2 组织芯片构建与免疫组化染色 采用3 cm×4 cm规格的包埋盒,制成25 mm×25 mm×5 mm的空白蜡块,在该蜡块中间20 mm×20 mm范围内设计6×10点组织微阵列(tissue microarrays,TMA),采用组织芯片仪打孔(1 mm),孔间距为2 mm,制成TMA模块。从石蜡包埋组织中选取3个核心组织进行活检(直径2.0 mm),将所采核心组织转移到TMA。样本随机排序,每例随机取3个区域打孔,每个模块包含侵袭性和无侵袭性垂体腺瘤各10例,将组织芯片切成4 μm厚度的切片。为了减少抗原损失,芯片载玻片在切割后1周内进行处理。常规免疫组化染色:所有标本切片事先采用HE染色以评估肿瘤细胞含量和质量。将载玻片置于徕卡BOND-Ⅲ全自动免疫组化染色机中检测抗体HIF-1α、VEGFA、EGFR、CD31及Ki-67表达情况。
1.4.3 免疫组化评分 采用徕卡Aperio AT2高通量快速扫描系统扫描玻片成像,根据预实验结果,采用徕卡Aperio AT2和数字切片查看软件计算剩余抗体的最优效价。免疫组化评分=阳性细胞百分数×染色强度评分,染色强度阴性记为0分、弱阳性记为1分、阳性记为2分、强阳性记为3分。
1.5 统计学方法 应用SPSS 22.0统计学软件(IBM公司)进行数据处理。符合正态分布及近似正态分布的计量资料以(±s)表示,组间比较采用成组t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 侵袭性组和无侵袭性组患者临床资料比较 侵袭性组和无侵袭性组患者年龄、性别、病理类型及头痛发生率比较,差异无统计学意义(P>0.05);侵袭性组患者有视野缺损、肿瘤体积≥6.92 cm3、全切及次全切者所占比例及肿瘤复发率高于无侵袭性组,差异有统计学意义(P<0.05),见表1。
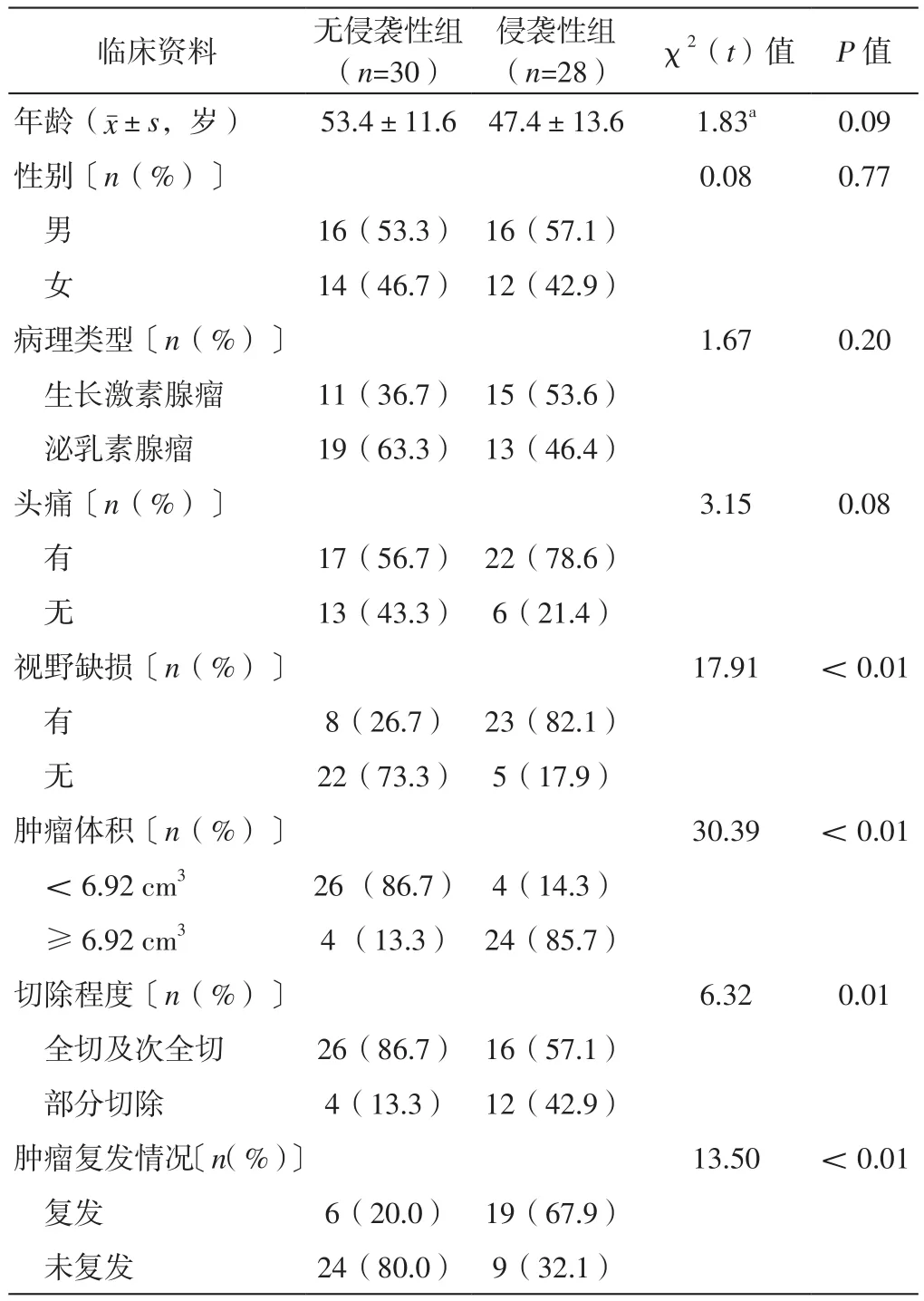
表1 侵袭性组和无侵袭性组患者临床资料比较Table 1 Comparison of clinical information between the invasive group and the non-invasive group
2.2 侵袭性组和无侵袭性组患者HIF-1α、VEGF-A、EGFR、CD31、Ki-67表达情况比较 侵袭性组患者中HIF-1α、VEGF-A、EGFR、CD31、Ki-67高表达者所占比例高于无侵袭性组,差异有统计学意义(P<0.05),见表2。
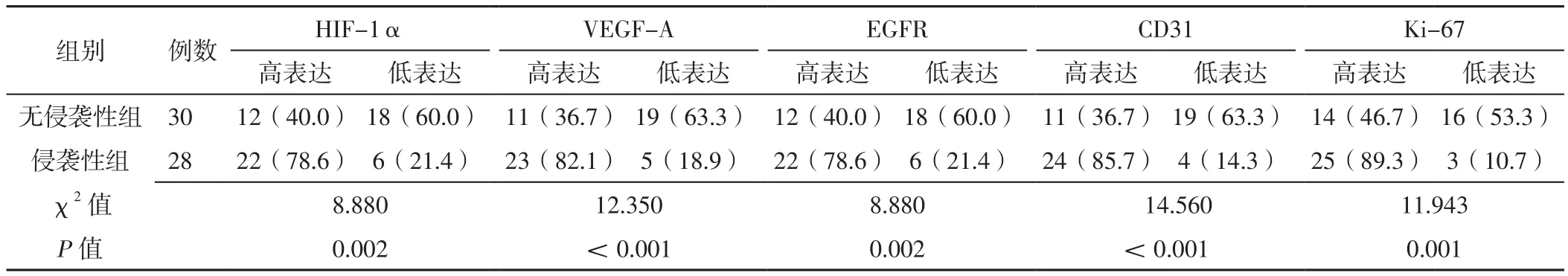
表2 侵袭性组和无侵袭性组患者HIF-1α、VEGF-A、EGFR、CD31、Ki-67表达情况比较〔n(%)〕Table 2 Comparison of expression of HIF-1α,VEGF-A,EGFR,CD31,Ki-67 between the invasive group and the non-invasive group
2.3 侵袭性组和无侵袭性组患者HIF-1α、VEGF-A、EGFR、CD31、Ki-67免疫组化评分比较 侵袭性组患者 HIF-1α、EGFR、VEGF-A、CD31、Ki-67免 疫 组化评分高于无侵袭性组,差异有统计学意义(P<0.05),见表3、图1。
表3 侵袭性组和无侵袭性组患者HIF-1α、VEGF-A、EGFR、CD31、Ki-67免疫组化评分比较(±s,分)Table 3 Comparison of immunohistochemical scores of HIF-1α,VEGF-A,EGFR,CD31,Ki-67 between the invasive group and the non-invasive group

表3 侵袭性组和无侵袭性组患者HIF-1α、VEGF-A、EGFR、CD31、Ki-67免疫组化评分比较(±s,分)Table 3 Comparison of immunohistochemical scores of HIF-1α,VEGF-A,EGFR,CD31,Ki-67 between the invasive group and the non-invasive group
组别 组别 HIF-1α VEGF-A EGFR CD31 Ki-67无侵袭性组 30 145.3±8.9 192.7±8.3 98.3±10.6 147.1±6.7 5.93±0.58侵袭性组 28 197.3±12.0 240.5±7.8 138.7±5.9 206.9±9.5 1.77±0.10 t值 3.483 4.044 3.304 4.566 7.297 P值 <0.001 <0.001 <0.001 <0.001 <0.001
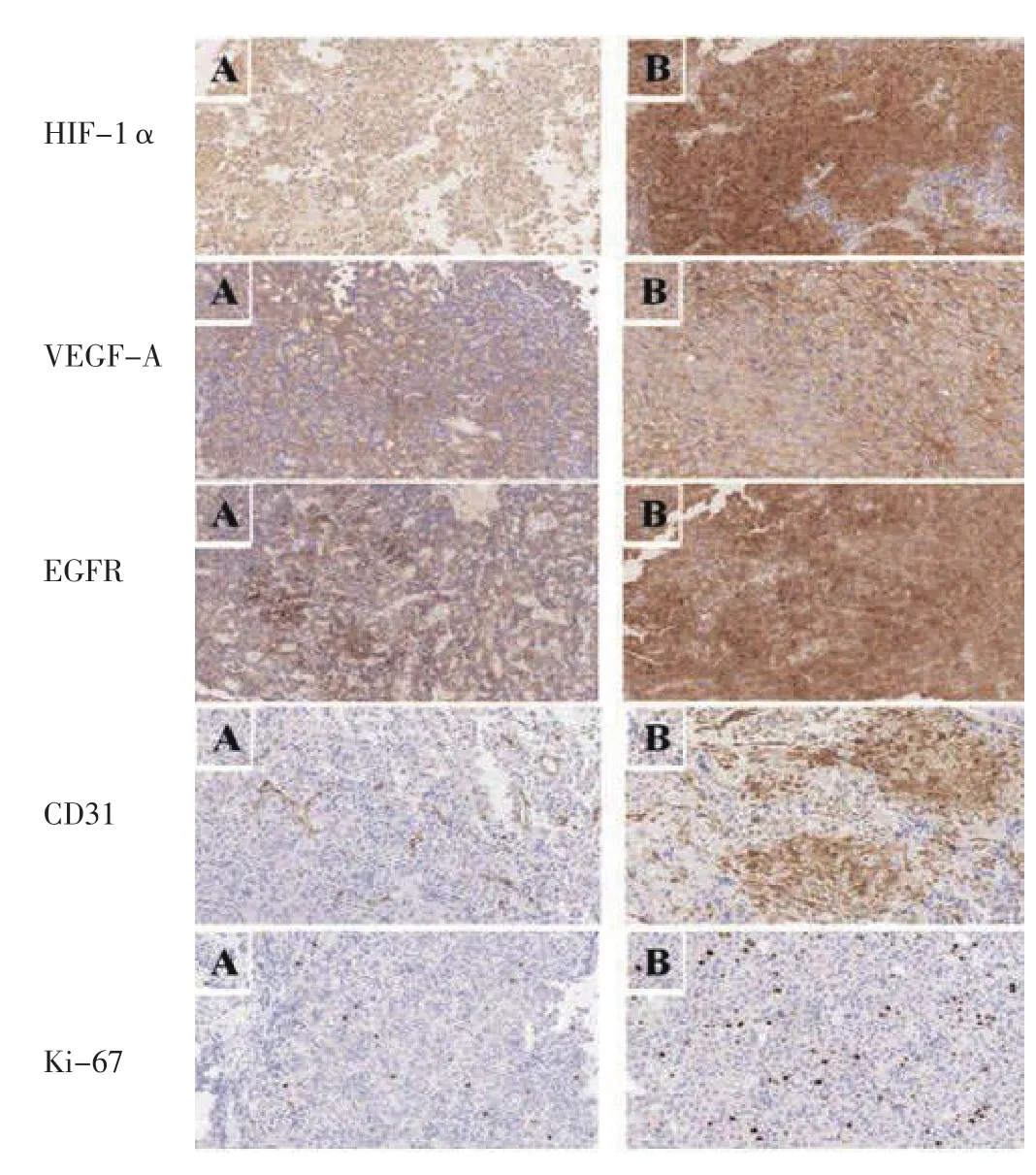
图1 侵袭性组和无侵袭性组患者HIF-1α、VEGF-A、EGFR、CD31、Ki-67的免疫组化染色结果(×400)Figure 1 Immunohistochemical results of HIF-1α,VEGF-A,EGFR,CD31,Ki-67 of the invasive group and the non-invasive group
3 讨论
垂体腺瘤是一种常见的颅内肿瘤,其最常见的亚型是功能性垂体腺瘤。WHO指南推荐,垂体腺瘤的治疗方法为药物治疗和手术综合治疗,但手术切除有难度,术后复发率高,特别是对于侵袭性垂体腺瘤,其是目前导致肿瘤细胞残留、术后复发和药物抵抗的重要因素之一[12-14]。因此,寻找治疗存在药物抵抗的侵袭性功能性垂体腺瘤的方法非常重要。本研究结果显示,侵袭性组和无侵袭性组患者年龄、性别、病理类型及头痛发生率比较差异无统计学意义,但侵袭性组患者有视野缺损、肿瘤体积≥6.92 cm3、全切及次全切者所占比例及肿瘤复发率高于无侵袭性组,但因Hardy-Wilson分级和Knosp分类方法考虑肿瘤体积,故不能完全认为肿瘤体积大小与功能性垂体腺瘤的侵袭性有关,尚有待进一步研究。
肿瘤微环境是由肿瘤细胞及其浸润周边的免疫细胞、新生血管、内皮细胞、成纤维细胞及细胞外基质共同构成[15]。ICGC/TCGA全基因组泛癌分析联盟量化27类1 188种癌症后发现,低氧程度与基因突变频率增加相关,其在肿瘤进展过程中起重要作用[16]。HIF-1是两个碱性螺旋-环-螺旋/PAS蛋白的异源二聚体,包括HIF-1α和HIF-1β。HIF-1α是功能亚基,可促进血管生成。在正常氧浓度下,HIF-1蛋白在细胞内通过氧依赖的泛素蛋白酶降解途径而快速降解[17]。研究表明,HIF-1α的强制过表达足以使哺乳动物细胞周期阻滞在G1期,且HIF-1以与转录无关的方式抑制DNA复制[18-19]。在癌症中,HIF-1α是通过多种信号通路调控多种基因转录,而非依赖氧气水平[20]。各种生长因子通过多种信号级联反应(即PI3K/PTEN/AKT通路或RAS/RAF/MAPK通路)而调节HIF-1α的表达[21]。与血管丰富的正常脑垂体相比,垂体腺瘤具有较低的血管密度,但肿瘤内的缺氧条件仍可激活一些诱导途径,导致血管密度增加或更有序的微血管几何形状,以维持肿瘤生长[22]。本研究结果显示,侵袭性组患者中HIF-1α高表达者所占比例和HIF-1α免疫组化评分高于无侵袭性组,提示侵袭性功能性垂体腺瘤患者存在HIF-1α高表达情况。
血管重构是机体发育和适应缺氧等不利环境的基本生理过程,VEGF可促进血管生成和新血管微血管网络的重建[14,23]。缺氧可诱导VEGF表达上调,其程序如下:由HIF-1α驱动,通过上调血管生成因子(如VEGF-A)可增加血管生成的氧气供应[24]。本研究结果显示,侵袭性组患者中VEGF-A高表达者所占比例和VEGF-A免疫组化评分高于无侵袭性组,提示侵袭性功能性垂体腺瘤患者存在VEGF-A高表达情况。
EGFR是一种致癌蛋白,在多种实体肿瘤中其具有促进肿瘤发生、发展的作用。EGFR是酪氨酸激酶受体ErbB家族成员之一,EGFR的激活启动了一系列下游信号通路。生长因子和EGFR家族的功能激活可发生于多数上皮细胞癌,抑制EGFR信号可导致癌细胞周期阻滞和凋亡[25],故EGFR已成为肿瘤治疗的重要靶点[26]。研究表明,表皮生长因子样结构域7(epidergrowth factor-like domain 7,EGFL7) 水 平 与EGFR激活程度呈正相关,而敲低EGFL7可有效抑制GH3和GT1-1细胞株中EGFR信号级联反应的激活[27]。本研究结果显示,侵袭性组患者中EGFR高表达者所占比例和EGFR免疫组化评分高于无侵袭性组,提示侵袭性功能性垂体腺瘤患者存在EGFR高表达情况。
综上所述,侵袭性功能性垂体腺瘤患者HIF-1α、VEGF-A、EGFR呈高表达,其机制可能为低氧环境下HIF-1α表达增加后上调VEGF-A、EGFR表达,从而促进血管生成,增加肿瘤侵袭性。因此,抑制血管生成治疗可能为垂体肿瘤靶点药物研究提供新的思路。但本研究样本量较小,所得结论仍有待大样本量、更深入的功能学及动物实验进一步验证。
作者贡献:董伟进行文章的构思与设计,并对文章整体负责、监督管理;张欢进行数据收集、整理、分析;张于、董桂兰进行结果分析与解释;岳成撰写并修订论文;石文建、刘永亮、李景武负责文章的质量控制及审校。
本文无利益冲突。
