猪NOX1基因启动子区转录因子的筛选与鉴定
2021-12-23李忠秋何鑫淼王文涛唐晓东张冬杰
汪 亮,李忠秋,何鑫淼,王文涛,唐晓东,刘 娣,张冬杰*
(1.黑龙江省农业科学院,黑龙江 哈尔滨 150086;2.农业农村部种养结合重点实验室,黑龙江 哈尔滨 150086)
还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NADPH oxidase,NOX)是一个多基因家族,目前已知有7名成员,包括NOX1~5和Duo x1~2,其中NOX2是最早发现的。NOX是一种由多个蛋白质亚基组成的复合物,其主要亚基就是NOX2(gp91-phox),NOX2特异表达于吞噬细胞,参与机体抗感染免疫防御[1]。后来,人们在非吞噬细胞中发现了gp91-phox的同源分子,即NOX1,它可在多个组织中表达,如大肠、前列腺、子宫和睾丸等。在血管平滑肌细胞中含量较高,许多刺激物如血小板衍生生长因子(platelet derived growth factor,PDGF),前列腺素 F2α(prostaglandin F2α,PG F2α)等均能诱导NOX1 mRNA 的表达增加[2]。将该基因在小鼠成纤维细胞NIH3T3过表达后,细胞内活性氧(reactive oxygen species,ROS)的产出增加,细胞增殖明显,并在细胞团中形成血管[3]。细胞较高的ROS水平一般与恶性转化有关,肿瘤细胞的ROS水平通常都会高于非肿瘤细胞。因此,NOX1与肺病、心血管系统疾病和肿瘤等疾病相关,不仅参与组织氧化损伤,还与组织中的炎症反应有关[4]。
本课题组发现6月龄雌性民猪在遭受-15℃持续14 d的冷处理后,其背部皮下脂肪内的NOX1基因转录水平与对照组相比发生了5.9倍的上升,推测其可能受低温环境诱导,并在脂肪细胞的新陈代谢中发挥作用。为了后续解析NOX1受低温诱导的分子机理,本研究拟利用双荧光素酶报告系统筛选调控其转录的分子元件,探讨其转录调控机制。
1 材料与方法
1.1 材料猪基因组DNA和PK15细胞系由本实验室保存;限制性核酸内切酶KpnⅠ、Hind Ⅲ和pMD18-T 载体、T4连接酶等购自TaKaRa公司;胶回收试剂盒(EG101-02)购自北京全式金生物公司;无内毒素质粒提取试剂盒购自天根生化科技有限公司;pGL3-Basic载体和双荧光素酶检测试剂盒购自Promega;脂质体2000购自Invitrogen。
1.2 引物设计与PCR扩增根据NCBI数据库中已有的猪NOX1基因组序列(NC_010461)设计引物1618S和1618A,扩增-1 618~-1 bp区间(将起始密码子“A”的位置定义为1)。1618S:5′-GGTACCACAATCTCATGTT CTCACCT-3′,16-18A:5′-AAGCTTTGTCAAGAGGTGTTTTGG-3′。下划线表示人为添加的酶切位点,分别为KpnⅠ和Hind Ⅲ。PCR反应体系为:DNA(50 mg/L)1 μL;2×PCR Mix 10 μL;上下游引物(10 μmol/L)各0.5 μL;去离子水补齐至20 μL。反应条件:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 2 min,30个循环;72℃ 5 min;16℃ 30 min。PCR反应结束后,使用1%的琼脂糖凝胶电泳检测PCR产物,凝胶成像系统观察、记录。
1.3 克隆测序严格按照胶回收试剂盒的说明书操作,将回收后的PCR产物连入pMD18-T载体,转入DH5α感受态细胞后,经挑菌、摇菌和提质粒后获得pMD18-NOX1质粒。使用KpnⅠ和Hind Ⅲ双酶切鉴定。双酶切体系为:KpnⅠ和Hind Ⅲ各0.5 μL,10×Buffer 1 μL,质粒4 μL;去离子水4 μL。37℃酶切15 min。酶切结束后使用1%琼脂糖凝胶电泳检测,选取含有目的条带的菌落送至北京擎科生物科技有限公司测序。使用DNAMAN 7.0软件对测序结果进行分析。
1.4 荧光素酶报告基因质粒构建将正确连入NOX1基因的pMD18-NOX1质粒与pGL3-Basic载体分别同时使用KpnⅠ和Hind Ⅲ双酶切,回收目的片段,使用T4连接酶将NOX1片段与pGL3-Basic载体相连接,转化至DH5α感受态细胞中,在含有氨苄的LB固体培养基中筛选重组质粒,经挑菌、摇菌、菌液PCR、双酶切、测序验证后,提取无内毒素的pGL3-Basic-1618质粒,-20℃保存备用。
1.5 PK15细胞的体外培养在含有10%胎牛血清、90% DMEM培养基、链霉素(100 U/mL)和青霉素(100 U/mL)中培养PK15细胞并置于5% CO2、37℃的饱和湿度培养箱中,待细胞生长汇合至85%~90%且呈伸展状态时,用0.25%胰蛋白酶充分消化10~15 min,以胎牛血清终止消化,传代于24孔板中,过夜培养,第2天进行转染试验。

1.7 NOX1基因启动子核心区鉴定以获得的-1 618~-1 bp片段为基序列,下游引物不变,单独设计上游引物,每条引物之间相差300 bp左右,5′端均引入KpnⅠ酶切位点(表1),共组成12对引物。以pMD18-T-NOX1为模板,分别进行PCR扩增,将大小正确的扩增片段回收,分别连入pMD18-T载体,测序验证正确后,将其从载体中双酶切下来,连入pGL3-Basic载体,转染入PK15细胞,进行荧光素酶活性检测。

表1 扩增截短型启动子所用引物信息
1.8 NOX1基因启动子区调控元件鉴定为保证预测的准确性,分别在JASPAR(http://jaspar.genereg.net)、ALGGEN(http://alggen.lsi.upc.es/)和Tfsitescan(http://www.ifti.org/Tfsitescan/)网站对NOX1基因的启动子区进行调控元件的预测。同时结合不同片段荧光素酶活性的测定结果,预测调控因子的结合位点。使用重叠延伸PCR技术将这些预测的结合位点进行缺失突变,所用引物序列见表2。以第1组引物M-1149-a2(A)和M-1149-a3(S)为例,第一轮反应以1149S和M-1149-a2(A)、M-1149-a3(S)和1618A引物对扩增,第二轮反应以第一轮反应获得的2个片段为模板,使用1149S和1618A引物对进行拼接扩增,将缺失突变引入产物内部。将扩增产物采用同上的方法连入pGL3-Basic载体,荧光素酶活性的测定也同上。

表2 突变调控元件所用引物信息
2 结果
2.1 NOX1基因启动子区的扩增与鉴定利用引物1618S和1618A进行PCR扩增,琼脂糖凝胶电泳检测后在1 618 bp左右发现目的条带,经测序验证后表明所扩增的片段为猪的NOX 1基因启动子区(图1A)。
2.2 pGL3-Basic-1618荧光素酶报告基因质粒的构建利用Kpn Ⅰ和 Hind Ⅲ对pMD18-T-NOX1质粒及pGL3-Basic空载体进行双酶切处理,将纯化后的目的片段连入线性化载体得到重组质粒pGL3-Basic-1618。对pGL3-Basic-1618质粒双酶切(图1B)、测序鉴定后表明该片段正确的连入了pGL3-Basic载体。

A.NOX1基因的PCR扩增结果;B.NOX1重组质粒的双酶切结果;M.DL2000 DNA Marker;M1.DL4000 DNA Marker;1.重组质粒图1 NOX1基因的PCR扩增及双酶切鉴定结果
2.3 pGL3-Basic-1618质粒的荧光素酶活性检测将pGL3-Basic-1618无内毒素质粒转染入PK15细胞中,24 h后检测荧光素酶活性,结果显示1618(图2)片段与空载体相比,荧光素酶相对活性显著升高,表明该片段含有转录因子结合位点,具有转录调控功能。

图2 pGL3-Basic-1618荧光素酶活性分析
2.4 NOX1基因启动子区系列截短序列载体的构建以pMD18-T-NOX1片段为模板,利用12条截短序列的上游引物与1618A配对,共扩增出12条长度不同的片段。将这些片段分别与pMD18-T载体相连,经测序验证后,从T载体上将目的片段切下,分别连入pGL3-Basic载体,构建12个报告基因重组载体,分别为pGL3-Basic-1326、pGL3-Basic-1251、pGL3-Basic-1185、pGL3-Basic-1149、pGL3-Basic-1091、pGL3-Basic-1052、pGL3-Basic-968、pGL3-Basic-834、 pGL3-Basic-719、pGL3-Basic-325、pGL3-Basic-208和pGL3-Basic-115。经双酶切(图3)和测序验证后表明目的片段均正确连入pGL3-Basic载体。
2.5 系列截短序列的双荧光素酶活性分析第一轮荧光素酶活性分析主要是从1618 bp片段至325 bp 片段,区间间隔大约为300 bp长度,共检测了5个片段的荧光素酶活性(图4)。根据荧光素酶的相对活性,发现1 618 bp片段截短至1 326 bp后,启动子活性无显著变化,说明-1 618~-1 326 bp区域内没有重要的转录调控位点。将1 326 bp片段截短至1 091 bp 后,启动子活性显著降低(P<0.05),1 091 bp片段截短至719 bp后,启动子活性明显升高,说明-1 326~-1 091 bp和-1 091~-719 bp 区域内分别存在正调控元件和负调控元件。719 bp片段截短至325 bp后,启动子活性无显著变化;但325 bp片段的双荧光素酶活性依旧显著,说明-325~-1 bp间存在增强子。

图4 NOX1基因启动子区第一轮双荧光素酶活性检测结果
第二轮荧光素酶活性分析以上述发生显著变化的区间为基础,将-1 326~-1 091 bp、-1 091~-719 bp和-325~-1 bp这3个区间进一步分割,结果发现-1 149~-1 091 bp和-208~-115 bp区域内可能存在正调控元件,-1 091~-1 052 bp区域内可能存在负调控元件,这3个区域存在对NOX1基因转录影响较大的转录因子结合位点(图5)。
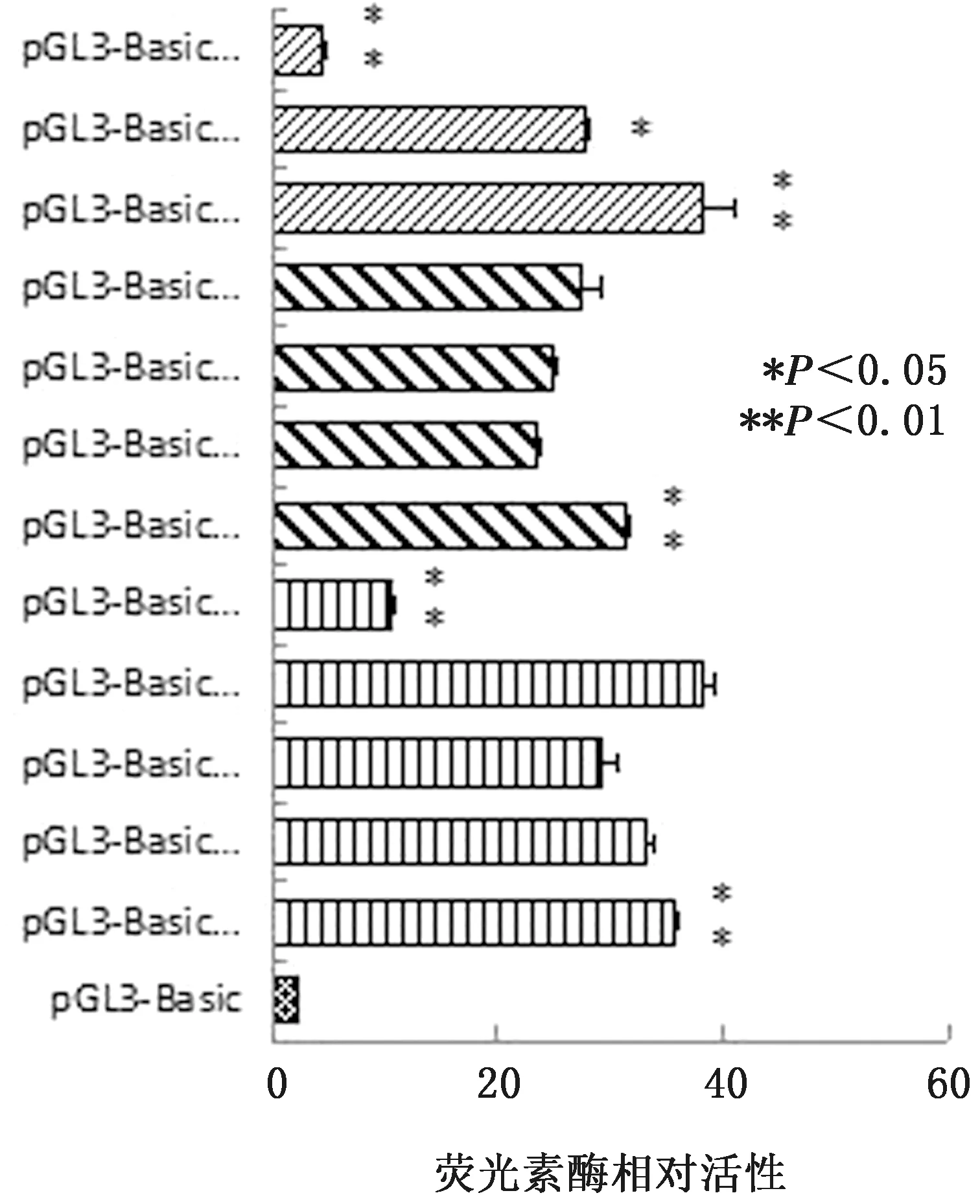
图5 NOX1基因启动子区第二轮双荧光素酶活性检测结果
2.6 NOX1基因转录调控元件的预测与鉴定
2.6.1生物信息学预测结果 综合3个在线预测软件的分析结果,同时参考上述荧光素酶相对活性的测定结果,共筛选出11个转录因子结合位点(表3),依据这些转录因子的结合位点,选择了适当的突变位置,以判定转录因子是否会与这些位点结合。

表3 转录因子结合位点预测结果
2.6.2转录因子结合位点的验证 分别以pGL3-Basic-1326和pGL3-Basic-208为模板,利用重叠延伸PCR法对预测的结合位点进行缺失突变,经酶切测序验证后,获得了4个报告基因质粒pGL3-Basic-1104、pGL3-Basic-1051、pGL3-Basic-1043和pGL3-Basic-126(数字代表缺失起始位置)。
以pGL3-Basic-1326和pGL3-Basic-208的双荧光素酶活性为参照,将构建的重组质粒进行双荧光素酶活性检测。结果显示缺失-1 104~-1 092 bp区域,双荧光素酶活性发生显著降低,其他2个区间的突变无明显变化,缺失-126~-116 bp区域双荧光素酶活性显著降低,推测ZNF384,ELF-1和TBR1是猪NOX1基因的正调控转录因子(图6)。

图6 序列缺失对NOX1基因启动子活性的影响
3 讨论
基因转录是在细胞核和细胞质内进行的,它是指以DNA的一条链为模板,按照碱基互补配对原则,合成RNA的过程。基因转录有正调控和负调控之分。转录因子是起调控作用的反式作用因子,它是转录起始过程中RNA聚合酶所需的辅助因子。真核生物基因在无转录因子时处于不表达状态,RNA聚合酶自身无法启动基因转录,只有当转录因子(蛋白质)结合在其识别的DNA序列上后,基因才开始表达。转录因子的结合位点(transcription factor binding site,TFBS)是与转录因子结合的DNA片段,长度通常在5~20 bp,一个转录因子往往同时调控若干个基因,在不同基因上的结合位点具有一定的保守性。较短的DNA片段在规模较大的基因组中重复出现的次数很多,另外,TFBS又允许一定的可变性,这给识别TFBS的工作带来困难。使得预测TFBS的算法普遍存在假阳性率偏高的问题[5],因此,预测后的结果必须辅以试验验证。
NOX1是NADPH氧化酶的一个催化亚基,在血管平滑肌细胞中含量较高,与血管硬化以及缺血再灌注损伤相关,也介导血管平滑肌细胞的增生和肥大[6]。Ang Ⅱ能够诱导NOX1 mRNA表达的增加,而二联苯碘(dipheny leneiodo nium,DPI)、线粒体呼吸链复合体-Ⅰ的抑制剂等则可抑制NOX1 mRNA的表达[7]。上调NOX1表达和随后生成的氧化应激产物可促进癌细胞增殖,如果抑制NOX1的活性则可诱导许多癌细胞(包括胰腺癌、间皮瘤和肉瘤)凋亡[8],这也预示着NOX1可能是癌细胞治疗的一个重要潜在靶点。在猪上的研究表明,罗伊氏乳杆菌可刺激断奶仔猪空肠组织内NOX1基因的显著上调[9]。运输应激可造成育肥猪空肠组织内NOX1 mRNA的显著上升[10],进一步研究发现,抑制NOX1表达可降低ROS和自噬水平,缓解氧化应激对细胞造成的损伤[11]。
本研究对猪的NOX1基因启动子区可能存在的转录因子进行了筛选与鉴定,发现该基因启动子区的-1 149~-1 091 bp和-208~-115 bp区域内存在正调控元件,-1 091~-1 052 bp区域内存在负调控元件。-1 104~-1 092 bp和-126~-116 bp 区域存在正调控该基因转录的转录因子结合位点,通过在线软件预测及靶序列定点缺失验证后认为ZNF384,ELF-1和TBR1可能是该基因的正调控转录因子。目前已知锌指蛋白384(ZNF384)可结合并调节细胞外基质基因MMP1、MMP3、MMP7 及COL1A1的启动子[12]。ELF-1是ETS转录因子家族的一员,是具有启动子特性的转录因子,在多种肿瘤中表达,与肿瘤的增殖、分化、凋亡、迁移等相关[13]。TBR1是来自于T-box脑蛋白家族的1个转录因子,它不但参与大脑皮质的早期发育,而且与神经细胞的分化与迁移、轴突寻径以及片层化的发育都有重要的关系[14],但上述转录因子是否会受到冷环境诱导,还未见报道。
徐采云等[15]在对人NOX1基因启动子区序列分析时发现,-140~-419 bp和-577~-946 bp区域可能存在NOX1启动子核心区域,与本研究所锚定的区域并不完全相同。此外,人们还发现转录因子SP1参与TNF-α介导的肺泡上皮细胞NOX1基因的表达调控[16],沉默NF-κB/p65基因,可有效下调TNF-α诱导A549细胞氧化应激程度及NOX1基因表达水平[17-18]。GLE1、DDX19A、KRT1和KRT10参与TNF-α诱导的A549细胞NOX1活化[19]。由此可知,NOX1基因的转录调控非常复杂,在不同类型的细胞内及行使不同生物学功能时其转录调控均存在差异。
综上所述,本研究克隆了猪NOX1基因的启动子序列,对可能结合到该区间的转录因子进行了筛选与分析,初步认定ZNF384、ELF-1和TBR1为该基因转录的正调控因子。结合前人的研究结果分析,NOX1基因的转录调控机制比较复杂。
