丁香油口服液对人工感染鸡沙门菌病的治疗作用及机制
2021-12-23尹义江陈峙峰邓旭明吕强华
姜 鲲,尹义江,陈峙峰,邓旭明,吕强华*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林省牧业信息中心,吉林 长春130062;3.吉林省牧硕养殖有限公司,吉林 长春130062;4.吉林市丰满区小白山乡畜牧兽医站,吉林 吉林市 132000)
1885年美国兽医学家丹尼尔·埃尔蒙·萨蒙和希尔博得·史密斯首次发现沙门菌,并命名为沙门菌属[1]。沙门菌(Salmonella)是一种兼性厌氧革兰阴性菌,在自然界广泛分布,目前经鉴定的血清型超过2 600种,我国报道已有292个血清型[2]。沙门菌感染畜禽引起不同的临床表现,可导致自限性胃肠炎、伤寒、副伤寒和系统性感染等疾病[3],对养殖业造成重大经济损失,严重阻碍畜禽养殖业的发展。近年来,欧洲食品安全局报道在人类食源性疾病的各种诱因中沙门菌的危害已跃居第二位。在我国,沙门菌引发食物中毒的事件更是屡见不鲜,严重威胁人类的生命安全[4]。沙门菌作为一种人畜共患病原菌造成的危害已经不容忽视,迫切需要有效的方法和手段解决面临的难题。
畜禽生产中主要依靠抗生素治疗沙门菌感染,但抗生素的不合理使用导致细菌耐药性逐年增强和耐药谱逐渐加宽,常规抗生素的治疗效果已经陷入困境。因此,寻求新型抗菌药物或抗菌策略对抗耐药菌的感染迫在眉睫。研究表明,沙门菌的致病性主要依赖于2个毒力岛(SPIs,Salmonellapathogenicity islands)及其编码的Ⅲ型分泌系统(type Ⅲ secretion system,T3SS)[5]。SPI-1编码的T3SS通过将效应蛋白注射至宿主细胞,在入侵肠上皮细胞中发挥重要作用,而SPI-2编码的T3SS调控细菌在宿主细胞内的存活、复制和增殖[6]。相比常规抗生素直接杀伤或杀灭病原菌的作用机制,以细菌生命过程非必需成分(如沙门菌T3SS)为靶标的抗毒力疗法成为一种理想的药物研发策略。
丁香是一味古老的中药,其根、茎、叶、花和果都可入药,在药学领域中被广泛研究,具有清热燥湿、解毒、消炎、利湿退黄的作用[7-9]。在本研究中,通过制备的丁香油口服液,发现丁香油口服液抑制沙门菌T3SS效应蛋白的转运功能,通过抗菌活性测定、蛋白免疫印迹(Western blot)和荧光定量PCR等研究丁香油口服液抑制沙门菌T3SS功能的作用机制,并评价丁香油口服液对人工感染鸡沙门菌病的保护效果,旨在为丁香油口服液治疗沙门菌感染的应用提供科学依据,以期为抗沙门菌感染提供候选制剂。
1 材料与方法
1.1 菌株、细胞与试剂鸡白痢沙门菌CVCC1789购自中国兽医药品监察所兽医微生物菌种保藏管理中心;抗ICDH血清由美国普渡大学罗招庆教授馈赠;人宫颈癌细胞HeLa来源于北京协和细胞中心;丁香油口服液(规格:100 mL/瓶,丁香酚含量不低于80 g/L),由吉林大学兽医药理学实验室提取和制备;空白辅料(规格:含二丁基羟基甲苯0.1 g,柠檬酸0.2 g,聚山梨酯-80为50 g,乙醇150 mL,PEG400加至1 L);硫酸新霉素由河南新正好生物工程有限公司生产(规格:100 g∶5 g,500万单位);TSB培养基购自青岛海博生物技术有限公司;含报告质粒sipA-PEX233菌株购自美国Abcam公司;6×CCF4试剂和DMEM细胞培养基购自Thermo Fisher公司。
1.2 试验动物1日龄AA+肉雏鸡购自吉林大学实验动物中心,正常饲喂至5日龄备用。
1.3 主要仪器生物安全柜(HDL),购自哈东联有限公司;恒温振荡器(THZ-82),购自上海跃进医疗器械厂;电子天平(BSA124S/224S-CW),购自德国赛多利斯;组织研磨仪,购自上海净信生物科技有限公司;免疫荧光显微镜,购自日本奥林巴斯;电泳仪、垂直蛋白电泳槽和半干转转膜仪,购自美国Bio-Rad;Tanon 4200化学发光成像系统购自上海天能科技有限公司;普通光学显微镜、手术刀、眼科镊和眼科剪等。
1.4 丁香油口服液对沙门菌T3SS抑制作用
1.4.1HeLa细胞的培养 将液氮中冻存的HeLa细胞放置在37℃水浴锅中快速融化。1 000 r/min离心5 min后弃上清,使用含有10%胎牛血清和1×双抗(青霉素/链霉素)溶液的DMEM高糖完全培养基轻柔重悬,将悬液加入细胞培养瓶中,向瓶中补充4 mL完全培养基混合均匀,置于37℃恒温细胞培养箱,5% CO2条件下培养。待瓶底细胞融合至70%~80%时,继续传代培养。
1.4.2细胞感染 按1.5×104个/孔将HeLa细胞接种于96孔板,在37℃、5% CO2条件下培养16~18 h。含报告质粒的沙门菌CVCC1789::SipA-TEM于LB液体培养基过夜培养,次日按1∶100扩大培养,加入终质量浓度为200 mg/L丁香油口服液或等量空白辅料,置于37℃和200 r/min水平摇床继续培养至对数生长中期(D600 nm=1.0左右)。1 000 r/min离心10 min收集菌体,PBS清洗3次,制备菌悬液。按细菌∶细胞=50∶1的比例感染HeLa细胞,1 000 r/min离心5 min后静置于37℃培养箱孵育90 min。吸出96孔板内的培养液,每孔加入CCF4工作试剂100 μL,室温避光孵育45 min 后,在荧光显微镜下观察不同处理组细胞的荧光(蓝色或绿色)情况。
1.5 丁香油口服液对体外抗菌活性测定
1.5.1最小抑菌浓度(MIC)的测定 根据CLSI(Clinical And Laboratory Standards Institute)公布的标准方法M7-A8,测定丁香油口服液对沙门菌的MIC。将鸡白痢沙门菌 CVCC1789接种至2 mL LB培养基中培养过夜待用,用新鲜LB培养基将过夜培养的菌液稀释至5×105CFU/mL,随后加入不同质量浓度的丁香油口服液倍比稀释,使其终质量浓度为0,4,8,16,32,64,128,256,512,1 024 mg/L,每孔体系为100 μL,另设LB纯培养基阴性对照组和不加丁香油口服液的阳性对照组,37℃静置培养24 h,以无细菌生长的最低药物质量浓度作为丁香油口服液的MIC。
1.5.2丁香油口服液对沙门菌生长曲线的测定 将过夜培养的CVCC1789按1∶50扩培于100 mL新鲜LB培养基中继续培养至D600 nm=0.3。将菌液等量分装到5个50 mL的三角锥形瓶中,同时加入不同质量浓度的丁香油口服液(终质量浓度分别为0,25,50,100,200 mg/L。置于37℃、200 r/min摇床中继续培养,间隔1 h测定菌液的D600 nm值并记录,绘制细菌的生长曲线。
1.6 丁香油口服液对沙门菌T3SS的作用机制
1.6.1Western blot检测沙门菌T3SS主要效应蛋白(SipA和SipB)和调控蛋白(HilA)的表达 沙门菌CVCC1789于LB液体培养基内过夜培养,次日按1∶100扩培,加入丁香油口服液(终质量浓度为200 mg/L)后继续培养4 h,10 000 r/min离心5 min 收集菌体,加入100 μL 1×loading buffer(含β-巯基乙醇)重悬菌体,置于100℃水浴锅中煮沸6 min。取上述样品进行SDS-PAGE电泳,用半干式转膜仪将分离的蛋白转移至PVDF膜,在5%脱脂奶粉中室温封闭2 h。使用沙门菌SipA抗血清(鼠来源)、沙门菌SipB抗血清(鼠来源)、HilA抗血清(鼠来源)和 ICDH 抗血清(兔来源)分别常温孵育2 h 后,羊抗鼠或羊抗兔常温孵育1 h,TBST洗膜3次后,置于Tanon 4200显影仪采集图像。
1.6.2RT-PCR法检测沙门菌SPI-1基因 本研究参照基因组序列信息详细的鼠伤寒沙门菌SL1344进行检测。挑沙门菌CVCC1789单菌落于LB培养基过夜培养,次日1∶20扩培,加入终质量浓度分别为0,200 mg/L的丁香油口服液,37℃培养4 h。使用Trizol法提取细菌总RNA,进行一步法反转录,使用Bio-Rad CFX96荧光定量PCR仪检测和分析。引物由吉林省库美生物科技有限公司合成,序列如下:
sipA-F 5′-GTCATTCGCGTGTGGATTCG-3′,sipA-R 5′-TTCGGATGAAGCGTTGGTCA-3′;
sipB-F 5′-GGGCAGATGATACCCGATGG-3′,sipB-R 5′-AAGAGAGAAGCGGGTTGGTG-3′;
hilA-F 5′-AAGAAGCGACAGAGGCGAAA-3′,hilA-R 5′-TATCCTGCTCACCCTGGGAA-3′;
FliC-F 5′-CGGAAGCGGCTGCTACAAC-3′,FliC-R 5′-CGGCTACGGGCAGAAGTCA-3′;
FliC作为内参基因。
1.7 丁香油口服液对人工感染鸡沙门菌病的治疗作用
1.7.1分组与处理 将肉雏鸡随机分组,每组20只。分组及处理方法见表1。

表1 试验动物分组及处理方法
1.7.2判定指标 分别于给药后3,7,12 d观察并记录各组雏鸡临床症状。鸡沙门菌病临床症状为精神萎顿、拉白色浆糊状稀粪及糊肛等。
分别于给药后3,7 d随机抽取5只及给药后12 d 剖检剩余所有雏鸡,观察肝脏、脾脏和盲肠病理变化。典型病理变化:肝脏外观呈土黄色,出现针尖大出血点和灰白色的坏死灶,质地脆弱;脾脏呈现红褐色,肿胀,有出血点(斑);盲肠出现一定程度的积粪。
给药前各组全部雏鸡(20只/组)和给药后12 d各组剩余雏鸡(10只/组)分别称体质量,以健康对照组增重率为100%计,计算平均增重和相对增重率。
临床症状和病理变化作为疗效判定主要指标,体质量变化情况作为次要指标。
治愈:治疗后临床症状和病理变化消失,判定治愈。
有效:治疗后临床症状和病理变化显著缓解,判定有效。
无效:临床症状和病理变化未显著缓解,判定无效。
治愈率=(组内治愈数/组内总数)×100%
有效率=(组内有效数/组内总数)×100%
总有效率=治愈率+有效率
无效率=(组内无效数/组内总数)×100%

2 结果
2.1 丁香油口服液抑制沙门菌T3SS的功能如图1所示,含报告质粒PEX233-SipA的CVCC1789::SipA-TEM菌株感染HeLa细胞后绝大多细胞呈蓝色荧光;空白辅料对照组大多细胞呈现蓝色荧光;200 mg/L丁香油口服液组大多数细胞呈绿色荧光,说明丁香油口服液阻止沙门菌T3SS效应蛋白SipA转运至HeLa细胞,抑制沙门菌T3SS的功能。

图1 丁香油口服液对沙门菌T3SS功能的抑制作用
注:感染组,CVCC1789::SipA-TEM感染;感染+丁香油口服液组,200 mg/L丁香油口服液预处理CVCC1789::SipA-TEM后感染;感染+空白辅料组,空白辅料预处理CVCC1789::SipA-TEM后感染。蓝色荧光代表沙门菌T3SS效应蛋白SipA正常转运至宿主细胞;绿色荧光代表沙门菌T3SS效应蛋白SipA不能正常转运至宿主细胞。
2.2 丁香油口服液对沙门菌无抗菌活性如图2所示,不同质量浓度的丁香油口服液处理组沙门菌CVCC1789的生长曲线与对照组相似,说明丁香油口服液对沙门菌的生长无显著性影响;同时,丁香油口服液对沙门菌CVCC1789的MIC值大于1 024 mg/L,该结果表明丁香油口服液对沙门菌无抗菌活性。

图2 丁香油口服液对沙门菌生长的影响
2.3 丁香油口服液降低沙门菌T3SS效应蛋白(SipA和SipB)及调控蛋白(HilA)的表达通过Western blot检测丁香油口服液对沙门菌T3SS效应蛋白(SipA和SipB)和调控蛋白(HilA)表达的影响。由图3可知,相比对照组,质量浓度为200 mg/L的丁香油口服液抑制沙门菌CVCC1789 T3SS主要效应蛋白(SipA和SipB)和调控蛋白(HilA)的表达。
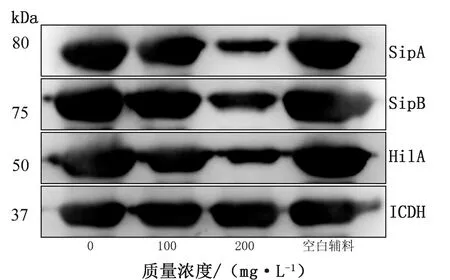
图3 丁香油口服液对沙门菌T3SS效应蛋白和调控蛋白的影响
2.4 丁香油口服液抑制沙门菌SPI-1相关基因的转录上述研究表明丁香油口服液抑制沙门菌T3SS效应蛋白(SipA和SipB)和调控蛋白(HilA)的表达。为进一步研究丁香油口服液的作用机制,通过荧光定量PCR测定丁香油口服液对沙门菌SPI-1相关基因(sipA、sipB和hilA)转录的影响。由图4可知,质量浓度为200 mg/L的丁香油口服液显著降低上述基因mRNA的转录。

图4 丁香油口服液对沙门菌T3SS效应蛋白及调控蛋白基因mRNA转录的影响
2.5 丁香油口服液对人工感染鸡沙门菌病的治疗作用
2.5.1临床症状 健康对照组未出现异常,试验过程未发生沙门菌感染;感染对照组和空白辅料对照组,给药后7,12 d所有雏鸡表现精神萎顿和拉白色稀粪的临床症状,表明感染模型建立成功(图5),空白辅料对鸡沙门菌病无任何疗效。由表2可知,给药后12 d丁香油口服液不同剂量组和硫酸新霉素对照组分别有45%,40%,30%,30%的雏鸡呈现临床症状,表明丁香油口服液和硫酸新霉素均可缓解感染雏鸡的临床症状,且中剂量和高剂量组与硫酸新霉素组临床症状相近。

图5 发病鸡临床症状

表2 丁香油口服液对人工感染鸡沙门菌病的临床症状观察 %
2.5.2病理变化 如表3所示,健康对照组未出现异常变化,说明饲养过程中未发生感染;感染对照组和空白辅料组雏鸡肝脏呈现不同程度淤血,脾脏肿大和盲肠积粪等典型病变,说明感染模型成功建立,空白辅料对鸡沙门菌病无任何治疗作用(图6)。丁香油口服液不同剂量和硫酸新霉素对照组在给药后呈现病理变化的雏鸡数量逐渐减少,低剂量组疗效较差,中剂量和高剂量与硫酸新霉素疗效相近。

图6 给药后12 d各组剖检病理变化

表3 丁香油口服液对人工感染鸡沙门菌病的病理变化观察 %
2.5.3体质量变化 如表4所示,健康对照组、感染对照组、丁香油口服液不同剂量组、硫酸新霉素对照组和空白辅料组平均增重分别为 653.76,457.58,576.40,620.43,624.46,628.96,465.84 g;以健康对照组增重率为100.00%计,感染对照组、丁香油口服液组、硫酸新霉素对照组和空白辅料对照组的相对增重率分别为69.99%,88.17%,94.90%,95.52%,96.21%,71.26%,感染对照组和空白辅料对照组相对增重率较低;中剂量和高剂量组平均增重和相对增重率与硫酸新霉素对照组相近,表明丁香油口服液可有效缓解沙门菌感染所造成体质量下降趋势。

表4 丁香油口服液对人工感染鸡沙门菌病体质量变化统计 g
2.5.4治疗效果统计 由表5可知,丁香油口服液不同剂量组和硫酸新霉素对照组治愈率分别为45%,60%,65%,70%,总有效率分别为65%,80%,85%,90%,表明丁香油口服液中剂量对鸡沙门菌感染具有良好治疗作用,与硫酸新霉素疗效相当。

表5 丁香油口服液对人工感染鸡沙门菌病治疗试验统计结果 %
3 讨论
自从发现沙门菌以来,作为一种临床上常见人畜共患病原菌,沙门菌病仍是困扰人类和动物的一种多发性疾病[10]。尤其在一些国家和地区,沙门菌已经成为食源性高致病菌,具有高传染率和高传播率的特点[11]。随着生活水平的提高和环保意识的增强,人们对食品安全和环保问题的要求越来越高,加上如今规模化和集约化畜禽养殖业的飞速发展,选择健康有效的抗菌药物和抗菌策略防治畜禽沙门菌感染,对于促进畜禽养殖业健康发展和提供健康安全的畜禽产品至关重要。
相比于传统抗生素通过抑制细菌必需成分易诱导产生耐药性的特点,以细菌生命过程非必需成分(如溶血素、菌毛、鞭毛和Ⅲ型分泌系统)为靶标的抗毒力药物研发已成为人类关注的热点。近年来,已有许多以细菌致病过程的毒力因子为靶标的化合物和天然小分子抑制剂陆续被报道出来[12-15]。在我国,中药的应用历史悠久,为抗细菌感染新药研发提供了巨大的天然宝库[16-18]。基于中药清热解毒等功效的临床实践,发现中药抗感染是以细菌致病过程的毒力因子为靶标的作用机制,来源广泛、成本低廉和绿色环保的中药成为抗细菌毒力策略中药物研发的理想选择。
在本研究中,通过建立沙门菌T3SS抑制剂的筛选平台,发现丁香油口服液显著抑制沙门菌T3SS的功能,并对其作用机制进行初步探索。同时,建立人工感染鸡沙门菌病模型并对丁香油口服液的治疗效果进行评价,以临床症状、病理损伤及体质量情况等指标评价丁香油口服液对人工感染鸡沙门菌病的保护效果。结果表明,丁香油口服液通过抑制沙门菌SPI-1相关编码基因(sipA、sipB和hilA)的转录,降低效应蛋白(SipA和SipB)和调节蛋白(HilA)表达抑制沙门菌T3SS功能的作用机制;体内试验发现丁香油口服液有效降低感染肉鸡的病理损伤,减轻临床症状和缓解体质量下降趋势,显著提高感染肉鸡的治愈率和有效率。综上所述,丁香油口服液是一种治疗沙门菌感染的潜在制剂,该研究也为它的临床开发和应用提供科学基础。
