基于RNA-Seq数据分析油酸与胰岛素诱导延边黄牛前脂肪细胞分化的差异表达基因
2021-12-23郭盼盼孙建富李香子严昌国尹云厚
郭盼盼,金 鑫,孙建富,李 强,李香子,严昌国*,尹云厚
(1.延边大学 肉牛科学与产业技术协同创新中心,吉林 延吉 133000;2.贵州民族大学,贵州 贵阳 550025;3.延边弘朝畜牧集团有限公司,吉林 延吉 133000)
较低的肌间脂肪含量仍然是提高我国牛肉品质的重大挑战,因此,增加肌内脂肪含量的方法已经成为提高肉类质量的一个关键方面。肌间脂肪含量的多少主要取决于前体脂肪细胞的数量及其分化的能力[1]。而前体脂肪细胞的分化受机体生长性能、脂肪酸组成以及脂肪代谢相关调控因子等复杂生物过程的综合调控作用影响。
油酸作为人体脂肪酸组成中非常重要的一种,可通过调节脂肪代谢相关基因来参与机体的脂肪代谢,且可有效促进牛前体脂肪细胞的分化[2-3]。并且油酸在骨骼肌卫星细胞成脂转分化过程中均可以起到积极的调控作用[4]。油酸可以使骨骼肌卫星细胞在缺乏PPARγ激动剂的情况下,增加成脂基因的表达[5]。胰岛素对前体脂肪细胞增值和分化同样具有不同程度的调控作用,且在一定范围内胰岛素可正向加速脂肪细胞的分化。但也有研究结果表明,胰岛素单独处理,不能够促进脂肪细胞的分化[6]。目前,关于胰岛素和油酸对前脂肪细胞分化的影响的研究大多还只集中于成脂分化相关基因mRNA表达水平。为了明确油酸和胰岛素是如何诱导延边黄牛前脂肪细胞成脂分化的,本试验应用 RNA-Seq技术探究胰岛素和油酸干预延边黄牛前脂肪细胞分化,以筛选出各处理中相关的DEGs,并对这些DEGs进行注释与富集分析,为进一步研究油酸和胰岛素对延边黄牛前脂肪细胞成脂分化途径的分子调控机制提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1细胞来源 试验所用的延边黄牛前脂肪细胞由延边大学东北寒区肉牛科技创新教育部工程研究中心鉴定并保存。
1.1.2主要试剂 DMEM高糖培养液、澳洲胎牛血清(FBS)、胰蛋白酶(0.25%)购自Gibco公司;油红O染色试剂盒(G1262)、青链霉素混合液(PS)、PBS购自Solarbio公司;胰岛素和油酸购自Sigma公司;甘油三脂试剂盒购自北京普利莱基因技术有限公司;cDNA反转录试剂盒与实时荧光定量试剂盒均购自Tiangen公司;其他试剂均为国产分析纯。
1.1.3主要试剂配置 基础培养液:DMEM+10% FBS+1% PS(青霉素+链霉素);基础分化培养液:DMEM+5% FBS+1% PS(青霉素+链霉素);清洗液:PBS+1% PS(青霉素+链霉素);消化液:DMEM+1% PS+2 g/L胶原酶(Collagenase)+1% BSA;油酸原液(100 μmol/L):0.793 mL油酸溶于24.207 mL无水乙醇。
1.2 延边黄牛前体脂肪细胞的诱导分化解冻置于液氮中的延边黄牛前脂肪细胞于培养皿中,37℃,5%的CO2培养箱中培养,48 h更换培养液,直至细胞密度达到70%~80%后进行不同的分化处理,分化培养液具体处理方法如下:
CON组:基础分化培养液;I组:基础分化培养液+10 mg/L胰岛素;O组:基础分化培养液+100 μmol/L油酸;IO组:基础分化培养液+10 mg/L胰岛素+100 μmol/L油酸。每个处理3次重复,置于 37℃,5% CO2恒温培养箱中培养,每隔48 h换1次分化培养液,分化处理96 h后,收集细胞用于后续试验。
1.3 油红O染色与甘油三酯含量测定细胞油红O染色参照油红O染色试剂盒(G1262)进行。最后在显微镜下镜检拍照,取拍好的油红O染色图片,每个试验组随机选取12张图片;甘油三酯含量的测定参照普利来甘油三酯测定试剂盒进行,最后取570 nm处的D值,并绘制标准曲线及计算甘油三脂浓度。
1.4 转录组学测序分析各试验组处理96 h后,加入1 mL Trizol后将裂解下的细胞放于无菌EP管中,低温保存运输,爱默基因(厦门)生物科技有限公司进行mRNA富集、cDNA文库构建及上机测序(PE150)。 对原始测序数据进行预处理后,再通过Fastp过滤获得最终的有效数据,用于后续差异表达基因的KEGG-GO富集分析。
1.5 实时荧光定量PCR各试验组处理96 h后,利用Trizol法提取细胞总RNA,再利用反转录试剂盒进行cDNA 合成,最后通过实时荧光定量试剂盒进行相关基因的定量检测,GAPDH、CD36、FABP4、PLIN2、DGAT1、LIPE引物购自生工生物工程(上海)股份有限公司,序列见表1。 以牛GAPDH(甘油醛-3-磷酸脱氢酶)基因作为内源性对照基因。 反应体系 20 μL:SYBR 10 μL,上、下游引物(10 μmol/L)各 0.6 μL,cDNA 模板 1 μL,RNase-free ddH2O 7.5 μL,Rox 0.3 μL。反应程序:在95℃ 下预变性15 min,在95℃下变性 10 s,在55℃下退火30 s,在72℃下延伸32 s,35 个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。

表1 引物信息
1.6 数据分析数据结果使用2-△△Ct计算相对mRNA表达量,数据分析与作图利用Graph Pad Prism 6.0软件进行。
2 结果
2.1 胰岛素和油酸对前体脂肪细胞脂滴形成的影响油红O染色结果如图1所示,分化处理96 h后,CON和I组均未形成明显的脂滴,其中I组细胞边界不清晰,CON组较分化前后无明显变化。而O和IO组均形成数量较多的脂滴。

图1 胰岛素及油酸对延边黄牛前脂肪细胞分化过程中脂滴形成的影响(20×)
2.2 胰岛素和油酸对前体脂肪细胞甘油三酯浓度的影响胰岛素和油酸分化处理96 h后,测定各试验组中的甘油三酯浓度,结果如图2所示,各试验组中甘油三酯含量均高于CON组,但是I与CON组之间差异不显著(P>0.05),而O与IO组甘油三酯含量均显著高于CON和I组(P<0.05),而O与IO组之间差异不显著(P>0.05)。

注:肩标不同小写字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)。下同图2 胰岛素及油酸对延边黄牛前脂肪细胞甘油三酯浓度的影响
2.3 胰岛素及油酸诱导延边黄牛前体脂肪细胞分化的差异基因分析如表2和图3所示,相比于对照组,I组差异表达基因总数为1 488个,其中上调基因834个,下调基因654个;O组共有1 773个差异表达基因,其中上调基因881个,下调基因892个;而IO组,差异表达基因总数共1 974个,上调基因和下调基因分别为963和 1 011个。韦恩图显示,各试验组有435个相同的DEGs(图3D)。聚类分析如图4所示,可直观看出各试验组与对照组的基因差异表达发生明显变化。

表2 胰岛素及油酸诱导分化的牛脂肪细胞中DEGs数目 个

A.胰岛素单独处理-I组;B.油酸单独处理-O组;C.胰岛素+油酸共处理-IO组;D.韦恩图图3 胰岛素及油酸处理的差异表达基因

图4 胰岛素及油酸处理的DEGs的聚类热图分析
2.4 胰岛素及油酸诱导延边黄牛前脂肪细胞中差异表达基因GO功能分析通过对各试验组DEGs的GO 富集结果进行分析来进一步探究这些 DEGs 的生物学功能,GO分类分为分子功能(molecular function,MF)、细胞组分(cellular component,CC)以及生物过程(biological process,BP)3个本体。本试验挑选GO分类中富集最显著的前10个GO条目进行展示(图5)。各试验组与对照组相比,在分子功能类别上,各试验组的DEGs主要富集在转运活性(transcription regulator activity)、转录调节活性(hijacked molecular function)、分子功能调节(molecular function regulator)及催化活性(catalytic activity)等;在细胞组分上的富集主要是在薄膜部分(membrane part)、细胞器部分(organelle part)、膜(membrane)、细胞器(organelle)、细胞部分(cell part)及细胞(cell)等;而大多数DEGs参与的生物过程主要有细胞成分组织或生物发生(cellular component organization or biogenesis)、多细胞有机体过程(cellular component organization or biogenesis)、生物过程调控(regulation of biological process)、生物调节(metabolic process)、代谢过程(metabolic process)及细胞过程(cellular process)等。

A.胰岛素单独处理-I组;B.环格列酮单独处理-C组;C.胰岛素+环格列酮共处理-IC。横轴表示基因数量;纵轴表示GO功能注释分类图5 在胰岛素和油酸处理后DEGs的GO功能注释分类
2.5 胰岛素和油酸处理后DEGs的KEEG富集分析为了进一步探究各处理组在调控脂肪细胞分化过程中的分子机制,我们通过DEGs所参与的主要生化代谢和信号转导途径进行KEGG富集分析探究,并筛选出富集前10的通路进行展示。与CON组相比,I组共有661个差异基因得到注释,共涉及到37个信号通路,主要有Hippo信号通路、P53信号通路、细胞周期、氨基酸生物合成信号通路、TGF-β信号通路以及Wnt信号通路等;O组共有798个差异基因富集到类固醇生物合成、脂肪酸代谢、P53信号通路、PPAR信号通路、AMPK信号通路、脂肪酸降解等77个信号通路上;IO组共有882个差异基因被富集到脂肪酸代谢、P53信号通路、FoXO信号通路、PPARγ信号通路、AMPK信号通路、胆固醇代谢等65个信号通路上(图6)。
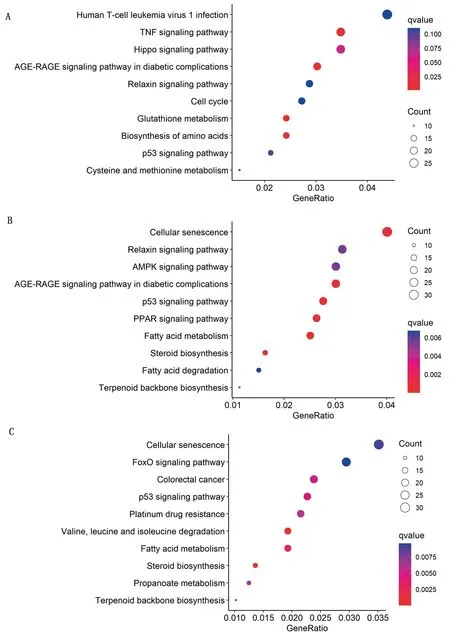
A.胰岛素单独处理-I组;B.环格列酮单独处理-C组;C.胰岛素+环格列酮共处理-IC。横轴表示富集系数,纵轴表示pathway名称,图中显示的是不同处理诱导的所有差异表达基因富集前10的信号通路图6 胰岛素和油酸处理后DEGs的KEEG富集分析
2.6 实时荧光定量PCR验证差异表达基因为了验证RNA-Seq结果,我们在O组选择5个典型DEGs,即CD36、FABP4、PLIN2、DGAT1和LIPE(表3),用qRT-PCR检测延边黄牛前脂肪细胞中以上基因mRNA表达水平。结果如图7所示,油酸诱导延边黄牛前脂肪细胞分化均显著提高各基因的mRNA表达量(P<0.05)。实时荧光定量 PCR 数据表的大趋势与转录组测序结果基本一致。

表3 油酸处理组部分差异表达基因

图7 实时荧光定量 PCR 验证 RNA-Seq 结果
3 讨论
肌内脂肪细胞的沉积过程包括细胞的增殖分化和成熟[7-8],而脂肪细胞来源于现有的前脂肪细胞,这些细胞会根据适当的信号进行分化[9],长链脂肪酸是构成甘油三酯(TG)的主要原料之一,是细胞代谢关键的能量来源。研究表明长链脂肪酸可以调节脂质代谢和细胞分化过程中相关基因的表达[10-11]。油酸作为长链脂肪酸中较为重要的十八碳烯酸,对牛脂肪细胞分化和脂肪沉积具有促进作用,且与其他长链脂肪酸相比,油酸可以更快的促进细胞中脂质的合成[12]。而胰岛素是调节机体内环境的重要激素之一,在一定的浓度范围内对脂肪细胞的生长和分化有一定的影响[13]。雷世成等[14]研究表明500 nmol/L的胰岛素,即高浓度的胰岛素可以促进脂肪细胞的分化。因此本试验基于以上研究基础,以期为油酸和胰岛素引起延边黄牛前脂肪细胞成脂分化过程中的分子调控机制提供理论依据,为提高肉品质提供宝贵的信息。
本试验设计为胰岛素和油酸分别诱导以及两者共同诱导延边黄牛前体脂肪细胞分化96 h后,进行转录组测序,来分析各处理组之间分别引起的DEGs、GO功能注释以及KEGG富集分析。由于油酸处理144 h后,大多数脂滴破裂及脱落,所以本试验统一处理时间为96 h。油红O染色以及甘油三酯含量结果可明显看出O和IO组脂滴数量和甘油三酯含量较多,说明油酸的添加显著促进了前脂肪细胞的分化。而CON和I组没有明显被染成红色的脂滴形成且甘油三酯含量与对照组相比没有显著变化,说明本试验中胰岛素的浓度可能还不足以促进脂肪细胞中脂滴的形成,或者胰岛素单独处理时间还不够。
本试验对各处理组中DEGs进行GO功能注释和KEGG 富集分析,结果表明DEGs主要注释到多细胞有机体过程、生物过程调控、生物调节、代谢过程及细胞过程等生物过程中。而KEGG 富集结果显示,油酸添加后,DEGs主要被富集到脂肪酸代谢、PPAR信号通路以及AMPK信号通路等信号通路中。AMPK信号通路主要参与脂肪的代谢过程,是细胞内能量代谢的重要酶之一。而PPAR信号通路中的PPARγ信号通路,主要参与调控脂肪酸代谢、糖代谢、细胞增殖与分化等[15]。
本试验RNA-Seq结果显示油酸的添加对脂代谢关键酶DGAT1基因表达有促进作用。在哺乳动物中,DGAT1不仅是脂肪细胞中控制甘油三酯合成的最后一步反应酶,同时也是甘油三酯合成过程中唯一的关键酶和限速酶[16]。DGAT1主要是负责以脂滴形式来储存甘油三酯[17-18]。在本试验牛前脂肪细胞分化过程中,油酸的添加确实显著促进了脂滴的形成,且DGAT1基因被显著上调。此外,RNA-Seq数据还显示,AMPK信号通路上相关基因(CD36、FABP4、LIPE)以及PPAR信号通路中相关基因(PPARγ、CD36、FABP4、PLIN2)有显著性差异(P<0.05),这通过qRT-PCR进一步得到证实。CD36是一种脂肪酸转运蛋白,在维持机体脂质代谢中起重要的作用[19-22],CD36基因编码的蛋白作为一种细胞黏附分子具有重要的功能,可与长链脂肪酸结合,在脂肪酸转运和/或作为脂肪酸转运的调节剂发挥作用。研究发现CD36基因敲除后,小鼠体内脂肪含量降低,体外试验也证实沉默CD36后,脂滴形成受到抑制[23]。PLIN2 是一种分布在脂滴表面与脂肪分化相关的一种蛋白质,参与脂质代谢,其蛋白水平与甘油三酯含量成正比。当PLIN2过度表达后,细胞内的胆固醇酯会大量聚集并使细胞泡沫化[24]。本试验结果显示油酸添加后,CD36和PLIN2基因表达量被显著提高,而对照组和胰岛素处理组,对CD36和PLIN2基因的表达没有显著影响,这可能由于胰岛素添加量和处理时间的原因导致的。FABP4参与脂肪细胞内脂质的转运与代谢,与脂肪酸有高度亲和性,是影响牛肉肌内脂肪含量的后选基因之一[25-29]。本试验PCR-Seq结果显示各试验组对FABP4基因的表达均有显著促进作用,其中油酸和胰岛素共处理,会显著提高FABP4基因的表达水平。这说明胰岛素单独处理也可部分促进脂质在脂肪细胞内的代谢。LIPE是激素敏感性脂肪酶(HSL)的基因,HSL是随着分化进程的增加而逐渐出现的分化中期标志物,本试验结果显示,胰岛素单独处理组,LIPE表达下降,而O组和IO组,LIPE基因的表达均被上调,这可能也是由于胰岛素添加浓度和处理时间不足所导致的结果。
综上所述,油酸对延边黄牛前脂肪细胞分化的调控作用可能主要是通过显著富集基因 FABP4、PPARγ、CD36、 PLIN2和LIPE等所在的PPARγ信号通路和AMPK信号通路相互作用来进行调控的,而胰岛素对PPAR信号通路和AMPK信号通路上基因的表达无显著影响。总之,本试验为了解胰岛素和油酸对脂质代谢和脂肪生成的分子机制提供了有用的信息。而油酸对脂肪细胞分化的调控机制还涉及哪些信号通路有待进一步挖掘。
对各处理组的差异表达基因进行比较发现,与CON组相比,I、O和IO组分别得到1 488,1 773和1 974个DEGs,其中各组共有435个共同差异表达基因。GO富集分析显示各DEGs主要参与细胞成分组织或生物发生过程、多细胞有机体过程、生物过程调控等;且与转运活性、转录调节活性、分子功能调节及催化活性等分子功能有关;大部分DEGs富集在薄膜部分、膜、细胞器及细胞等部分。KEGG结果显示,含有油酸的试验组的DEGs与脂肪细胞代谢的调控密切相关,包括脂肪酸代谢、PPARγ信号通路、AMPK信号通路、胆固醇代谢。胰岛素单独处理组的DEGs参与氨基酸生物合成信号通路、TGF-β信号通路以及Wnt信号通路等。综合分析结果表明,胰岛素和油酸单独处理与二者共同处理对延边黄牛前脂肪细胞分化的调控机制有所差别,其中胰岛素的添加加强了油酸本身对前体脂肪细胞分化的促进作用。
