间充质干细胞中血红素加氧酶-1的过表达抑制NOD样受体热蛋白结构域相关蛋白3炎症小体活化改善大鼠急性肺损伤
2021-12-20许欣婷张瑶陈丽展张芳
许欣婷 张瑶 陈丽展 张芳
急性肺损伤(ALI)是一种由多种病因引起的以急性进行性呼吸困难和顽固性低氧血症为特征的疾病,其发病机制复杂,发病率及死亡率均较高[1]。ALI的特征是肺组织水肿和损伤、气体交换受损、严重的炎症反应导致弥漫性肺泡损伤、严重低氧血症、肺顺应性降低[2]。几十年来,人们在探索ALI治疗策略和措施方面取得了一些进步,但仍未开发出ALI最优的治疗策略[3]。因此,有必要继续探究新颖有效的ALI治疗策略。NOD样受体热蛋白结构域相关蛋白3(NLRP3)是一种细胞内信号分子,NLRP3炎症小体是由NLRP3、凋亡相关斑点样蛋白(ASC)和半胱氨酸蛋白酶-1(Caspase-1)组成的复合物。NLRP3炎症小体的激活与ALI疾病进展及炎症反应有关[4]。最近的研究表明,间充质干细胞(MSCs)可以移植到受损的肺部,通过归巢,转移至炎症部位,分化为肺泡上皮细胞,并发挥修复气血屏障的多潜能来减轻炎症的发生[5]。已有研究证明,骨髓间充质干细胞(BMSCs)移植可减轻香烟烟雾和副流感嗜血杆菌所致的慢性阻塞性肺疾病小鼠肺损伤,该作用是通过抑制炎症信号通路,减少炎症发生实现的[6]。血红素加氧酶-1(HO-1)是一种抗氧化和抗凋亡的酶。在缺血/再灌注诱导的急性肾损伤的研究中,HO-1通过促进BMSCs的增殖和分化,进一步增强BMSCs对急性肾损伤大鼠的治疗作用,改善大鼠肾功能[7]。综上所述,本研究旨在探究过表达HO-1的BMSCs对ALI大鼠的作用及其作用机制是否与调控NLRP3炎症小体的激活相关,以期为开发新的ALI治疗策略提供依据。
材料与方法
1.材料:实验动物:50只雄性SD大鼠(4周龄,体重80~100 g)购自空军军医大学实验动物中心[动物生产许可证号:SCXK(陕)2019-001],饲养在环境温度24~26 ℃、环境湿度55%~60%的动物房中,光/暗周期为12 h/12 h,大鼠自由饮水和进食。实验材料:茜素红染色液(G1452)、油红O染色液(G1262)和脂多糖(LPS,L8880)均购自北京索莱宝科技有限公司;过表达HO-1重组慢病毒液和阴性对照(NC)重组慢病毒液购自上海吉满生物科技有限公司;FITC-CD44(ab189524)、FITC-CD90(181469)、FITC-CD105(ab252345)、FITC-CD45(ab40763)、FITC-CD34(ab81289)、FITC-HLA-DR(ab92511)、NLRP3(ab263899)抗体均购自英国Abcam公司;PrimeScriptTM1st strand cDNA Synthesis Kit(6110A)购自宝日医生物技术(北京)有限公司;2×SYBR Green qPCR Master Mix(HY-K0522)购自美国MedChemExpress公司;BCA蛋白定量检测试剂盒(PA115-01)购自天根生化科技(北京)有限公司;HO-1(P249)和cleaved-Caspase-1(4199T)抗体均购自美国cell signaling technology公司;表面活性蛋白C(SP-C)(HK4743)和ASC抗体(HK3961)均购自美国Santa Cruz Biotechnology公司;GAPDH抗体(A01020)购自北京义翘神州生物技术有限公司;肿瘤坏死因子(TNF)-α(H052-1)、白细胞介素(IL)-6(H007-1-1)和IL-1β(H002)酶联免疫吸附试验(ELISA)检测试剂盒均购自南京建成生物工程研究所。
2.方法
(1)BMSCs的分离与培养:随机取10只SD大鼠,10%水合氯醛(300 mg/kg)麻醉后处死。取大鼠双侧股骨和胫骨,剪开两骨骺端,使用注射器吸取DMEM培养基冲洗骨髓腔,一共冲洗3次。将细胞悬液加入到预先装有淋巴细胞分离液的离心管内,2 000 r/min离心20 min,吸取中层BMSCs。用含10%胎牛血清(FBS)的DMEM培养基重悬细胞,以1×106个/ml的细胞密度接种于培养瓶中,细胞置于37 ℃、5% CO2培养箱中培养。细胞每2天更换一次新鲜培养基,待细胞密度达到80%~90%时,以0.25%胰酶液消化细胞,以1∶3比例传代培养。
(2)茜素红染色检测BMSCs成骨分化潜能:取处于对数期生长的BMSCs,以3×104个/孔的密度接种于6孔板中,细胞于37 ℃、5% CO2培养箱中继续培养。待细胞密度达到80%~90%时,将细胞培养基更换为成骨诱导培养基培养,连续诱导21天后,弃去旧培养基,磷酸盐缓冲液(PBS)清洗细胞后,4%多聚甲醛室温条件下固定细胞15 min。PBS清洗细胞后,加入茜素红染液,染色5 min,PBS清洗细胞后,显微镜下观察并拍照,钙沉积阳性细胞呈现橘红色。
(3)油红O染色检测BMSCs成脂分化潜能:取处于对数期生长的BMSCs,以3×104个/孔的密度接种于6孔板中,细胞于37 ℃、5%CO2培养箱中继续培养。待细胞密度达到80%~90%时,弃去旧培养基,添加成脂诱导培养基继续培养,连续诱导21天。弃去细胞旧培养基,PBS清洗细胞,4%多聚甲醛室温条件下固定细胞15 min。PBS清洗细胞后,加入油红O染色液染色10 min。用75%酒精漂洗细胞以去除多余的染料。显微镜下观察并拍照,脂类物质呈红色着染,细胞核呈蓝色着染。
(4)流式细胞术检测BMSCs典型表面标志物的表达:取处于对数期生长的BMSCs,加入PBS重悬细胞,再加入FITC-CD44(1∶200)、FITC-CD90(1∶200)、FITC-CD105(1∶200)、FITC-CD45(1∶200)、FITC-CD34(1∶200)、和FITC-HLA-DR(1∶200)抗体,避光孵育30 min,离心收集细胞。PBS洗涤细胞并重悬。上流式细胞仪检测CD44、CD90、CD105、CD45、CD34和HLA-DR阳性细胞比例。
(5)慢病毒感染:取处于对数期生长的BMSCs,以1×105个/孔的细胞数量接种于6孔板中,细胞于37 ℃、5%CO2培养箱中继续培养24 h。将细胞随机分为BMSCs组(添加PBS)、BMSCs-NC组(添加50 MOI NC重组慢病毒液)和BMSCs-HO-1组(添加50 MOI过表达HO-1重组慢病毒液)。弃去新鲜培养基,添加含2% FBS、6 μg/ml polybrene的DMEM培养基,根据分组添加重组慢病毒液。细胞继续培养24 h后,将细胞培养基更换为含10% FBS的DMEM培养基。细胞继续培养48 h后,进行后续实验。
(6)大鼠ALI模型的建立及给药处理:造模前,40只SD大鼠禁食12 h。将SD大鼠随机分为对照组、模型组、BMSCs-NC组和BMSCs-HO-1组,每组各10只,模型组、BMSCs-NC组和BMSCs-HO-1组大鼠应用腹腔注射LPS(5 mg/kg)建立ALI大鼠模型[8],对照组大鼠腹腔注射等量生理盐水。随后BMSCs-NC组大鼠尾静脉注射BMSCs-NC细胞(1×106个),BMSCs-HO-1组大鼠尾静脉注射BMSCs-HO-1细胞(1×106个),对照组和模型组大鼠尾静脉注射生理盐水。48 h后进行后续实验操作。
(7)肺泡灌洗液(BALF)炎症细胞计数和炎症因子水平检测:10%水合氯醛(300 mg/kg)麻醉大鼠,分离大鼠气管,结扎大鼠右主支气管和肺门后,插入灌洗管,用预冷的PBS灌洗左肺,并回收BALF。回收的BALF在4 ℃条件下1 500 r/min离心10 min,取上清液,采用ELISA试剂盒检测上清液中炎症因子(TNF-α、IL-6、IL-1β)水平。PBS重悬细胞沉淀,涂片,进行Giemsa染色,采用细胞计数板计数细胞总数、中性粒细胞数和巨噬细胞数。
(8)苏木素-伊红(HE)染色检测肺组织病理学变化:10%水合氯醛(300 mg/kg)麻醉后处死大鼠。取大鼠肺组织,10%福尔马林固定组织24 h。梯度酒精脱水,二甲苯透明。将组织块置于融化的石蜡中,直至石蜡完全浸入。组织包埋、切片。石蜡切片常规脱蜡至水化。苏木素染液染色3 min,自来水冲洗;1%盐酸酒精分化3 s,自来水冲洗;0.6%氨水返蓝,自来水冲洗。伊红染液染色1 min;梯度酒精脱水,二甲苯透明。滴加中性树胶,盖上盖玻片封固,显微镜下观察拍照。根据中性粒细胞浸润、肺泡壁透明膜形成、肺泡壁水肿增厚、肺泡腔内出血及水肿情况进行肺损伤程度评分:0分:无病理变化;1分:轻度病理变化;2分:中度病理变化;3分:重度病理变化;4分:非常严重的病理变化[9]。
(9)大鼠肺组织湿/干重比(W/D)测定:取大鼠肺组织,先用滤纸吸干组织表面的水分和残留的血液,称量此时肺组织的湿重(W)。随后将肺组织置于65 ℃烘箱中干燥24 h,称量此时肺组织的干重(W),计算大鼠肺组织湿/干重比(W/D)。
(10)实时荧光定量PCR(qRT-PCR)检测细胞和肺组织中HO-1和SP-C mRNA表达水平:收集BMSCs及各组大鼠肺组织,加入Trizol试剂,提取细胞和组织中的总RNA。随后按照PrimeScriptTM1st strand cDNA Synthesis Kit说明书所示,合成cDNA,此为qRT-PCR实验中所需的模板。按照2×SYBR Green qPCR Master Mix说明书所示,配制qRT-PCR反应体系,反应程序为:94 ℃ 3 min;94 ℃ 15 s,60 ℃ 20 s,72 ℃ 30 s,40个循环;72 ℃ 10 min。以GAPDH为内参,采用2-ΔΔCt法计算HO-1和SP-C mRNA表达水平。实验中所需引物序列见表1。
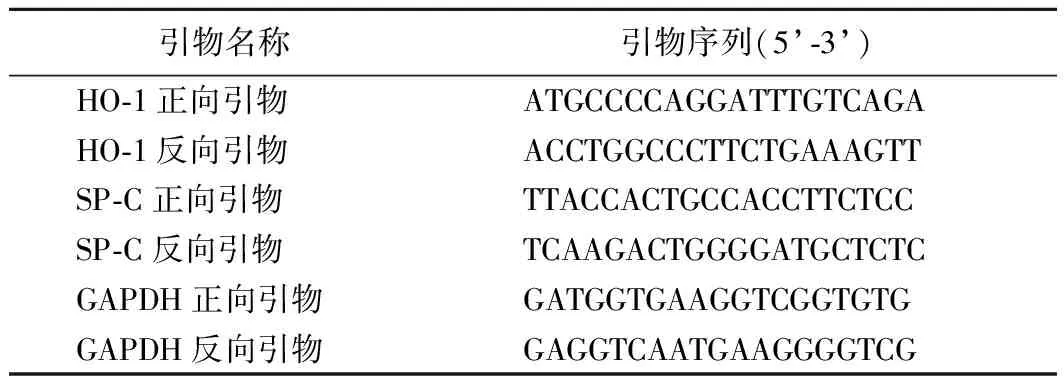
表1 qRT-PCR实验中所需引物序列
(11)蛋白质免疫印迹法(Western blot)检测BMSCs和大鼠肺组织中HO-1、SP-C、NLRP3、ASC和cleaved-Caspase-1蛋白表达水平:收集BMSCs及各组大鼠肺组织,采用蛋白裂解液裂解细胞和组织,冰上反应30 min。离心收集上清液,采用BCA蛋白定量试剂盒检测上清液蛋白水平。取30 μg蛋白加入凝胶上样孔中,进行SDS-PAGE凝胶电泳,湿转法将凝胶中的蛋白质转印至聚偏二氟乙烯膜(PVDF)膜上。封闭液室温封闭3 h。加入HO-1(1∶1 000)、SP-C(1∶1 000)、NLRP3(1∶1 000)、ASC(1∶1 000)、cleaved-Caspase-1(1∶1 000)和GAPDH(1∶5 000)抗体,于4 ℃冰箱内孵育过夜。加入二抗(1∶5 000),室温条件下孵育1 h。滴加ECL超敏化学发光液至膜上,暗室曝光,应用Image J软件进行蛋白条带半定量分析。

结 果
1.大鼠BMSCs的分离与鉴定:原代BMSCs培养7 d后,可见细胞已贴壁,细胞形态较为规整,形态多呈纺锤形。诱导成骨分化后,在BMSCs中也观察到大量致密的钙结节。同时,诱导成脂分化后,在BMSCs中观察到弥漫分布的红色脂滴。流式细胞术检测BMSCs典型表面标志物的表达情况,结果显示,BMSCs表达CD44、CD90和CD105,但不表达CD45、CD34和HLA-DR。以上数据表明成功分离得到了BMSCs,可应用于后续实验。
2.3组BMSCs中HO-1 mRNA和蛋白表达水平比较:与BMSCs组相比,BMSCs-NC组BMSCs中HO-1 mRNA和蛋白表达水平差异无统计学意义(P>0.05);与BMSCs-NC组相比,BMSCs-HO-1组BMSCs中HO-1 mRNA和蛋白表达水平明显升高(P<0.05)。见表2。

表2 3组BMSCs中HO-1 mRNA和蛋白表达水平比较
3.4组大鼠BALF中炎症细胞计数比较:与对照组相比,模型组大鼠BALF中细胞总数、中性粒细胞数和巨噬细胞数均明显升高(P<0.05);与模型组相比,BMSCs-NC组大鼠BALF中细胞总数、中性粒细胞数和巨噬细胞数均明显降低(P<0.05);与BMSCs-NC组相比,BMSCs-HO-1组大鼠BALF中细胞总数、中性粒细胞数和巨噬细胞数均明显降低(P<0.05)。见表3。

表3 4组大鼠BALF中炎症细胞计数比较
4.4组大鼠BALF中炎症因子水平比较:与对照组相比,模型组大鼠BALF中TNF-α、IL-6和IL-1β水平明显升高(P<0.05);与模型组相比,BMSCs-NC组大鼠BALF中TNF-α、IL-6和IL-1β水平明显降低(P<0.05);与BMSCs-NC组相比,BMSCs-HO-1组大鼠BALF中TNF-α、IL-6和IL-1β水平明显降低(P<0.05)。见表4。

表4 4组大鼠BALF中炎症因子水平比较
5.4组大鼠肺组织中HO-1 mRNA和蛋白表达水平比较:与对照组相比,模型组大鼠肺组织中HO-1 mRNA和蛋白表达水平明显降低(P<0.05);与模型组相比,BMSCs-NC组大鼠肺组织中HO-1 mRNA和蛋白表达水平明显升高(P<0.05);与BMSCs-NC组相比,BMSCs-HO-1组大鼠肺组织中HO-1 mRNA和蛋白表达水平明显升高(P<0.05)。见表5。

表5 4组大鼠肺组织中HO-1 mRNA和蛋白表达水平比较
6.4组大鼠肺组织病理学变化情况及W/D比较:对照组大鼠肺组织无明显异常;与对照组相比,模型组大鼠肺组织出现明显病变,肺泡水肿、炎症细胞堆积和肺泡上皮细胞变性坏死,肺损伤评分和W/D明显升高(P<0.05);与模型组相比,BMSCs-NC组大鼠肺组织病理学变化得到明显改善,肺损伤评分和W/D明显降低(P<0.05);与BMSCs-NC组相比,BMSCs-HO-1组大鼠肺组织病理学变化得到明显改善,肺损伤评分和W/D明显降低(P<0.05)。见表6。

表6 4组大鼠肺损伤评分和W/D比较
7.4组大鼠肺组织中SP-C mRNA和蛋白表达水平比较:与对照组相比,模型组大鼠肺组织中ATⅡ细胞特异性标志物SP-C mRNA和蛋白表达水平明显降低(P<0.05);与模型组相比,BMSCs-NC组大鼠肺组织中SP-C mRNA和蛋白表达水平明显升高(P<0.05);与BMSCs-NC组相比,BMSCs-HO-1组大鼠肺组织中SP-C mRNA和蛋白表达水平明显升高(P<0.05)。见表7。

表7 4组大鼠肺组织中SP-C mRNA和蛋白表达水平比较
8.4组大鼠肺组织中NLPR3、ASC和cleaved-Caspase-1蛋白表达水平比较:与对照组相比,模型组大鼠肺组织中NLPR3、ASC和cleaved-Caspase-1蛋白表达水平明显升高(P<0.05);与模型组相比,BMSCs-NC组大鼠肺组织中NLPR3、ASC和cleaved-Caspase-1蛋白表达水平明显降低(P<0.05);与BMSCs-NC组相比,BMSCs-HO-1组大鼠肺组织中NLPR3、ASC和cleaved-Caspase-1蛋白表达水平明显降低(P<0.05)。见表8。

表8 4组大鼠肺组织中NLPR3、ASC和cleaved-Caspase-1蛋白表达水平比较
讨 论
ALI的发病机制主要是过度的肺部炎症和中性粒细胞过度浸润肺组织,释放促炎细胞因子,损伤肺内皮和上皮细胞,导致肺水肿和气体交换功能受损[10]。目前,尽管ALI的治疗干预措施(如肺保护性机械通气和液体管理)取得了较大进展,但ALI总死亡率仍保持在40%左右[11]。因此,继续探索ALI新的治疗策略对ALI的临床防治具有重要意义。
LPS是革兰阴性菌细胞壁的主要成分,可引起机体免疫和炎症反应的紊乱,可用于制备ALI动物模型,诱导TNF-α、IL-1β和IL-6等促炎细胞因子的产生[12]。越来越多的证据表明,BMSCs治疗能够抑制ALI小鼠肺部炎症,减少氧化损伤和中性粒细胞胞外陷阱的释放,最终提高治疗动物的生存率。该研究表明,BMSCs是基于细胞治疗ALI的一种有效方式[13]。此外,BMSCs表现出免疫调节特性,可以保护肺泡毛细血管膜免受免疫损伤,并通过分泌有益的可溶性因子恢复肺泡液的清除[14]。然而,在持续缺氧缺血和过度炎症的环境下,移植的MSCs存活率较低,这成为MSCs用于治疗炎症性疾病的主要限制性因素[15]。因此,提高移植MSCs的存活率对修复受损组织具有重要意义。此外,MSCs具有自我更新、低免疫原性和易扩张性的特点,这使得MSCs可以作为一种理想的载体以加载保护性基因,最大限度地发挥MSCs的益处[16]。HO-1是抑制氧化应激、促炎细胞因子和促凋亡因子作用的关键成分[17]。上调HO-1的表达可改善ALI动物模型肺组织病理损伤、肺水肿、脂质过氧化,阻止细胞死亡[18]。有证据显示,MSCs与肺微血管内皮细胞(PVECs)共培养可明显抑制LPS诱导的PVECs损伤,抑制炎症和氧化应激的产生;而与MSCs相比,过表达HO-1的MSCs可进一步改善LPS诱导的PVECs损伤,抑制炎症和氧化应激的产生,表明过表达HO-1可增强MSCs对LPS诱导的PVECs损伤的抑制作用[19]。本研究结果显示,LPS诱导建立的ALI大鼠肺组织出现明显病变,肺泡水肿、炎症细胞堆积和肺泡上皮细胞变性坏死,ATⅡ细胞特异性标志物SP-C表达水平降低,炎症细胞数和炎症因子水平明显升高。BMSCs治疗可明显改善ALI大鼠肺组织病理学变化,促进SP-C表达,抑制炎症细胞数和炎症因子水平的升高,而与BMSCs相比,过表达HO-1的BMSCs对ALI的改善作用进一步增强,表明过表达HO-1可增强BMSCs对ALI的保护作用。
NLRP3是一种细胞质模式识别受体,可被某些病原体相关分子模式或损伤相关分子模式激活,如细菌、病毒和ATP[20]。NLRP3的激活导致适配器ASC的组装,导致pro-Caspase-1的自激活并裂解为酶成熟的Caspase-1,进一步将pro-IL-1β和pro-IL-18分别裂解为成熟的IL-1β和IL-18[21]。尽管NLRP3炎症小体的激活是一种宿主防御机制,以消除感染性疾病中入侵的病原体,但NLRP3炎症小体的过度激活也是异常炎症、组织损伤和器官功能障碍的核心因素[22]。最近的研究表明,在ALI小鼠模型中,NLRP3炎症小体被激活,而抑制NLRP3炎症小体激活可抑制TNF-α和IL-1β的产生,改善ALI小鼠肺组织病理学变化[23]。在一项关于2型糖尿病的研究中发现,MSCs可通过抑制NLRP3炎症小体的激活,抑制IL-1β、IL-18和TNF-α的产生,从而减轻胰岛素抵抗[24]。另外,MSCs在柯萨奇病毒B3诱导的心肌炎中具有心脏保护作用,该作用主要是通过抑制NLRP3、ASC、Caspase-1、IL-1β和IL-18的表达实现[25]。本研究中,BMSCs治疗可明显抑制NLRP3、ASC和Caspase-1的表达,降低IL-1β和TNF-α水平。有研究发现,一氧化碳作为HO-1氧化代谢的产物,可以通过抑制NLRP3炎症小体的激活来保护肺免于炎症损伤[26]。因此我们通过给予过表达HO-1的BMSCs.进一步促进体内BMSCs的增殖和分化,并且由于HO-1具有抑制炎症小体激活的作用,ALI大鼠肺组织中NLRP3、ASC和Caspase-1表达水平明显升高,IL-1β和TNF-α水平明显升高,与BMSCs相比,过表达HO-1的BMSCs对ALI的抑制作用进一步增强,从而发挥对ALI的治疗作用。本研究结果表明,过表达HO-1可增强BMSCs对ALI大鼠NLRP3炎症小体激活的抑制作用。
综上所述,过表达HO-1的BMSCs可能通过抑制NLRP3炎症小体激活,抑制炎症反应,促进ATⅡ细胞的形成,改善大鼠ALI。
