维生素A对过氧化氢诱导的奶牛乳腺上皮细胞内乳脂合成的影响
2021-12-08赵艳丽闫素梅郭晓宇郭咏梅齐敬宇
郝 颖 赵艳丽 闫素梅 郭晓宇 郭咏梅 齐敬宇
(内蒙古农业大学动物科学学院,内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特 010018)
乳脂肪是构成牛奶的重要组成成分之一,也是衡量乳品质的关键指标,其含量与组成是奶业核心竞争力重要标志。在泌乳期间的奶牛,尤其是高产奶牛,由于合成和分泌大量的乳汁,乳腺组织代谢增强,对能量和氧的需求与利用增加,奶牛乳腺上皮细胞(BMECs)内呼吸作用加强,导致奶牛体内产生过多的活性氧(ROS),当奶牛体内产生的大量ROS与机体抗氧化防御系统的清除能力不平衡时,会导致乳腺组织发生氧化应激[1-2]。乳腺组织是泌乳动物体内代谢最强的组织之一,BMECs是乳腺组织的主要实质细胞,是合成和分泌乳汁中乳脂和乳蛋白的主要场所。氧化应激的发生会对乳腺组织造成损伤,使其易遭受病原微生物的感染,易患乳房炎,并且会降低乳脂和乳蛋白的合成,影响乳产量和乳品质[3],使奶牛的淘汰率增加,对奶业的健康发展造成重大损失。因此,缓解BMECs氧化应激的发生,进而改善乳腺健康和保证乳品质对奶业的健康持续发展具有非常重要的意义。本课题组前期研究得出,饲粮添加高于推荐剂量的维生素A可提高奶牛抗氧化功能和产乳性能[4],体外研究也发现,维生素A的添加可促进BMECs内谷胱甘肽过氧化物酶1(GPx1)、谷胱甘肽过氧化物酶4(GPx4)和硫氧还蛋白还原酶1(TrxR1)的活性及其基因表达,促进乳脂合成相关基因的表达,对氧化损伤细胞具有缓解作用[4-6],但其机制尚不清楚。过氧化氢(H2O2)是属于ROS的一种体内代谢产物,可消耗抗氧化物质使机体抗氧化能力降低,对细胞有一定的毒害作用,其极容易穿过细胞膜,在细胞内与Fe2+反应生成高活性的自由基。Jin等[7]研究发现,过量H2O2可引起BMECs氧化损伤,降低细胞抗氧化能力。由于H2O2性质较稳定并容易获得,所以目前很多研究都将其作为氧化损伤模型的诱导剂[8]。鉴于此,本试验以H2O2为诱导剂,研究不同浓度的维生素A对H2O2诱导的BMECs内乳脂合成的影响,为合理调控乳腺内氧化还原平衡,进而改善乳腺健康、提升原料乳质量提供理论依据。
1 材料与方法
1.1 试验设计
本试验采用单因子完全随机试验设计,将第3代BMECs随机分成对照组(CON组)、H2O2损伤组(H2O2组)和7个维生素A预保护组,每个组6个重复。其中,CON组BMECs不进行维生素A与H2O2处理,用生长培养基于5% CO2、37 ℃条件下培养30 h;H2O2组BMECs进行H2O2损伤处理,即用CON组培养基于5% CO2、37 ℃条件下培养24 h,再加入H2O2继续培养6 h;7个维生素A预保护组BMECs预添加维生素A后进行H2O2损伤处理,即在CON组培养基中添加不同浓度维生素A后于5% CO2、37 ℃条件下培养24 h,再加入H2O2继续培养6 h,维生素A浓度分别为0.05(0.05VAH组)、0.10(0.1VAH组)、0.20(0.2VAH组)、0.50(0.5VAH组)、1.00(1VAH组)、2.00(2VAH组)和4.00 μg/mL(4VAH组)。培养结束后收集培养液和细胞用于分析测定。维生素A浓度以及H2O2浓度与处理时间依据本课题组前期研究结果[4,7]设定,H2O2浓度与处理时间分别为800 μmol/L和6 h。
1.2 试剂配制
生长培养基:在DMEM/F12基础培养基中添加10%胎牛血清(FBS,Gibco公司,美国)、0.5%胰岛素转铁蛋白硒钠(ITS,Gibco公司,美国)、10 ng/mL表皮生长因子(EGF,Sigma公司,美国)、2.5 μg/mL两性霉素(Sigma公司,美国)、2%双抗(Gibco公司,美国)、1 μg/mL氢化可的松(Sigma公司,美国)。
维生素A贮备液:称取100 mg的视黄酸(RA,Sigma公司,美国)溶解于5 mL的二甲基亚砜(DMSO,Amresco公司,美国)溶液中,配制成20 mg/mL的维生素A原液,然后再用DMSO溶液将维生素A原液稀释成0.05、0.10、0.20、0.50、1.00、2.00和4.00 mg/mL的维生素A贮备液,用0.22 μm过滤器过滤,避光保存。
H2O2工作液:3%的H2O2(Sigma公司,美国)浓度约为0.88 mol/L,用超纯水将0.88 mol/L的H2O2原液稀释成800 mmol/L的H2O2贮备液,最后用不加FBS的生长培养基将H2O2贮备液配制成880 μmol/L的工作液。
1.3 BMECs的培养
BMECs原代培养采用胶原酶消化法,操作方法参考Sheng等[9]的方法进行。将从屠宰场采回的健康奶牛乳腺去除组织表层,再剪成约1 cm3大小的组织块,用3×双抗磷酸盐缓冲溶液(PBS,HyClone公司,美国)清洗。在超净台里用PBS、75%酒精分别清洗后从乳腺内部剪取腺泡丰富的部位剪碎至糊状,再加入等体积的0.5%胶原酶Ⅱ(Gibco公司,美国),37 ℃消化1 h。最后用80目滤网过滤,滤液262×g离心5 min后弃上清,用PBS清洗细胞,在相同条件下离心3 min,弃上清,加入生长培养基悬浮细胞并接种于25 cm2细胞培养瓶中,于37 ℃、5% CO2条件下培养。当细胞贴壁度达到80%~90%时,使用0.05%胰蛋白酶/乙二胺四乙酸(Gibco公司,美国)进行细胞纯化并传代。原代细胞含有少量的成纤维细胞,但在纯化与传代培养过程中,成纤维细胞很少被传入第3代细胞中,详见图1。

图1 原代(a)和第3代(b)奶牛乳腺上皮细胞的显微镜图像Fig.1 Microscopic images of primary (a)and F3 (b) bovine mammary epithelial cells (100×)
1.4 测定指标与方法
1.4.1 细胞活力
BMECs的细胞活力采用Cell Counting Kit-8(CCK-8)法测定,使用相对增殖率(RGR)表示。将细胞悬液接种到96孔细胞板内,按试验设计处理后加入20 μL的CCK-8溶液(北京碧云天生物技术研究所),继续培养1 h,使用全自动酶标仪检测各孔450 nm波长处的吸光度值(OD450 nm)。
RGR(%)=(试验组OD450 nm/CON组OD450 nm)×100。
1.4.2 甘油三酯(TG)含量、抗氧化指标以及乳脂合成相关酶活性
按照试验设计培养结束后弃上清,用PBS清洗2次,每孔加入200 μL裂解液混匀后室温静置10 min,收集裂解液于1.5 mL无酶无菌离心管中,70 ℃加热10 min,室温下622×g离心5 min后取上层清液进行TG含量测定。TG含量使用酶法,按照试剂盒说明书(北京普利莱基因技术有限公司)进行测定。
细胞培养液总抗氧化能力(T-AOC)采用钼酸铵显色法测定,总超氧化物歧化酶(T-SOD)活性采用黄嘌呤氧化酶法测定,过氧化氢酶(CAT)活性采用比色法测定,谷胱甘肽过氧化物酶(GPx)活性采用二硫代二硝基苯甲酸法测定,试剂盒购于南京建成生物工程研究所,具体测定方法按照试剂盒说明书进行。细胞裂解液中ROS和TrxR1以及乳脂合成相关酶——脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶(ACC)、脂酰辅酶A去饱和酶(SCD)和脂蛋白酯酶(LPL)活性采用酶联免疫吸附试验(ELISA)法测定,试剂盒购自美国R&D公司,具体测定方法按照试剂盒说明书进行。细胞裂解液中GPx和TrxR1活性换算为蛋白质基础,蛋白质含量采用二喹啉甲酸法测定。
1.4.3 细胞内抗氧化和乳脂合成相关基因的相对表达量


表1 引物序列及参数Table 1 Primer sequences and parameters
1.5 数据统计与分析
试验数据利用SAS 9.0软件的ANOVA程序进行单因素方差分析,采用Duncan氏法进行多重比较。统计结果以P≤0.05表示组间差异显著,P>0.05表示组间差异不显著。
2 结果与分析
2.1 维生素A对H2O2诱导的BMECs内RGR、抗氧化指标和ROS活性的影响
由表2可知,H2O2组的RGR显著低于CON组(P≤0.05);与H2O2组相比,0.1VAH~4VAH组的RGR显著增加(P≤0.05),以1VAH组最高。与CON组相比,H2O2组的GPx、T-AOC、T-SOD、CAT、TrxR活性显著降低(P≤0.05),但ROS活性显著增加(P≤0.05)。与H2O2组相比,0.2VAH~4VAH组的GPx活性显著升高(P≤0.05),以1VAH组最高;0.2VAH~2VAH组的T-AOC显著增加(P≤0.05),其他维生素A预保护组变化不显著(P>0.05);1VAH~4VAH组的TrxR活性显著增加(P≤0.05),其他维生素A预保护组变化不显著(P>0.05);1VAH组的T-SOD和CAT活性显著增加(P≤0.05),但ROS活性显著下降(P≤0.05)。
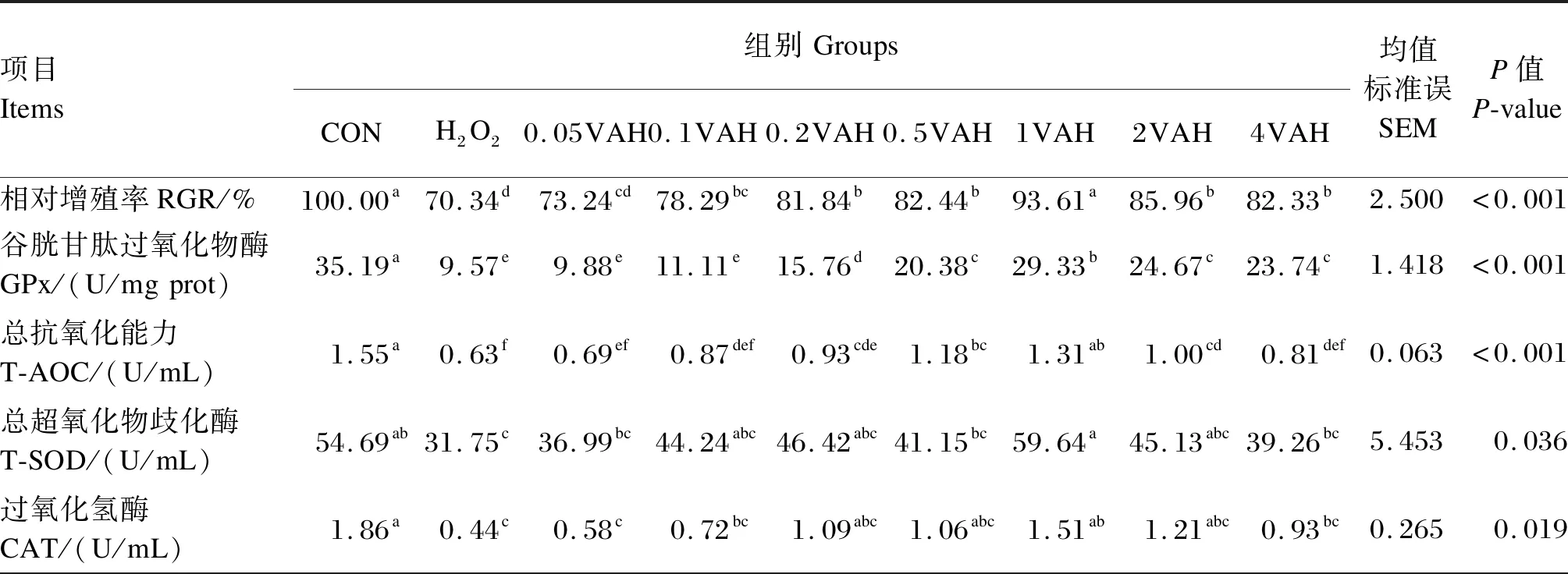
表2 维生素A对H2O2诱导的BMECs内RGR、抗氧化指标和ROS活性的影响Table 2 Effects of VA on RGR,antioxidant indexes and ROS activity of BMECs induced by H2O2

续表2项目Items组别GroupsCONH2O20.05VAH0.1VAH0.2VAH0.5VAH1VAH2VAH4VAH均值标准误SEMP值P-value硫氧还蛋白酶TrxR1/(U/mgprot)4.65a3.29c3.37c3.40c3.90bc3.78bc4.11ab4.11ab4.08ab0.1590.002活性氧ROS/(U/mL)67.20c78.40a70.20bc77.70a77.40a75.33ab66.73c76.13ab69.73bc1.8420.003
2.2 维生素A对H2O2诱导的BMECs内TG含量和乳脂合成相关酶活性的影响
由表3可知,H2O2组的TG含量显著低于CON组(P≤0.05)。与H2O2组相比,1VAH组的TG含量显著升高(P≤0.05)。与CON组相比,H2O2组的ACC、LPL和SCD活性显著降低(P≤0.05),FASN活性无显著变化(P>0.05)。与H2O2组相比,0.5VAH和1VAH组的FASN活性显著升高(P≤0.05);0.1VAH~4VAH组的ACC活性显著升高(P≤0.05);0.1VAH、1VAH、2VAH和4VAH组的LPL活性显著升高(P≤0.05);0.2VAH、1VAH、2VAH和4VAH组的SCD活性显著升高(P≤0.05)。

表3 维生素A对H2O2诱导的BMECs内TG含量和乳脂合成相关酶活性的影响Table 3 Effects of VA on TG content and enzyme activities related to milk fat synthesis of BMECs induced by H2O2
2.3 维生素A对H2O2诱导的BMECs内抗氧化和乳脂合成相关基因表达的影响
由表4可知,与CON组相比,H2O2组的GPx1、GPx4、TrxR1、FASN、ACC和PPARγ相对表达量显著降低(P≤0.05)。与H2O2组相比,0.05VAH~4VAH组的GPx1、SCD和PPARγ相对表达量显著升高(P≤0.05),GPx1相对表达量以1VAH组最高;1VAH~4VAH组的GPx4相对表达量显著升高(P≤0.05),以4VAH组最高;0.1VAH~4VAH组的TrxR1相对表达量显著升高(P≤0.05);0.2VAH~4VAH组的FASN和LPL相对表达量显著升高(P≤0.05),FASN相对表达量以1VAH组最高;0.1VAH和0.2VAH组的ACC相对表达量显著升高(P≤0.05);0.05VAH~2VAH组的SREBP1相对表达量显著升高(P≤0.05);0.05VAH~0.5VAH组的FABP3相对表达量显著升高(P≤0.05)。
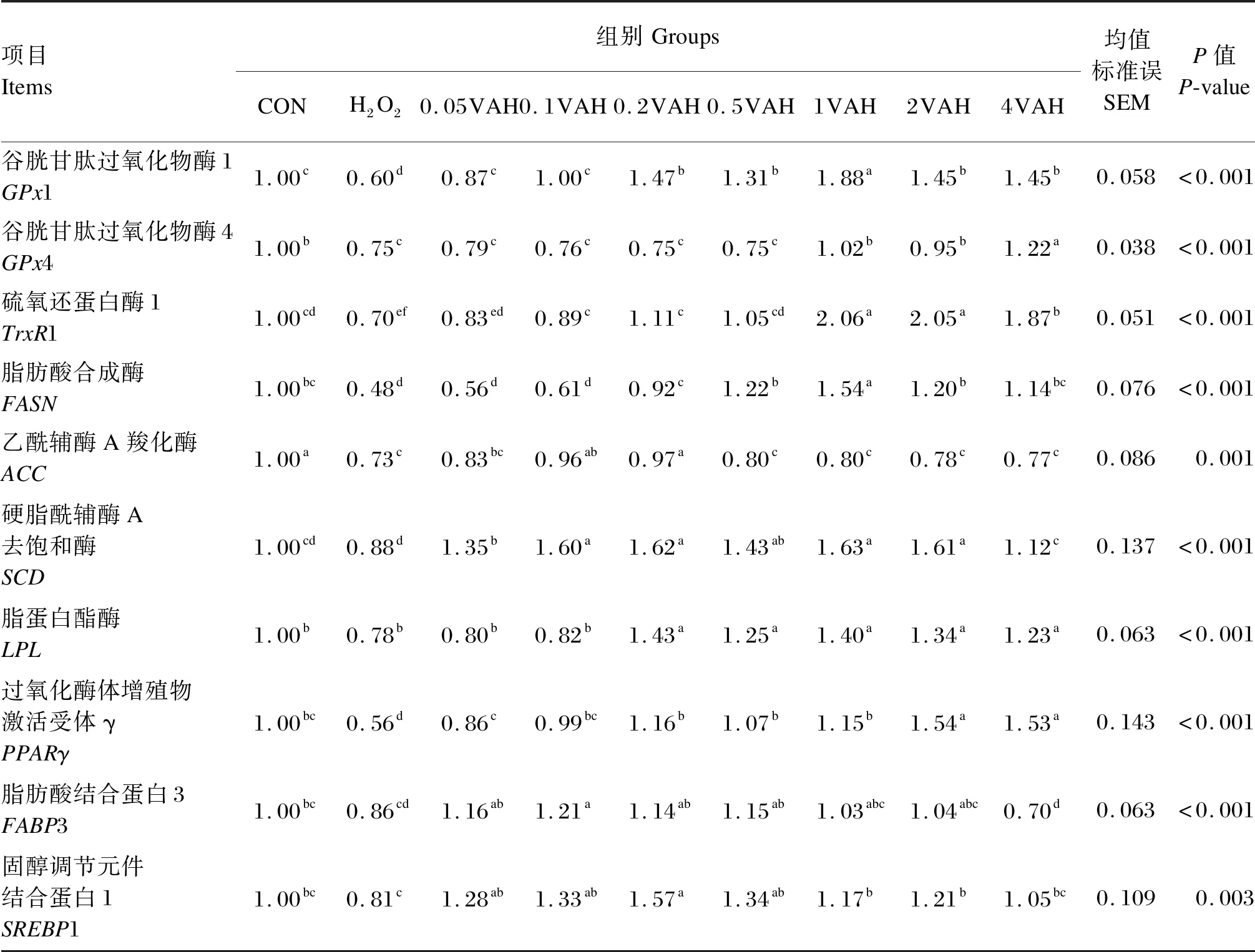
表4 维生素A对H2O2诱导的BMECs内抗氧化和乳脂合成相关基因表达的影响Table 4 Effects of VA on expression of genes involved in antioxidation and milk fat synthesis in BMECs induced by H2O2
3 讨 论
动物机体在正常的生理代谢情况下会产生具有氧化性的自由基,例如ROS和H2O2等,但ROS过量产生并积累可对动物组织和细胞产生实质性损害,导致细胞氧化应激[10-11]。抗氧化酶GPx、TrxR、T-SOD和CAT在催化还原H2O2和一些脂溶性过氧化物方面发挥了重要的作用,可以清除组织细胞由氧化损伤而产生的自由基[1,12]。在人体肝细胞及BMECs上的研究表明,H2O2损伤细胞后,细胞内GPx1、CAT和超氧化物歧化酶(SOD)的活性显著降低,而ROS活性显著升高[5,11]。本课题组前期研究得出,奶牛饲粮添加高于推荐剂量的维生素A(220 IU/kg饲粮)可以提高血清抗氧化酶GPx、TrxR、T-SOD、CAT等的活性,降低ROS活性,减缓机体及细胞氧化损伤[5],体外研究也得出了相似的结果[7]。本试验从体外进一步验证了H2O2会导致细胞活力和抗氧化功能的降低,抗氧化酶活性及抗氧化相关基因GPx1、GPx4和TrxR表达的下调,ROS活性显著增加;采用0.20~2.00 μg/mL维生素A进行预保护会减缓细胞氧化损伤,抑制ROS活性的增加,尤以1.00 μg/mL的维生素A效果最好。
TG含量约占乳脂总量的98%,其含量高低可以反映乳脂的合成情况。TG主要在哺乳动物的乳腺组织中积累形成脂质滴,其主要成分是脂肪酸[13]。乳中脂肪酸有2个来源途径:一是中短链脂肪酸的从头合成;二是从血液中吸收的长链脂肪酸。FASN和ACC是乳腺内短链(C4~C8)和中链(C10~C14)以及一部分C16脂肪酸从头合成的2个关键酶[13],并且ACC也是牛乳脂合成的限速酶。LPL和FABP3参与BMECs内多种组织脂肪酸的摄取和转运,LPL将血液中摄取的乳糜微粒和TG水解成甘油和分子质量较小的脂肪酸,然后FABP3将脂肪酸从细胞膜运送到TG和磷脂合成与氧化的位点上[14]。SCD在乳脂合成过程中具有脱氢去饱和作用,FABP3主要作用是为SCD提供脱氢底物[14]。有研究表明,用氧化诱导剂作用BMECs后,细胞内抗氧化酶活性降低,导致细胞氧化损伤,进而引起乳脂合成相关酶活性降低[3,13],抑制乳脂的合成[15]。本研究发现,添加维生素A预保护后可减缓H2O2引起的细胞内TG含量、与脂肪酸从头合成相关基因FASN和ACACA的表达和其对应酶活性及其与脂肪酸摄取相关酶LPL和SCD活性的下降。
PPARγ和SREBP1是脂肪合成中重要的转录因子和核受体,可以调节乳腺内FASN、ACACA、SCD、LPL和FABP3等靶基因的表达。奶山羊乳腺细胞中敲除PPARγ会导致上述基因的表达量显著下降[16],表明PPARγ调节乳腺细胞中脂肪酸的从头合成和去饱和过程。Wang等[13]研究指出,脂多糖(LPS)诱导的BMECs会使SREBP1活性及其基因相对表达量下降,导致TG合成和分泌减少。H2O2诱导损伤神经元细胞后,使PPARγ磷酸化并使其失活[17],而PPARγ激活可以抑制ROS和脂质过氧化物产生,提高SOD活性和谷胱甘肽(GSH)含量,减少细胞氧化损伤[18]。本课题组前期研究指出,在BMECs中添加PPARγ抑制剂GW9662后,细胞内PPARγ和TrxR的相对表达量显著降低[19]。过氧化酶体增殖物激活受体(PPAR)与配体结合激活后能和类维生素A的X受体(RXR)形成异源二聚体,然后和靶基因上的PPAR反应元件相互作用调控靶基因的转录和表达,而维生素A的代谢产物9-顺式维甲酸(9-cisRA)是RXR的有效配体[20]。本研究结果得出,添加维生素A预保护逆转了H2O2诱导引起的BMECs中PPARγ、FASN、ACC和LPL相对表达量的降低,并上调了SREBP1、SCD和FABP3的表达,提示维生素A可能通过抑制转录因子PPARγ和SREBP1表达的下降,促进脂肪酸从头合成和脂肪酸摄取来缓解氧化损伤引起的细胞内TG合成的下降;但维生素A在减缓氧化损伤的细胞内TG合成降低的同时,是否对乳脂肪中各种脂肪酸的组成产生影响尚需在后续的研究中进一步探讨。
大鼠发生脂肪肝炎后,脂肪组织内TrxR、GPx的活性与TrxR的基因表达量显著降低,氧化应激加剧,引起肝组织中游离脂肪酸含量增加,PPARγ的基因表达量显著减少[21]。在小鼠上的研究发现,增加血清GPx活性可以促进PPARγ活化,减轻动脉炎症并降低体内氧化应激水平[22]。本课题组前期研究指出,沉默BMECs中GPx基因可降低PPARγ基因的表达[20]。上述结果提示维生素A缓解H2O2引起的BMECs内乳脂合成的降低可能是通过增强TrxR、GPx活性引起PPARγ的活性升高,因此有必要利用基因沉默或过表达技术从该领域继续进行深入研究。本试验从体外研究了维生素A对氧化损伤后BMECs内乳脂合成减少的缓解效果,并得出1.00 μg/mL维生素A的效果较好。在实际生产中,饲粮中维生素A的添加量具体为多少可以对乳腺组织氧化损伤具有较好的减缓效果,还需要在体内进一步验证。
4 结 论
维生素A对H2O2诱导的氧化损伤引起的BMECs抗氧化能力的降低,乳脂合成、转录因子PPARγ和SREBP1以及从头合成基因FASN、ACC与脂肪酸摄取基因LPL、SCD和FABP3表达的下降具有减缓作用,并呈剂量依赖性,以0.20~2.00 μg/mL维生素A的效果较好,尤以1.00 μg/mL维生素A的效果最好。
