男女性系统性红斑狼疮患者的差异表达蛋白及其生物学功能-基于iTRAQ的蛋白质组学研究▲
2021-12-08黄子宸郑乐婷刘秀华徐涓涓
黄子宸 郑乐婷 李 晞 刘秀华 雷 玲 文 静 徐涓涓 赵 铖
(1 广西医科大学第一附属医院风湿免疫科,南宁市 530021,电子邮箱;mh1990.pink@163.com;2 南京医科大学附属逸夫医院风湿免疫科,江苏省南京市 210000;3 广西医科大学第一附属医院临床检验中心,南宁市 530021;4 广西柳州市工人医院风湿免疫科,柳州市 545000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性进行性、反复发作的自身免疫性疾病,其特征为多系统炎症及可产生大量自身免疫性抗体。SLE的发生和发展与多种因素相关,包括遗传、种族、免疫、激素、环境因素[1-2]。SLE 好发于青年女性,发病高峰为15~40岁,男女发病比例为1 ∶9至1 ∶10[3-5]。虽然女性SLE的发病率比男性高,但是男性SLE病情比女性严重[4-8]。本文采用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)技术,比较初治活动期男女性SLE患者与相应的健康人血浆标本中的差异蛋白表达谱,以了解男女性 SLE患者的人体蛋白质组表达差异,为男女性SLE发病差异的研究提供理论依据和实验基础。
1 材料与方法
1.1 临床资料 收集广西医科大学第一附属医院风湿免疫科2017年7~10月间病房及门诊收治的16例SLE活动期初治患者,其中男性8例,年龄为19~49(29±11.5)岁,女性8例,年龄25~51(35±8.6)岁。入组标准:诊断均符合1997年修订的美国风湿学会SLE分类标准[9],由两名副主任以上职称的专科医师确诊。排除标准:妊娠、分娩或哺乳期女性,合并癌症、肝炎、结核、过敏、严重感染、近期有手术创伤及其他自身免疫性疾病者。同期选取与入组患者的年龄性别匹配的16例体检者,排除标准:妊娠、分娩或哺乳期女性,合并癌症、肝炎、结核、过敏、严重感染、近期有手术创伤及其他自身免疫性疾病者。其中男性8例,年龄为29~44(33.6±6)岁,女性8例,年龄28~43(33.4±4.8)岁。本研究经广西医科大学第一附属医院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 实验仪器和试剂 Agilent 1260 Infinity Ⅱ液相色谱系统购自Agilent Technologies公司,Q Exactive Plus质谱仪、Multiskcan FC酶标仪、Easy nLC色谱系统、NanoDrop 2000微量紫外分光光度计均购自美国Thermo Fisher Scientific公司。iTRAQ Reagent-4/8plex Multiplex Kit(批号:4390812)购自AB SCIEX公司,Multiple Affinity Removal LC Column-Human 14(批号:Hu14)购自Agilent Technologies公司。
1.3 实验方法
1.3.1 样品采集:采集外周静脉血2 mL,6 h内分离血浆,在-80℃下保存待测。共分为4组进行实验,包括SLE女性组、SLE男性组、健康女性组、健康男性组,各组各自将组内8例研究对象的血浆进行混合。
1.3.2 样品去血浆高丰度处理:取适量样本,采用人类的去血浆高丰度亲和色谱柱Agilent Multiple Affinity Removal LC Column-Human 14,按照说明书中的操作方法去除高丰度蛋白质,得到低丰度组分溶液。应用10 kD超滤管进行超滤浓缩,加入低丰度组分溶液的一倍体积的SDT裂解液,沸水浴15 min,8.36×107r/min离心15 min,取上清。采用二喹啉甲酸法进行蛋白质定量。分装样品,于-80℃下保存。
1.3.3 电泳:取蛋白质20 μg,加入5×上样缓冲液4 μL,沸水浴5 min,进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(恒压250 V,40 min),考马斯亮蓝染色。
1.3.4 FASP酶解:各样品取30 μL蛋白质溶液,分别加入DTT至终浓度为100 mmol/L,沸水浴5 min,冷却至室温。加入200 μL UA缓冲液(为8 mol/L尿素+150 mmol/L Tris-HCl,pH 8.5)混匀,转入30 kD超滤离心管中,8.36×107r/min离心15 min,弃滤液(重复该步骤1次)。加入100 μL碘乙酰胺缓冲液(100 mmol/L碘乙酰胺加入UA缓冲液中),振荡,室温避光反应30 min,8.36×107r/min离心15 min。加入100 μL UA缓冲液后离心(8.36×107r/min,15 min),重复2次。加入100 μL 稀释10倍的Dissolution buffer,8.36×107r/min离心15 min,重复2次。加入40 μL Trypsin缓冲液(4 μg Trypsin加入40 μL Dissolution buffer),振荡后37℃放置16~18 h。换新收集管,8.36×107r/min离心 15 min;再加入40 μL稀释10倍的Dissolution buffer,8.36×107r/min离心15 min,收集滤液。使用NanoDrop 2000微量紫外分光光度计进行肽段定量。
1.3.4 iTRAQ标记:各样品分别取100 μg肽段,按照iTRAQ Reagent-4/8plex Multiplex Kit说明书的操作步骤进行标记。
1.3.5 高效液相色谱分级:将每组标记后的肽段混合,采用Agilent 1260 Infinity Ⅱ液相色谱系统进行高效液相色谱(high-performance liquid chromatography,HPLC)分级。缓冲液A液由10 mmol/L甲酸铵、5% ACN组成,pH为10.0;B液由10 mmol/L甲酸铵、85% ACN组成,pH为10.0。色谱柱以A液平衡,样品由手动进样器上样到色谱柱进行分离,流速为1 mL/min。液相梯度为:0~25 min,B液为0%; 25~30 min,B液线性梯度从0%到7%;30~65 min,B液线性梯度从7%到40%;65~70 min,B液线性梯度从40%到100%;70~85 min,B液维持在100%。洗脱过程中监测214 nm处的吸光度值,每隔1 min收集洗脱组分,共计收集洗脱组分约36份,冻干保存。
1.3.6 质谱分析:每份样品采用纳升流速Easy-nLC色谱系统进行分离。样品经色谱分离后用Q Exactive Plus 质谱仪进行质谱分析,检测方式为正离子,母离子扫描范围350 ~1800 m/z,一级质谱分辨率为70 000,AGC Target为3e6,一级Maximum IT为50 ms。多肽和多肽碎片的质量电荷比按照下列方法采集,即每次全扫描(Full Scan)后采集10个碎片图谱(MS2 scan),MS2 Activation Type为HCD,Isolation Window为2 m/z,二级质谱分辨率17 500,Microscan为1,二级Maximum IT为45 ms,Normalized Collision Energy为30 eV。
1.4 质谱原始数据处理 使用Proteome Discoverer 2.1(Thermo Fisher Scientific公司)软件将Q Exactive Plus产生的原始图谱文件(RAW文件)转化为.mgf文件,通过软件内置的工具提交到MASCOT 2.5服务器进行数据库检索,数据库选择UniProt(http://www.uniprot.org,下载时间为2019年8月1日)。然后再通过Proteome Discoverer 2.1将MASCOT服务器上形成的查库文件(DAT文件)传回软件,根据FDR<0.01的标准对数据进行筛选鉴定,获得高度可信的定性结果。以FC>1.2且P值<0.05作为标准筛选差异表达蛋白,其中FC为表达倍数。
1.5 生物信息分析
1.5.1 功能注释:利用Blast2GO(数据库版本:go_201504.obo;下载地址:www.geneontology.org)对差异表达蛋白集合进行基因本体论(Gene Ontology,GO)注释,注释的过程包括序列比对、GO条目提取、GO注释和补充注释4个步骤。
1.5.2 通路注释:在京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库中(https://www.kegg.jp/)对差异表达蛋白集合进行KEGG通路注释,先利用KAAS软件,比对KEGG GENES数据库,然后将差异表达蛋白序列进行KO归类,并根据KO归类自动获取目标蛋白质序列参与的通路信息。
1.5.3 GO注释与KEGG注释的富集分析:在对差异表达蛋白集合进行GO功能注释或KEGG通路注释的富集分析时,采用Fisher精确概率法,比较各个GO条目或KEGG通路在目标蛋白质集合和总体蛋白质集合中的分布情况,评价某个GO条目或KEGG通路蛋白质富集度的显著性水平,以P<0.05为差异有统计学意义。
2 结 果
2.1 质检结果 电泳结果显示蛋白质质量好,总量足够,各组样本分离情况佳且基本相同(见图1);色谱-质谱分析中,蛋白预质谱显示酶解正常,色谱-质谱行为正常(见图2),可进行下一步实验。
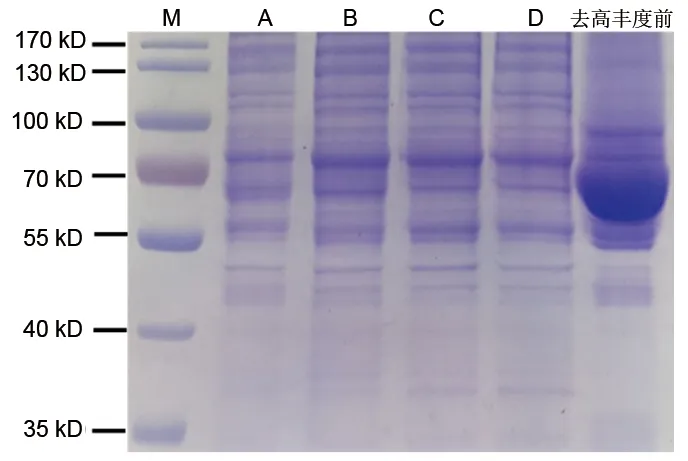
图1 4组样本SDS-PAGE电泳图
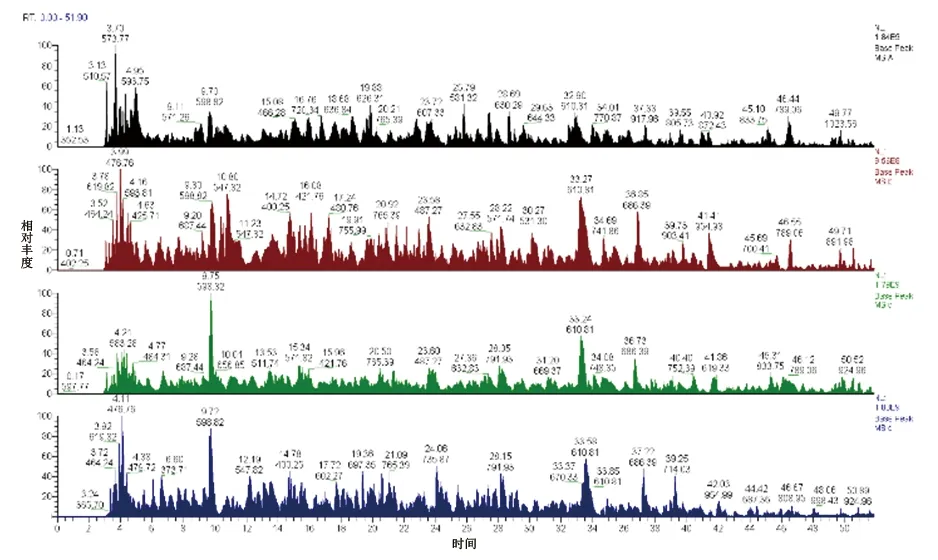
图2 色谱-质谱分析的Basepeak图谱
2.2 质谱鉴定结果 共得到图谱258 041张,通过MASCOT进行分析后,匹配得到图谱数量共55 831张,鉴定出1 283个蛋白共18 126个肽段,其中含10 577个唯一性肽段。
2.3 差异表达蛋白筛选结果 SLE女性组与SLE男性组共存在277个差异表达蛋白,其中,与SLE男性组相比,SLE女性组表达上调蛋白193个,表达下调蛋白84个;SLE女性组与健康女性组共存在242个差异表达蛋白,其中,与健康女性组相比,SLE女性组表达上调蛋白181个,表达下调蛋白61个;SLE男性组与健康男性组共存在214个差异表达蛋白,其中,与健康男性组相比,SLE男性组表达上调蛋白114个,表达下调蛋白100个。女性SLE组/健康女性组、男性SLE组/健康男性之间共有26个相同的差异表达蛋白,包括表达上调蛋白14个,表达下调蛋白12个。差异倍数由大到小排名前20蛋白见表1及表2。SLE女性/SLE男性之间的差异表达蛋白中,共有193个蛋白涉及免疫系统过程,包括主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类抗原、肌球蛋白反应性免疫球蛋白重链可变区、免疫球蛋白λ链等;SLE女性/SLE男性之间的差异表达蛋白、女性SLE/健康女性之间的差异表达蛋白同时涉及的信号通路包括类风湿关节炎、扩张性心肌病、自身免疫性甲状腺疾病、病毒性心肌炎和哮喘等。
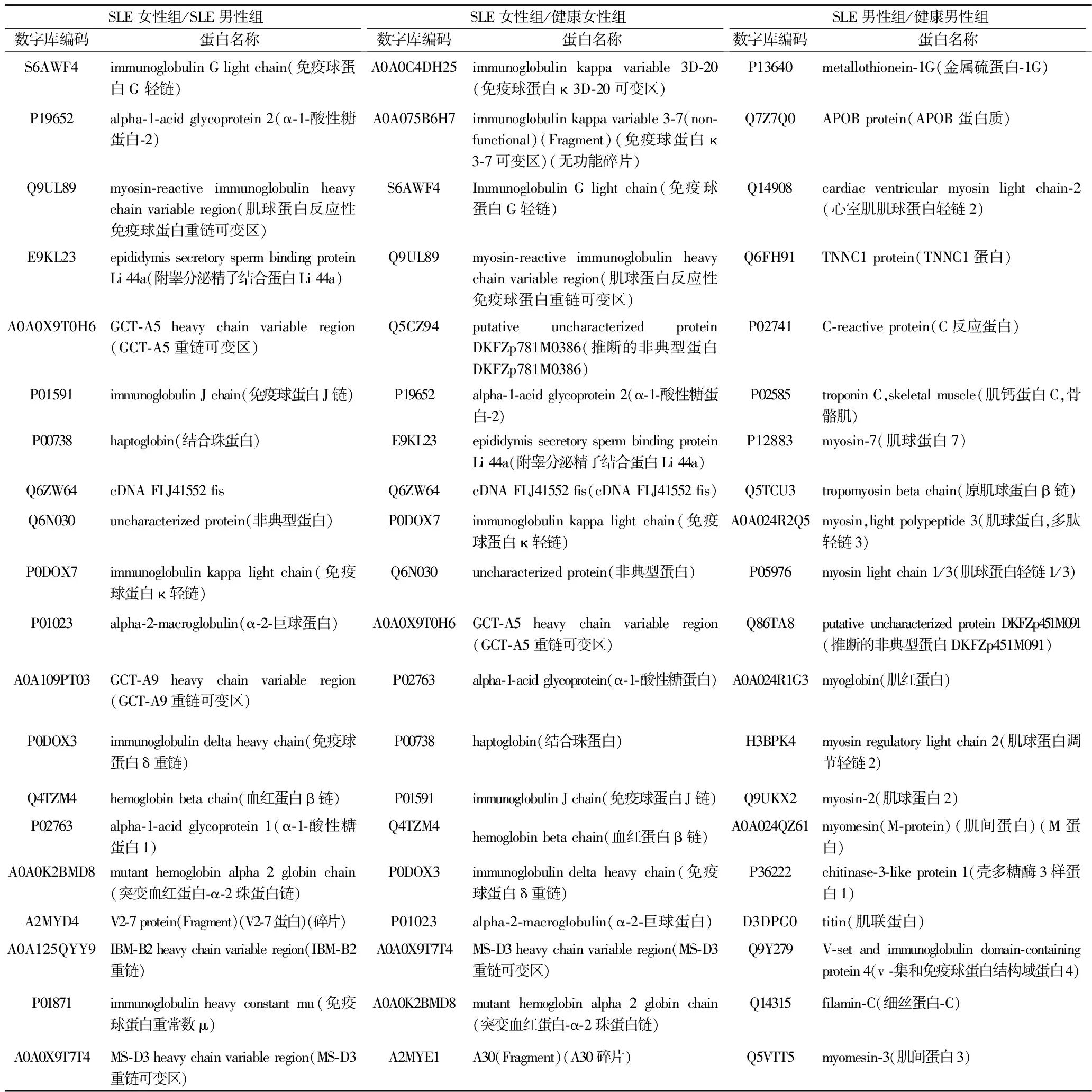
表1 排名前20的差异表达上调蛋白
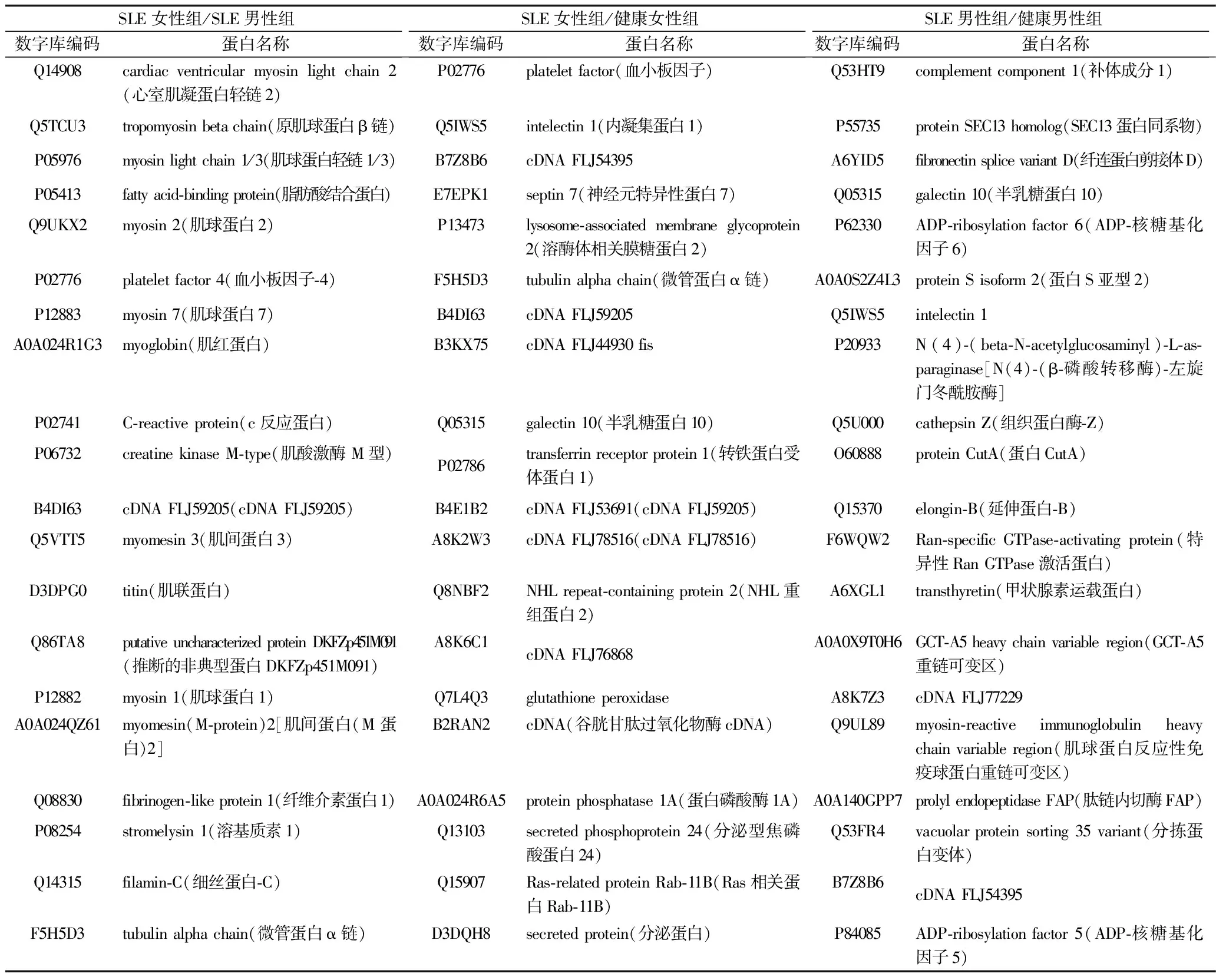
表2 排名前20的差异表达下调蛋白
2.4 生物信息学分析结果
2.4.1 GO分析:(1)SLE女性组与SLE男性组的277种差异表达蛋白,涉及23种生物学过程、17种细胞组分和12种分子功能。其中,生物过程包括生物调节(259个差异表达蛋白)、免疫系统过程(193个差异表达蛋白)、生物过程调节(255个差异表达蛋白)等,分子功能主要表现为结合(219个差异表达蛋白)、催化活性(191个差异表达蛋白)、结构分子活性(19个差异表达蛋白)等,细胞组分主要为细胞(256个差异表达蛋白)、膜(199个差异表达蛋白)、细胞器(265个差异表达蛋白)等,见图3A。(2)SLE女性组与健康女性组的242种差异表达蛋白,涉及22种生物学过程、14种细胞组分和13种分子功能。其中,生物过程包括细胞过程(232个差异表达蛋白)、免疫系统过程(181个差异表达蛋白)、生物过程调节(228个差异表达蛋白)等,分子功能主要表现为催化活性(169个差异表达蛋白)、结合(186个差异表达蛋白)、转运活性(10个差异表达蛋白)等,细胞组分主要为细胞器(200个差异表达蛋白)、细胞(218个差异表达蛋白)、膜(187个差异表达蛋白)等,见图3B。(3)SLE男性组与健康男性组的214种差异表达蛋白,涉及24种生物学过程、18种细胞组分和11种分子功能。其中,生物过程包括免疫系统过程(110个差异表达蛋白)、刺激反应(169个差异表达蛋白)、细胞过程(199个差异表达蛋白)等,分子功能主要表现为结合(186个差异表达蛋白)、催化活性(108个差异表达蛋白)、结构分子活性(27个差异表达蛋白)等,细胞组分主要为细胞(195个差异表达蛋白)、细胞器(199个差异表达蛋白)、细胞外区域部分(169个差异表达蛋白)等,见图3C。SLE男性/健康男性之间的差异表达蛋白与SLE女性/健康女性之间的差异表达蛋白,在生物过程中涉及30个相同的免疫功能,包括补体活化经典途径、B细胞免疫、免疫球蛋白介导的体液免疫应答、适应性免疫反应、淋巴细胞免疫等。此外,SLE男性/健康男性、SLE女性/健康女性相同的差异表达蛋白共26个,均参与免疫系统过程。
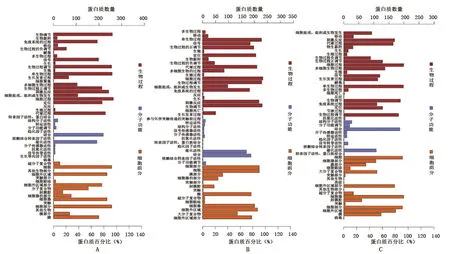
图3 差异蛋白GO注释
2.3.3 KEGG通路分析:SLE女性组/SLE男性组的差异表达蛋白共涉及22条通路,包括类风湿关节炎、原发性免疫缺陷及生产IgA的肠道免疫网络等;SLE女性组/健康女性组的差异表达蛋白共涉及23条通路,包括类风湿关节炎、FcεRI信号通路及麻疹等;SLE男性组/健康男性组的差异表达蛋白共涉及7条通路,包括心肌收缩、钙离子信号通路及过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)信号通路等。见图4。
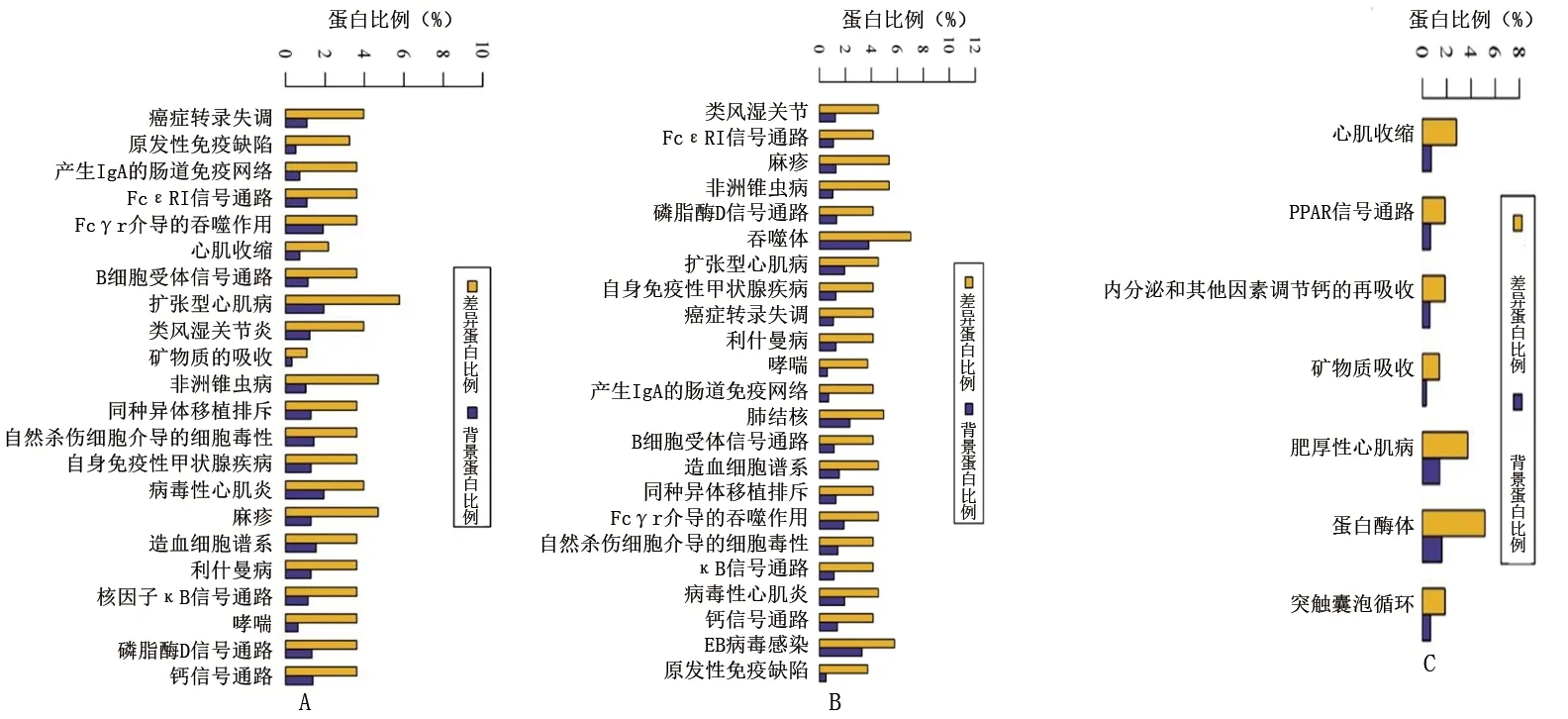
图4 KEGG通路分析
3 讨 论
SLE是一种典型的自身免疫性疾病,由于女性机体的免疫反应强于男性,因此女性对自身免疫性疾病的易感性高于男性[10]。女性的SLE发病率明显高于男性,然而男性受疾病的影响更为严重,发生终末期肾病的风险更高[5,8]。多种因素被用于解释这种性别引起的疾病差异,包括性染色体上基因的差异、免疫系统内在的性别差异、性激素水平的差异、基因调控的性别差异、性别依赖的环境因素、雌激素受体α和β蛋白的表达、泌乳素水平及肠道微生物等[11-18]。根据性别进行分组研究,可能有助于探寻判断不同性别SLE潜在的分子标记及干预靶点。
蛋白质组指在特定的时间和空间内,一种生物或者一个细胞所表达的全部蛋白质[19]。iTRAQ技术作为一种新的蛋白质定量技术,克服了传统双向凝胶电泳不能检测具有极端等电点、分子量太大或太小、低丰度蛋白质及膜蛋白质的弊端[20-21],其通过高通量筛选,可以同时筛查疾病中几乎全部蛋白质的改变,从而发现在致病过程中的关键蛋白质分子。因此,本研究利用iTRAQ技术分析男性和女性SLE患者血浆标本中差异蛋白的表达谱。本研究结果显示,SLE女性/SLE男性之间的差异表达蛋白中,共有193个蛋白涉及免疫系统过程,而这些蛋白作为细胞内、细胞膜及胞外的组成成分,可能通过发挥蛋白质结合、分子功能调节、转录因子活化等功能来参与免疫过程。此外,SLE女性/SLE男性之间的差异表达蛋白、SLE女性/健康女性之间的差异表达蛋白同时涉及的信号通路包括类风湿关节炎、扩张性心肌病、自身免疫性甲状腺疾病、病毒性心肌炎和哮喘等,这是否提示女性SLE患者更容易出现关节、心肌、甲状腺及呼吸道等问题,还需要结合临床进一步验证。
SLE男性/健康男性之间的差异表达蛋白与SLE女性/健康女性之间的差异表达蛋白的差异很大,在生物过程、细胞组分、分子功能、信号通路方面均有很大不同,但在生物过程中涉及30个相同的免疫功能,包括补体活化经典途径、B细胞免疫、免疫球蛋白介导的体液免疫应答、适应性免疫反应、淋巴细胞免疫等。此外,SLE男性/健康男性、SLE女性/健康女性相同的差异表达蛋白共26个,均参与免疫系统过程,提示它们可能是男女性SLE患者免疫学过程发生和发展的共性蛋白,而其余的蛋白则可能存在着病因学特异性。与健康女性相比,SLE女性患者差异表达上调的蛋白包括免疫球蛋白G、免疫球蛋白λ链、免疫球蛋白κ链、类风湿因子等;与健康男性相比,男性患者差异表达上调的蛋白则包括肌球蛋白、肌红蛋白、肌钙蛋白等。由此可见,相较于SLE男性/健康男性,SLE女性/健康女性之间的免疫球蛋白G、免疫球蛋白λ链、免疫球蛋白κ链显著增加,这提示女性SLE患者机体的体液免疫反应更为亢进;而相较于SLE女性/健康女性,SLE男性/健康男性之间的肌球蛋白、肌红蛋白显著增加,这提示男性SLE患者更容易出现肌损伤。然而,本研究筛选的很多差异表达蛋白,尚未见相关研究报告这些蛋白与SLE的相关性,需要采用酶联免疫吸附法、放射免疫法或蛋白免疫印迹试验等方法进一步实验以验证。
综上所述,基于iTRAQ技术的蛋白质组学分析发现,男女性SLE患者之间存在较多差异表达蛋白,这些蛋白质涉及包括免疫过程在内的众多生物学过程及分子功能。但这些血浆差异表达蛋白是否能够成为区别男女性SLE患者的特异性标志物和治疗靶点,还需继续扩大样本量并结合其他方法进行后续研究。
