微小RNA-215调控TLR4/NF-κB信号通路在急性呼吸窘迫综合征炎症反应中的作用▲
2021-12-08王丽姝莫玉珍赖旭东
王丽姝 莫玉珍 王 锋 赖旭东
(广东省广州市红十字会医院1 感染科,2 放疗科,广州市 510220,电子邮箱:wanglishuabcd@126.com;3 中山大学附属第八医院心血管内科,广东省深圳市 518033)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由各种原因导致肺泡上皮细胞及肺毛细血管内皮细胞损伤而出现的以呼吸窘迫及顽固性低氧血症为临床表现的综合征[1-2]。研究表明,ARDS的发病机制与机体内炎症与抗炎反应失衡导致肺泡-血管内皮屏障破坏,从而引起肺泡充血、表面活性物质合成障碍,局部呈现高凝状态等有关[3-4]。因抑制失控的炎症反应对ARDS的治疗具有关键作用,因而各种促炎信号通路细胞因子网络成为ARDS治疗的研究热点[5]。Toll样受体4(toll-like receptor 4,TLR4)/核因子κB(nuclear factor κB,NF-κB)信号通路是常见的促炎信号通路之一,其中TLR4与革兰阴性杆菌外壁层的脂多糖结合后,通过激活下游多条信号通路激活NF-κB,NF-κB上调肿瘤坏死因子(tumor necrosis factor α, TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-18等各种促炎因子的表达,从而促进炎症反应的发生[6-7]。微小RNA(microRNA,miRNA)是一种内源性非编码RNA,与mRNA的3′非编码区特异性结合,诱导mRNA降解或抑制其翻译,在转录后水平调控基因的表达[8]。多种miRNA在急性肺损伤中存在异常表达,并且可能与ARDS的炎症反应有关[9]。但miRNA在ARDS中的具体作用及其作用机制目前尚无定论。因此,本研究探讨miRNA-21通过调控TLR4/NF-κB信号通路对ARDS炎症反应的作用,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:48只C57BL/6J小鼠,雄性,6~8周龄,体重50~100 g,购自广东省医学实验动物中心[动物许可证号SCXK(粤)2016-0003]。在室温、湿度为55%~60%的条件下常规饲养小鼠,适应性喂养1周后进行实验。
1.1.2 实验细胞:A549细胞由珠江医院实验室提供。
1.1.3 实验试剂:脂多糖、杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)购自北京索莱宝科技有限公司(批号:L8880,XG-S63632);水合氯醛购自上海酶联生物科技有限公司(批号:165252-70-0);氯仿购自南京润升石化有限公司(批号:MFCD00000827);异丙醇购自上海宽任化工有限公司(批号:67-63-0);TRIzol RNA分离试剂、磷酸盐缓冲液所有原材料、胰蛋白酶、Lipofectamine 3000试剂、2.5%胰酶、细胞裂解液均购自赛默飞世尔科技(中国)有限公司(批号:BH-S63734,XG-S63608,GDG-2016,L3000015,R001100,BC-WB-018-100mL),其中,按说明书进行磷酸缓冲盐溶液配置后,高压蒸汽灭菌,置于4℃环境下保存;DEPC水、胎牛血清、细胞冻存液(二甲基亚砜与胎牛血清的体积比为1 ∶9)购自南京森贝伽生物科技有限公司;高效RIPA裂解液原材料购自北京索莱宝科技有限公司,按说明书进行配置备用;miRNA反转录试剂盒、(Hifair®Ⅲ 1st Strand cDNA Synthesis Kit(gDNA digester plus)、定量PCR试剂盒(Hifair®Ⅲ One Step RT-qPCR Probe Kit)均购自翌圣生物科技(上海)股份有限公司;鼠TNF-α酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、鼠IL-1β ELISA试剂盒、鼠IL-6 ELISA试剂盒、鼠IL-18 ELISA试剂盒均购自青旗生物技术发展有限公司;蛋白免疫印迹试验所需的各种试剂[蛋白Marker、阳性对照裂解液、电泳缓冲液、蛋白染脱色试剂盒、转膜浓缩试剂盒、蛋白免疫印迹试剂盒、抗体、聚偏二氟乙烯膜、苯甲基磺酰氟、ECL plus发光试剂盒、脱脂奶粉、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)上样缓冲液、二喹啉甲酸蛋白浓度测定试剂盒等]购自金斯瑞生物科技有限公司;中性树脂购自哈灵生物科技有限公司;miRNA-215 mimics和miRNA-215 inhibitor购自吉满生物科技有限公司。通过microRNA Database(http://microrna.sanger.ac.uk/sequences/search.shtmL)进行PCR的引物设计。
1.1.4 主要设备:低温冰箱购自安徽中科都菱商用电器股份有限公司;高压蒸汽灭菌锅购自青岛环保聚创环保集团有限公司;FrontierTM小型多功能台式离心机购自奥豪斯国际贸易(上海)有限公司;电子肛门体温计购自广州市倍尔康医疗器械有限公司;超纯水机(HHitech和泰系列)购自上海和泰仪器有限公司;1.5 mL EP管、2 mL EP管、10 mL EP管、10 μL移液枪吸头、200 μL移液枪吸头、1 000 μL移液枪吸头、移液器、Varioskan LUX 多功能酶标仪、HeraguardTMECO 超净工作台、Countess 3自动细胞计数仪均购自赛默飞世尔科技(中国)有限公司; VORTEX05型涡旋混匀器购自上海达姆实业有限公司;UV7型紫外可见分光光度计购自梅特勒-托利多国际有限公司;乐普全自动医用PCR分析系统 Lepgen-96购自购自南京贝登医疗股份有限公司;蛋白免疫印迹试验所需的仪器(微量加样器、电泳系统、凝胶成像仪等)购自金斯瑞生物科技有限公司;CellXpert® C170i细胞培养箱购自Eppendorf公司;BHC-1300IIB2生物安全柜购自苏洁医疗器械(苏州)有限公司。
1.2 动物实验
1.2.1 动物模型的建立和实验分组:采用随机数字表法将48只小鼠分为脂多糖组和对照组,每组24只。动物模型建立前一天晚上开始禁食,但仍可自由饮水。脂多糖组小鼠按5 mg/kg的剂量腹腔注射1 mg/mL的脂多糖溶液,对照组腹腔注射5 mg/kg的生理盐水。注射后观察两组小鼠的一般状况及生命体征的变化。24 h后使用10%的水合氯醛(5 mg/kg)麻醉两组小鼠,麻醉完成后使用皮肤剪剪开小鼠胸部的皮肤,使用组织剪剪断部分肋骨,打开胸腔充分暴露肺部,将周围结缔组织清理干净后结扎右主支气管,取出右侧肺叶组织,立即将肺下叶置于-196℃的液氮中浸泡20 min,然后保存于-80℃冰箱中,用于相关指标的检测。
1.2.2 肺组织炎症因子的检测:将100 mg上述肺组织剪碎,加入1 mL RIPA蛋白裂解液,低温电动匀浆机匀浆,0℃充分裂解30 min,于4℃、12 000 r/min条件下离心20 min,取上清液置于1.5 mL EP管中,-80℃下保存。然后按照ELISA试剂盒标准操作步骤,检测小鼠肺组织中的TNF-α、IL-1β、IL-6、IL-18水平。
1.2.3 肺组织miRNA-215相对表达水平的检测:(1)RNA的提取。取出肺组织100 mg,于1 mL TRIzol RNA分离试剂中剪碎,低温电动匀浆机匀浆后静置5 min。加入0.2 mL氯仿,剧烈震荡1 min后静置5 min,于4℃、12 000 r/min条件下离心15 min,取上层无色水相于新的离心管并加入0.5 mL异丙醇混匀,置于-70℃环境中沉淀过夜,4℃、12 000 r/min条件下离心10 min,使用1 mL 75%乙醇洗涤RNA沉淀,震荡后4℃、12 000 r/min条件下离心5 min,弃上清,再重复以上操作一次,室温自然风干沉淀结晶后加入DEPC水充分溶解,置于-80℃冰箱中冷藏备用。(2)RNA纯度和浓度检测。使用紫外可见分光光度计UV7对所得到的RNA样品进行纯度和浓度检测,以DEPC水为空白对照,当吸光度(A)260/A280值在1.8~2.0范围内时判定为纯度和浓度合适,可以进行下一步PCR检测。(3)反转录。反转录的上游引物序列为5′-GAGGAAAGTGGCGGGGAG-3′,下游引物序列为 5′-CCAACCAGAGCTGAGTCCAAGTA-3′。配置反转录反应体系,包括反转录buffer 2 μL、上游引物0.2 μL、下游引物0.2 μL、dNTP 0.1 μL、逆转录酶MMLV 0.5 μL、DEPC水5 μL、RNA模板2 μL。在37℃ 60 min、85℃ 5 min、4℃持续的条件下进行反转录得到cDNA,用DEPC水稀释5倍后于-20℃保存。(4)实时荧光定量PCR检测。miRNA-215的上游引物序列为5′-TGCGGCAACACCAGTCGATGG-3′ ,下游引物序列为5′-CCAGTGCAGGGTCCGAGG T-3′;内参U6上游引物序列为5′-GGCTACAGCAACAGGGTG-3′,下游序列为5′-TTTGGTTGAGCACAGGGT-3′。配制miRNA扩增反应体系,包括SYBR GREEN染料10 μL、上游引物1 μL、下游引物1 μL、dNTP 1 μL、Taq聚合酶 2 μL、待测样品cDNA 5 μL、ddH2O 30 μL。将配制好的反应体系置于PCR分析系统 Lepgen-96中,在95℃预变性10 min、95℃变性10 s、60℃退火20 s、72℃延伸34 s循环40次的条件下进行PCR扩增反应。使用乐普全自动医用PCR分析系统 Lepgen-96配置的计算机软件获取实时荧光定量PCR结果。
1.2.4 肺组织TLR4、NF-κB蛋白相对表达水平的检测:(1)蛋白质的提取。方法同1.2.2。(2)蛋白质浓度的测定。使用二喹啉甲酸法,按照说明书操作步骤检测蛋白质的浓度。(3)电泳。按照说明书配制SDS-PAGE凝胶,在蛋白质样品中加入适量浓缩SDS-PAGE蛋白上样缓冲液,100℃水浴加热3~5 min使蛋白质变性充分,冷却至室温后上样,100 V电压恒压电泳100~120 min,条带跑至离边缘0.5~1 cm为止。(4)转膜。将聚偏二氟乙烯膜在甲醇中浸泡5 min激活后,将聚偏氟乙烯膜、海绵垫、滤纸、电泳胶按照顺序制备成转膜夹(注意不要产生气泡,膜和胶要对齐),电转液稀释10倍后,70 V恒压电转2 h。(4)封闭。将蛋白膜于Western洗涤液中漂洗1~2 min后加入Western封闭液室温封闭2 h。(5)一抗孵育。吸尽封闭液加入一抗(稀释比例为1 ∶1 000),4℃下于摇床上缓慢摇动孵育过夜后,回收一抗,使用Western Blot洗涤液在摇床上缓慢摇动洗涤5~10 min,洗涤3次。(6)二抗孵育。吸尽洗涤液加入二抗(稀释比例为1 ∶1 000),4℃于摇床上缓慢摇动孵育过夜后,回收二抗,使用Western Blot洗涤液在摇床上缓慢摇动洗涤5~10 min,共洗涤3次。(7)蛋白检测。配制ECL 工作液A液及B液各1 mL,按照说明书使用凝胶成像仪成像后,以甘油醛-3-磷酸脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,分析并计算各个条带灰度值。
1.3 细胞实验
1.3.1 细胞培养和分组:使用含10%胎牛血清、100 U青霉素的DMEM培养基于37℃、饱和湿度、5%CO2的培养箱中培养A549细胞,待细胞生长至融合度为85%时,使用磷酸缓冲盐溶液清洗,0.25%胰酶消化细胞后离心(1 000 r/min)5 min;将细胞沉淀加入新鲜的完全培养基并按照1 ∶3的比例进行传代,于37℃培养箱中培养至细胞融合度为85%时,使用磷酸缓冲盐溶液清洗,0.25%胰酶消化细胞后离心(1 000 r/min)5 min,将细胞沉淀加入冻存液以重悬细胞,按40℃ 30 min、-20℃ 30 min、-80℃ 12 h进行梯度降温,最后于液氮中长期保存。实验共分为4组进行,包括miRNA-215组、miRNA-215抑制组、阴性对照组、空白对照组。需要使用细胞时对细胞进行复苏,即取出冻存细胞,37℃水浴复苏,解冻后3 000 r/min离心5 min,使用磷酸缓冲盐溶液漂洗细胞沉淀3遍后接种于完全培养基,置于37℃培养箱中培养过夜。
1.3.2 脂多糖刺激A549细胞建立模型:miRNA-215组、miRNA-215抑制组、阴性对照组细胞复苏后,使用胰酶消化,然后接种到6孔板上(1×106个细胞/孔),于37℃培养箱中培养过夜,次日待细胞融合度约为80%时加入100 ng 脂多糖(使用脂多糖时用无菌磷酸缓冲盐溶液稀释10倍)刺激4 h后,使用胰酶消化,收集细胞。
1.3.3 细胞转染:取经脂多糖刺激的A549细胞置于37℃培养箱中培养,至细胞融合度为50%时进行细胞转染,miRNA-215组、miRNA-215抑制组分别转染miRNA-215 mimics、miRNA-215 inhibitor,阴性对照组和空白对照组仅加入标准转染液(Lipofectamine 3000试剂)。转染操作如下:将细胞置于不含血清的2 mL DMEM培养液中,其中miRNA-215组和miRNA抑制组分别在不含血清的DMEM培养基中分别加入2 μg的miRNA-215 mimics、miRNA-215 inhibitor,并加入4 μL的Lipofectamine 3000试剂,其他两组加入4 μL的Lipofectamine 3000试剂;混匀后室温放置20 min,放入37℃培养箱中培养,4 h后再将培养基换成含10%胎牛血清的DMEM培养基继续培养48 h。
1.3.4 miRNA-215相对表达水平的检测:细胞转染完成后,使用0.25%的胰酶消化,经磷酸缓冲盐溶液洗涤3次后将细胞接种于6孔板中(1×106个细胞/孔),每孔加入1 mL TRIzol试剂,冰上放置5 min后加入0.2 mL氯仿剧烈震荡15 s,30℃孵育5 min,4℃、12 000 r/min下离心15 min,取上层无色水样移入新的EP管中,加入0.5 mL异丙醇混匀,室温孵育30 min,4℃、12 000 r/min下离心10 min,留沉淀加入1 mL 75%乙醇,漩涡震荡30 s,4℃、7 500 r/min下离心5 min,留沉淀于超净台中鼓风干燥5 min,加入RNA溶解液,60℃水浴10 min后,用1%琼胶电泳鉴定RNA样品浓度和纯度,浓度纯度合适者于-80℃储存备用。(2)反转录和实时荧光定量PCR检测步骤同1.2.3。实验重复5次。
1.3.5 炎症因子水平的检测:取完成转染后的细胞,使用胰酶消化后,4℃、2 000 r/min下离心5 min,磷酸缓冲盐溶液清洗细胞沉淀3次,4℃、2 000 r/min下离心5 min,加入80 μL细胞裂解液冰浴30 min进行裂解,之后0℃、10 000 r/min下离心10 min,采用二喹啉甲酸法测定蛋白浓度并检测纯度后于-80℃保存备用。将提取所得的细胞蛋白质,按照ELISA试剂盒标准操作步骤检测细胞模型的TNF-α、IL-1β、IL-6、IL-18的水平。实验重复5次。
1.3.6 TLR4和NF-κB蛋白相对表达水平的检测:取完成转染后的细胞,按照1.3.5的方法提取蛋白质后,采用蛋白免疫印迹法检测TLR4和NF-κB蛋白的表达水平,具体步骤见1.2.4。实验重复5次。
1.4 统计学分析 应用SPSS 20.0 软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用独立样本t检验或t′检验,多组均数间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组小鼠的基本情况 对照组小鼠的一般状况良好,饮食饮水、呼吸、活动、精神状态均正常。而脂多糖组小鼠在腹腔注射3 h后呼吸频率加快,饮食饮水减少,活动减少;随着时间延长,小鼠症状逐渐加重,出现呼吸窘迫、发绀,精神状态不佳,不再饮食饮水。以上结果提示脂多糖组小鼠出现ARDS症状,造模成功。
2.2 两组小鼠肺组织炎症因子表达水平的比较 脂多糖组小鼠肺组织TNF-α、IL-1β、IL-6、IL-18的表达水平均高于对照组(均P<0.05),见表1。

表1 两组小鼠肺组织炎症因子表达水平的比较(x±s,pg/mg)
2.3 两组小鼠肺组织miRNA-215相对表达水平的比较 脂多糖组小鼠miRNA-215的相对表达水平为146.78±18.56,低于对照组的216.43±12.43(t=15.275,P<0.001)。
2.4 两组小鼠肺组织TLR4、NF-κB蛋白相对表达水平的比较 脂多糖组小鼠的TLR4、NF-κB蛋白相对表达水平均高于对照组(均P<0.05),见表2和图1。
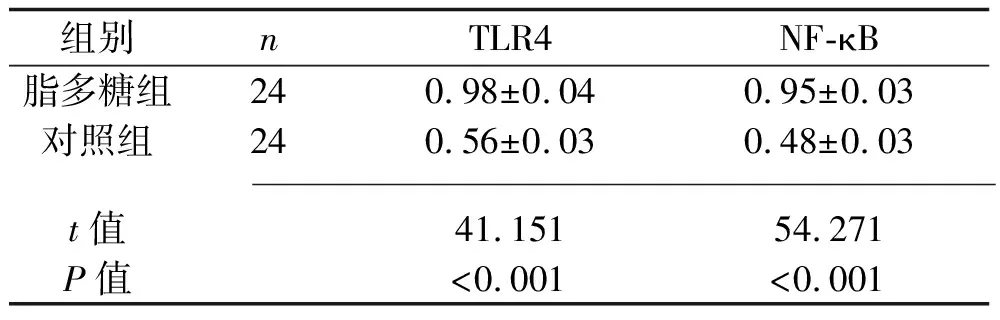
表2 两组小鼠肺组织TLR4、NF-κB蛋白相对表达水平的比较(x±s)
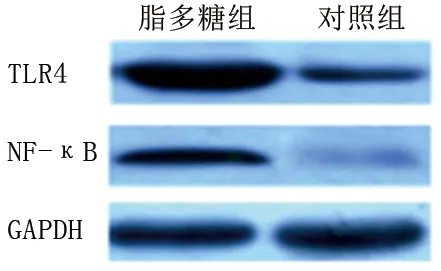
图1 两组小鼠肺组织TLR4、NF-κB的蛋白表达情况
2.5 各组细胞miRNA-215相对表达水平的比较 miRNA-215组、miRNA-215抑制组、阴性对照组、空白对照组的miRNA-215相对表达水平依次为265.87±21.32、31.03±7.23、143.54±13.45、187.55±15.85,差异有统计学意义(F=204.739,P<0.001)。其中,阴性对照组的miRNA-215相对表达水平低于空白对照组(P<0.05);此外miRNA-215组、阴性对照组、miRNA-215抑制组的miRNA-215相对表达水依次降低(均P<0.05),表明转染成功,细胞实验数据具有参考意义。
2.6 各组细胞炎症因子水平的比较 阴性对照组的炎症因子TNF-α、IL-1β、IL-6、IL-18的表达水平均高于空白对照组(均P<0.05),表明模拟ARDS细胞模型成功;miRNA-215组、阴性对照组、miRNA-215抑制组的TNF-α、IL-1β、IL-6、IL-18水平依次升高(均P<0.05)。见表3。

表3 4组细胞炎症因子水平的比较(x±s,pg/mg)
2.7 各组细胞TLR4和NF-κB蛋白相对表达水平的比较 miRNA-215组、空白对照组、阴性对照组、miRNA-215抑制组细胞的TLR4和NF-κB蛋白相对表达水平依次升高(均P<0.05)。见表4、图2。
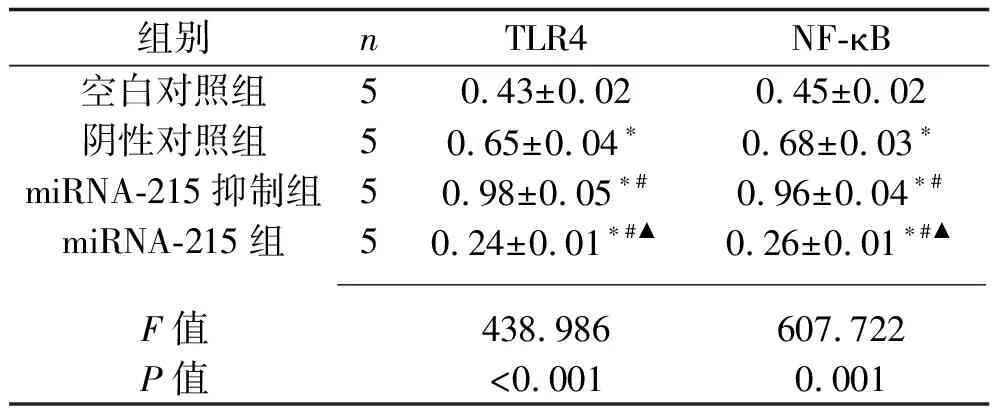
表4 4组细胞TLR4和NF-κB蛋白相对表达水平的比较(x±s)

图2 4组细胞中TLR4和NF-κB的蛋白表达情况
3 讨 论
ARDS是各种病因导致肺泡上皮细胞、肺毛细血管内皮细胞受损而出现的急性肺损伤[10-11]。ARDS的临床治疗主要采取治疗原发病、控制感染性炎症、呼吸支持、防治并发症等综合措施[12-13],但是效果有限,因此合理有效的治疗方案成为研究的热点。ARDS的发生可能是因为体内促炎和抗炎机制出现失衡[4],短时间内大量炎性因子释放,造成肺泡上皮、毛细血管内皮的炎性损伤[14],肺泡内物质渗出形成透明膜造成肺组织呼吸功能受限[15]。因此,目前级联式炎症反应机制也成为了ARDS的发病机制和治疗靶点的研究方向[16]。miRNA作为真核生物中常见的非编码小分子RNA,能够与靶基因的3′非编码区特异性结合,在转录后水平调节基因的表达[17]。miRNA在真核生物的多种信号通路基因表达的调控中发挥作用[18],并且miRNA的这种调控不会影响到mRNA的稳定性,是非常理想的治疗靶点[19]。有研究表明,miRNA可能参与肺部炎症反应的调节,例如孟建斌等[20]发现急性肺损伤小鼠血浆中的miRNA-146a呈高表达;徐媛等[21]发现腹腔注射脂多糖构建的急性肺损伤小鼠模型中存在miRNA-181b的异常表达,miRNA-181b可能参与炎症反应的负性调控等。miRNA-215可能参与多种炎症反应信号通路,但是目前关于miRNA-215是否与ARDS的发病机制有关,以及miRNA-215在ARDS的炎症反应中的具体作用及其机制的研究均较少。
本研究通过动物实验和细胞实验,探讨miRNA-215对ARDS炎症反应的具体作用及其作用机制是否与TLR4/NF-κB信号通路相关。本研究中,腹腔注射脂多糖后,小鼠呼吸频率加快、饮食饮水减少、活动减少,且肺组织TNF-α、IL-1β、IL-6、IL-18水平升高,表明腹腔注射脂多糖后小鼠出现ARDS症状以及肺部的炎症反应,成功建立ARDS模型。肺泡Ⅱ型上皮细胞凋亡是ARDS的重要病理生理过程,以肺泡Ⅱ型上皮细胞构建ARDS细胞模型具有较好的价值。A549细胞为人肺腺癌细胞,属于传代细胞系,可稳定地进行传代和培养。且A549细胞系具有理想的肺泡Ⅱ型上皮细胞的结构和生化特征,已经成为公认的用于构建肺泡Ⅱ型上皮细胞模型的理想的细胞。因此,本研究利用脂多糖刺激A549细胞构建ARDS细胞模型。结果显示,阴性对照组的炎症因子TNF-α、IL-1β、IL-6、IL-18水平均高于空白对照组(均P<0.05),即脂多糖刺激后A549细胞出现了明显的炎性因子过度释放,符合ARDS的发生机制,这表明本研究成功模拟了ARDS细胞模型。动物实验中脂多糖组小鼠的miRNA-215的相对表达水平低于对照组,而细胞实验中阴性对照组的miRNA-215的相对表达水平也低于空白对照组,即无论是ARDS动物模型还是ARDS细胞模型都出现了miRNA-215表达的下调。这表明ARDS发生时存在miRNA-215表达下调。
我们进一步将miRNA-215 mimics、miRNA-215 inhibitor转染至ARDS模型细胞,以探讨miRNA-215 在ARDS发生机制中的作用。结果显示miRNA-215组、阴性对照组、miRNA-215抑制组的miRNA-215相对表达水依次降低(均P<0.05),表明转染成功,细胞实验数据具有参考意义。与阴性对照组相比,miRNA-215抑制组的炎性因子TNF-α、IL-1β、IL-6、IL-18水平升高,而miRNA-215组上述炎症因子水平降低(均P<0.05),这表明miRNA-215表达下调可能与ARDS的炎症反应有关,而上调miRNA-215表达具有减轻ARDS炎症的作用。
动物实验中,脂多糖组肺组织的TLR4、NF-κB蛋白表达水平高于对照组(均P<0.05),这提示ARDS的发生机制可能与TLR4/NF-κB通路有关。细胞实验中,miRNA-215组、阴性对照组、miRNA-215抑制组的TLR4和NF-κB蛋白相对表达水平依次升高(均P<0.05),这表明miRNA-215可以调节ARDS细胞模型的TLR4/NF-κB信号通路,即下调miRNA-215的表达可使得ARDS细胞模型的TLR4、NF-κB表达增高,而上调miRNA-215表达则会抑制TLR4、NF-κB的表达。由此推测miRNA-215可以通过调控TLR4/NF-κB信号通路来调节各种炎症因子的表达,从而参与ARDS的发生。
综上所述,miRNA-215表达下调可能与ARDS的发病有关,其可能通过调控TLR4/NF-κB信号通路以调节各种炎症因子的表达。而上调miRNA-215的表达或可通过负调控TLR4/NF-κB信号通路来减轻ARDS的炎症反应,miRNA-215可以作为辅助治疗ARDS的靶点之一。由于本研究样本量有限,并且没有针对miRNA-215表达水平的改变与各种炎症因子、TLR4、NF-κB水平的变化进行相关性分析,今后仍需深入研究以证实miRNA-215在ARDS中的作用及其作用机制。
