涪陵青菜头泡菜发酵过程中的细菌多样性分析
2021-11-18任亭刘玉凌彭玉梅曾胜贺云川栾兴霞罗远莉
任亭,刘玉凌,彭玉梅,曾胜,贺云川,栾兴霞,罗远莉*
(1.重庆市渝东南农业科学院,重庆 408000;2.重庆市涪陵榨菜集团股份有限公司,重庆 408000)
我国泡菜历史悠久,属四川泡菜最为有名,已成为西南地区餐桌上常见的配菜。由于泡菜在泡制过程中蔬菜原料一直处于常温下,且以乳酸菌发酵为主,在较好保存蔬菜原料维生素、矿物质等营养物质的同时也拥有大量益生菌,使其具有抑制肠道致病菌、抑菌、抗癌等多种功效[1-2]。泡菜从发酵开始到成熟是一个极为复杂的微生物发酵系统,其菌落结构与发酵条件、发酵底物、制作工艺均有着较大联系。有研究报道,泡菜食盐浓度对乳酸菌多样性有一定影响,低盐浓度泡菜中乳酸菌多样性高于高盐泡菜[3]。朱琳等[4]发现萝卜泡菜发酵过程中细菌群落结构多样性伴随着亚硝酸盐浓度变化也发生演替。康建依等[5]研究表明山西地方自然发酵蔬菜在发酵前期细菌多样性丰富,发酵中后期,细菌多样性降低,其主要菌属为乳杆菌属(Lactobacillus)。
青菜头是重庆市涪陵区特产蔬菜,当地农户喜好用其制作泡菜。青菜头泡菜具有脆嫩爽口、风味鲜美、营养丰富等特点。目前,采用高通量测序技术对青菜头泡菜中微生物菌群结构的研究尚未见报道。本研究以青菜头为泡菜原料,当地陈年泡菜水为母水制作泡菜,分析研究其发酵过程中泡菜品质、微生物菌落的动态变化,在明确青菜头泡菜品质特性的同时更全面地了解青菜头泡菜发酵过程中的微生物多样性,为青菜头泡菜产品的研发与生产提供了理论支撑,同时为泡菜发酵优良菌株的分离鉴定提供了参考。
1 材料与方法
1.1 材料
泡菜原料:鲜青菜头、食盐、大蒜、鲜姜、辣椒、花椒,购于重庆涪陵某菜市场。
陈年泡菜母水:重庆市涪陵区二度村某农户。
1.2 青菜头泡菜的制备
青菜头清洗沥干水分后切块,按青菜头∶泡菜母水∶凉开水(盐浓度4%)为2∶1∶4的比例入坛,再添加冰糖、姜、大蒜、辣椒、花椒,于25 ℃密封发酵。在发酵第0,1,3,5,7,9天取泡菜水进行各项指标的检测。
1.3 微生物指标测定方法
参照GB 4789.35-2016《食品微生物学检验 乳酸菌检验》、GB 4789.2-2016《食品微生物学检验 菌落总数测定》。
1.4 理化指标测定方法
1.4.1 pH值、总酸含量的测定
pH值采用pH计测定,总酸参照GB/T 12456-2008《食品中总酸的测定》。
1.4.2 亚硝酸盐含量的测定
参照国标GB 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》。
1.4.3 样品总DNA提取、PCR扩增
采用细菌基因组DNA抽提试剂盒提取样品总DNA,提取步骤根据说明书进行。扩增结束后,PCR 扩增产物使用2%琼脂糖进行凝胶电泳检查扩增效果。
1.4.4 高通量测序分析
将样品的PCR产物送至重庆博爱麦迪逊生物科技公司,在Illumina-HiSeq平台上进行高通量测序分析。
2 结果与分析
2.1 青菜头泡菜发酵过程中微生物指标测定结果
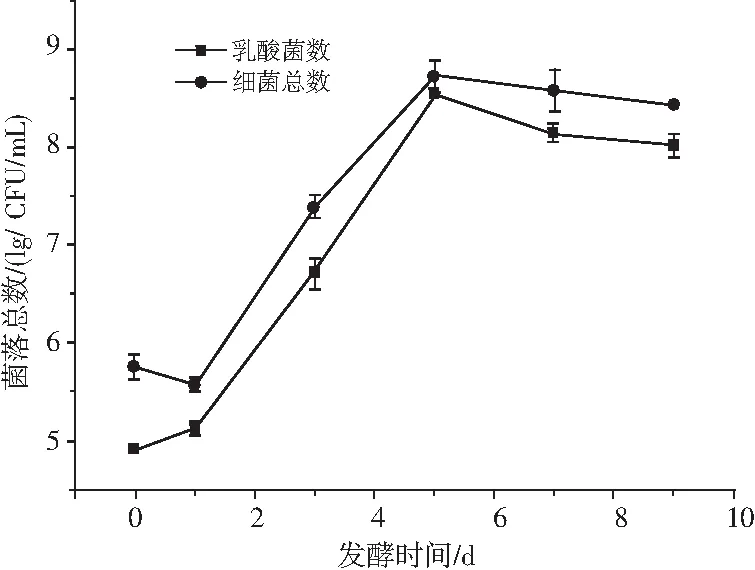
图1 青菜头泡菜发酵过程中乳酸菌数与细菌总数的变化Fig.1 Changes of lactic acid bacteria and total number of bacteria during the fermentation of Brassica juncea pickles
由图1可知,菌落总数在发酵第0天较高,这是由于涪陵青菜头泡菜采用陈年泡菜水为母水引子进行发酵而成,而陈年泡菜水中菌落总数和乳酸菌数较多[6],且青菜头本身带有部分细菌。发酵1~5 d,乳酸菌数、菌落总数增加迅速,并在第5天达到峰值8.53,8.71 lg CFU/mL,此时乳酸菌含量达到97.93%,说明乳酸菌已快速生长繁殖成为青菜头泡菜的优势菌群。也有研究表明添加泡菜老汤水能促进泡菜中的乳酸菌迅速成为优势菌群[7]。发酵5~9 d,乳酸菌数、菌落总数逐渐减少并趋于平稳,在发酵后期乳酸菌产生大量乳酸导致乳酸菌生长受到反馈抑制。
2.2 青菜头泡菜发酵过程中理化指标测定结果
2.2.1 pH值、总酸在青菜头泡菜发酵过程中的变化
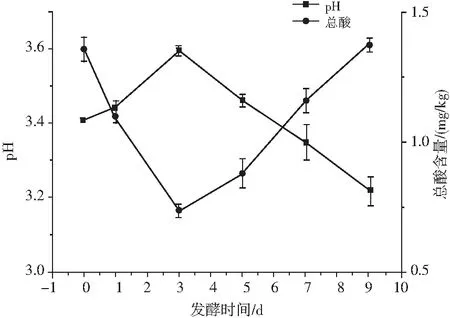
图2 青菜头泡菜发酵过程中pH值、总酸的变化Fig.2 Changes of pH values and total acids during the fermentation of Brassica juncea pickles
泡菜发酵过程中产出的代谢产物对其口感(酸度、甜度、脆度、苦味等)和风味均有重要影响,而pH值和总酸含量直接影响着泡菜微生物的生长和代谢产物的生成。由图2可知,在整个发酵过程中,pH值呈先上升后降低的趋势,相应的总酸含量呈先下降后上升的趋势,在发酵前期(0~3 d),pH值含量明显升高,总酸含量迅速降低,可能是由于青菜头泡菜按青菜头∶泡菜母水∶凉开水为2∶1∶4的比例制作,泡菜母水中有机酸和H+含量较高,导致新制青菜头泡菜乳酸代谢途径因泡菜母水乳酸的积累产生反馈抑制作用,使总酸含量呈现一定的下降趋势[8],发酵中后期(3~9 d),青菜头泡菜的pH值迅速降低,总酸含量迅速上升,此时乳酸菌已大量繁殖成为优势菌群,产酸,与图1乳酸菌数的变化一致。
2.2.2 亚硝酸盐含量在青菜头泡菜发酵过程中的变化
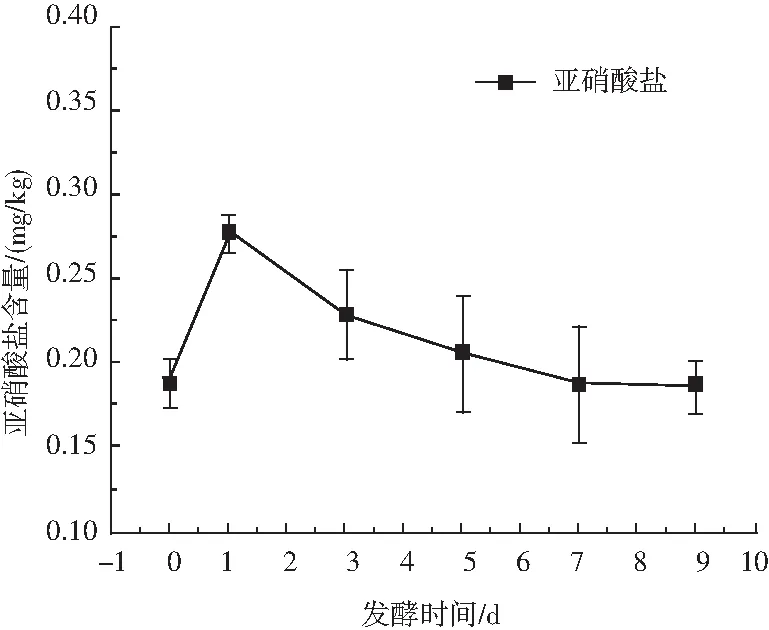
图3 青菜头泡菜发酵过程中亚硝酸盐含量的变化Fig.3 Changes of nitrite during the fermentation of Brassica juncea pickles
青菜头泡菜在整个发酵过程中亚硝酸盐含量整体较低,在0.19~0.27 mg/kg之间。在发酵初期(0~1 d),亚硝酸盐含量迅速增加,在发酵第1天达到峰值,由于青菜头表面携带大量微生物通过硝酸还原酶将硝酸盐还原成亚硝酸盐而形成“亚硝峰”。而随着发酵的进行,在发酵1~9 d,泡菜中乳酸菌数迅速增加,亚硝酸盐含量迅速降低,有研究表明乳酸菌中含有亚硝酸还原酶能分解亚硝酸盐[9],康建依等研究表明乳酸菌数与亚硝酸盐含量呈此消彼长得趋势。
2.2.3 样品细菌稀释曲线
通过对传统青菜头泡菜不同发酵时期(0,1,3,5,7 d)的泡菜盐水进行细菌16S rDNA基因V3~V4区测序,5个样品产生1,106,326条高质量序列(重复5次),统计所有样品优质序列长度平均约为450 bp。由图4可知,随着测序量的增加,细菌稀释曲线(Sobs指数、Shannon指数)接近平台期达到饱和,表明测序数据足以代表整个种群。
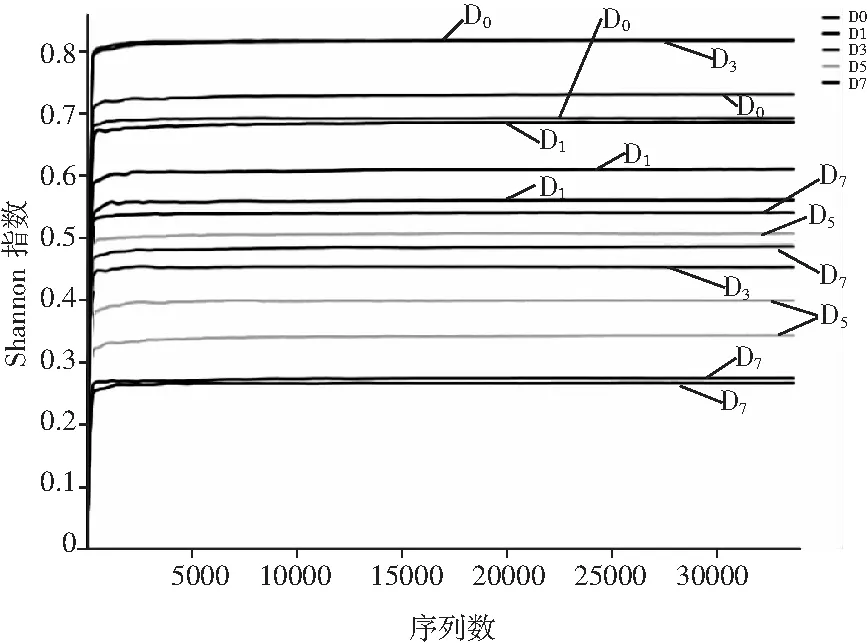
图4 样品的细菌稀释曲线Fig.4 The bacterial dilution curves of samples
2.2.4 样品的信息以及微生物多样性
各样品Alpha多样性指数值统计见表1。
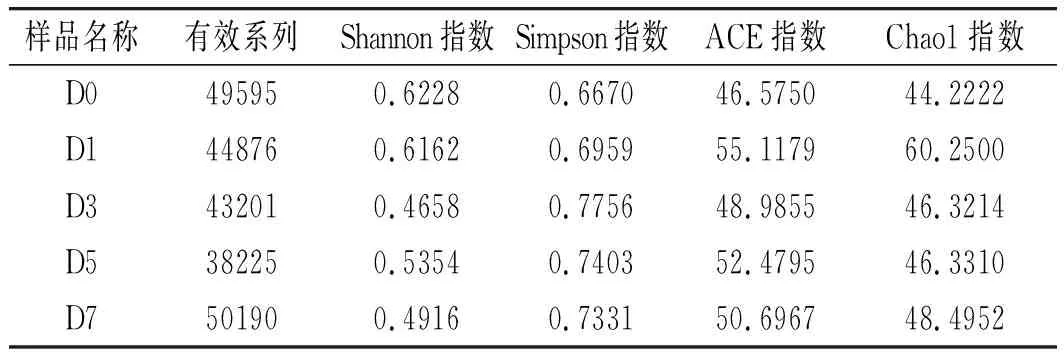
表1 样品的信息以及微生物多样性Table 1 The samples' information and microbial diversity
由表1可知,ACE指数和Chao1指数在发酵第1天时最大,细菌种类数最高,说明陈年泡菜水能快速启动泡菜发酵系统;Shannon指数的变化与Simpson指数的变化呈负相关,Shannon指数随着发酵的进行呈先下降再升高的趋势,在发酵第0天Shannon指数最大,说明物种多样性在发酵初期第0天最大,随着发酵的进行,细菌多样性下降,到发酵后期又有一定上升,这可能是由于第0天加入的新鲜青菜头上附着大量的细菌,而随着发酵的进行,泡菜逐渐成熟,乳酸菌迅速繁殖成为优势菌群,抑制了其他杂菌的成长[10]。
2.2.5 样品细菌菌群结构分析
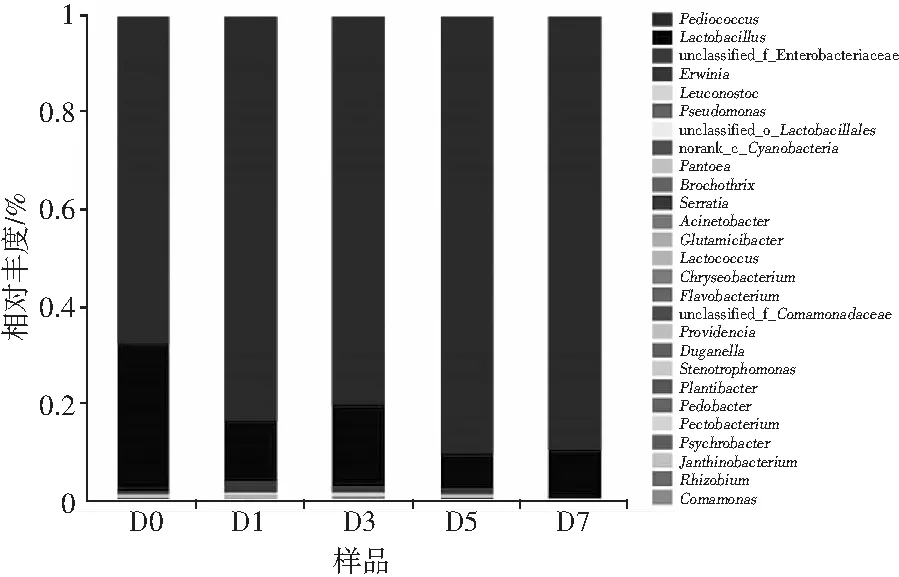
图5 青菜头泡菜发酵过程中属水平菌落结构分析Fig.5 Analysis of bacterial colony structure of Brassica juncea pickles at genus levelin the fermentation process
由图5可知,在属水平上的细菌属主要有片球菌属(Pediococcus)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、明串珠菌属(Leuconostoc)、肠杆菌属(Enterobacter)和欧文氏菌属(Erwinia),其中,片球菌是其优势菌属,李恒等[11]通过对传统泡菜中微生物群落的动态变化研究发现乳杆菌属是泡菜母水中的主要细菌属,于文平等[12]研究表明,消化乳杆菌和植物乳杆菌为青菜泡菜发酵过程中的优势菌群,汪冬冬等[13]通过对二轮盐渍工业泡菜微生物群落结构解析研究表明豇豆、萝卜和榨菜的主要优势细菌为芽孢杆菌属,均与本研究结果不同,可能是由于地域、泡菜原料、辅料及加工工艺等存在差异。通过比较发现,在发酵前期(0~1 d),片球菌属含量从65.13%迅速增加至83.35%,明串珠菌属含量从0.67%增加至0.72%;在发酵中后期(3~7 d),片球菌含量基本不变,明串珠菌含量从0.69%迅速降低至0.03%,由此可推测片球菌与明串珠菌能快速启动发酵,在发酵初期发挥主要作用,黄存辉等[14]也研究表明明串珠菌能快速启动发酵。明串珠菌含量在发酵后期迅速降低,是因为其不耐酸,而泡菜水中总酸在后期含量较高。随着发酵的进行,乳杆菌属含量从30.49%降到8.86%,假单胞菌属含量从0.2%降到0.02%,肠杆菌属含量从1.2%降到0.56%,欧文氏菌属含量从1.47%降到0.58%,然后升高到0.71%,说明乳杆菌属在陈年泡菜母水中含量较高,而其含量随着发酵的进行逐渐降低并趋于稳定,发酵后期泡菜水的酸度增加,抑制了部分微生物的繁殖生长。
2.2.6 样品细菌群落相似性分析
PCA分析见图6,在发酵第3天细菌种类分散度最高,然后依次为第1,5,0,7天。其中,发酵第7天优势菌比例最高并且细菌种类分散度最低,此时总酸含量最高,pH值最低;发酵第3天优势菌比例最低并且细菌种类分散度最高,而此时总酸含量最低,pH值最高。可能是由于总酸含量较低时,一些非优势菌能大量生长,从而降低了优势菌所占的比例,导致细菌种类分散度升高。
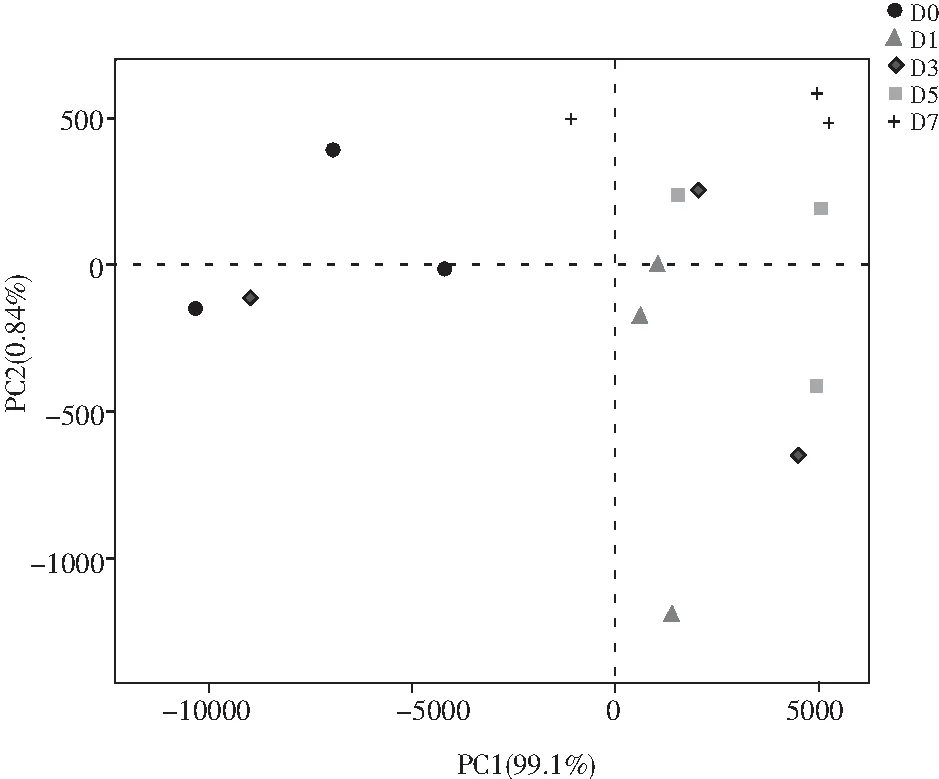
图6 青菜头泡菜发酵过程中细菌菌落相似性分析Fig.6 The similarity analysis of bacterial colony of Brassica juncea pickles in the fermentation process
2.2.7 样品聚类分析

图7 青菜头泡菜发酵过程中聚类热图Fig.7 The cluster heat diagram of Brassica juncea pickles in the fermentation process
由图7可知,对不同发酵时间的5个样品在属分类水平的物种丰度相似性进行聚类分析。通过对颜色梯度及相似程度进行分析,D0与其他样品差距较大,D1和D3基本接近,D5和D7基本接近,说明随着泡菜发酵的成熟,样品之间的微生物差异性减少,物种丰度越来越相似。发酵前期D1中含量较多的假单胞菌(Pseudomonas)、肠杆菌(Enterobacter)和欧文氏菌(Erwinia)均属于变形菌门,有研究表明,变形菌门能促使泡菜水亚硝酸盐的生成[15],与泡菜样品中亚硝酸盐含量在第1天达到峰值的结果相对应。在发酵后期,泡菜样品的微生物多样性相对减少,主要含有乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)均属于厚壁菌门。
3 结论
以陈年泡菜水为母水引子发酵青菜头泡菜,在整个发酵过程中乳酸菌与菌落总数逐渐增加,而微生物多样性与丰度逐渐降低,到发酵末期菌群结构相似性较大。在属水平上,片球菌为优势菌群,随着泡菜发酵时间的推移(0~7 d),片球菌含量从65.13%增加到88.47%,发酵前期存在假单胞菌(Pseudomonadaceae)、肠杆菌(Enterobacteriaceae)和欧文氏菌(Erwinia)等变形菌门菌群。pH值呈先上升后降低的趋势,总酸含量呈先下降后上升的趋势,亚硝酸盐含量整体较低,在0.19~0.27 mg/kg之间。
