组织粉碎器在腹膜后腹腔镜肾癌根治术中的应用研究
2021-11-11瞿根义向茂林王佳威
汤 乘,阳 光,徐 勇,瞿根义,向茂林,王佳威
(中南大学湘雅医学院附属株洲医院泌尿外科,湖南 株洲,412007)
外科手术是局限性肾癌的首选治疗手段,根治性肾切除术是得到认可的可能治愈肾癌的方法。随着腹腔镜技术的发展,腹腔镜下根治性肾切除术已取代大部分开放性根治性肾切除术[1]。腹膜后腹腔镜根治性肾切除术(retroperitoneoscopic radical nephrectomy,RRN)因分离组织少、损伤轻且肠道恢复快,更加符合外科快速康复理念,利于患者术后恢复,但经腹膜后入路易受腹膜后脂肪的影响,游离后不易通过Trocar内完整取出,常规放置于腹膜后髂窝内,但腹膜后腔本身空间狭小,过多的脂肪容易造成术野不清,给术者操作造成较大影响。放置于腹膜后腔中缺少血管供给的游离脂肪增加了腹膜后腔引流量,还可能成为术后感染源,对于患者的术后恢复可能也有一定影响。组织粉碎器可对大块软组织进行吸引切割,普遍应用于普通外科及妇科领域[2-3]。本研究旨在比较在局限性肾癌患者中,应用组织粉碎器清除腹膜后脂肪的RRN与传统RRN的安全性与临床疗效。
1 资料与方法
1.1 临床资料 纳入标准:(1)不适合行肾部分切除术的T1a肾癌或局限性肾癌cT1b/T2N0M0(2017年美国癌症联合委员会分期);(2)对侧肾功能正常,有肾脏全切指征;(3)无其他严重的心脑血管疾病、肝病,严重的营养不良,凝血功能障碍等手术禁忌证;(4)同意行RRN且签订知情同意书。排除标准:(1)因术中情况,中途改为开放手术;(2)孤肾或对侧肾功能差,不能行根治性肾切除术;(3)有严重的心脑血管疾病、肝病、营养不良、凝血功能障碍等手术禁忌证;(4)拒绝手术治疗。根据中国肥胖协作组织所制定的标准[4],将BMI≥28 kg/m2认为病态肥胖,先将能入组患者分为肥胖组(BMI≥28 kg/m2)与非肥胖组(BMI<28 kg/m2)两个亚组,应用随机数字表,将入组患者随机匹配到两种手术方式,实验组术中应用组织粉碎器,对照组行传统RRN。根据纳入标准前瞻性纳入2018年6月至2020年12月行RRN的208例患者,其中肥胖组50例,26例归为实验组,24例归入对照组;非肥胖组共纳入158例,78例分入实验组,80例分入对照组。
1.2 手术方法 实验组应用组织粉碎器行改进RRN:采用气管插管全身静脉复合麻醉,深静脉穿刺置管,留置导尿,患者取健侧卧位,抬高腰桥,腰部垫高,腋窝放置腋窝垫防止术中身体倾斜,用宽胶带将患者髋部固定于手术台上,并将四肢摆放为功能体位。应用Hasson技术建立腹膜后腔:先于腋中线髂嵴上2 cm做约2 cm的切口,切开皮肤及皮下组织,用血管钳钝性分离各肌层及腰背筋膜,示指在腹横肌深面分离腹膜后腔并将腹膜向腹侧推开,置入制作好的腹膜后腔扩张器充气600 mL扩张后腹膜腔3~5 min,穿刺10 mm Trocar,并在腹腔镜直视下分别于腋后线肋缘下、腋前线肋下缘穿刺Trocar,右手方位穿刺10 mm Trocar,另一穿刺点为5 mm Trocar,置入套管后缝合,以防止漏气,Trocar连接气腹机建立气腹,压力维持在15 mmHg。分离钳、超声刀分离扩大腹膜后间隙,并将腹膜后脂肪剥离(图1),通过10 mm Trocar置入组织粉碎器,由于腹膜后腔空间很小,相关文献已表明,快速旋转的刀片容易导致与粉碎器相关的血管、内脏器官受损[5-6],粉碎并吸出腹膜后脂肪必须在腹腔镜密切监视粉碎器末端安全运作的情况下进行(图2),整理Trocar周围组织,可见腹膜后空间操作较前明显增大(图3)。在腹膜后返折背侧,用超声刀纵行切开Gerota筋膜,显露肾前筋膜,在肾前筋膜外与腹膜之间向腹侧深面分离,暴露出肾脏中部的肾旁前间隙。左肾根治性切除术则分离左肾门周围脂肪,可见生殖静脉汇入左肾静脉近端,以Hem-o-lok夹闭(近心端夹2个,远心端夹1个)后切断,于左肾静脉后上方分离可看到肾动脉搏动,超声刀切开肾动脉鞘膜,直角钳游离出肾动脉,同法夹闭后切断,显露肾静脉与下腔静脉间的夹角,同法夹闭肾静脉并切断。如行右肾根治性切除术,则在肾后筋膜与腰肌筋膜之间钝性分离,沿腰大肌向深面分离,首先暴露下腔静脉,上至膈下,下至髂窝,充分游离肾脏背侧,并将肾脏推向腹侧,肾门水平可见动脉搏动,超声刀切开肾动脉鞘膜,直角钳游离出肾动脉,以Hem-o-lok夹闭并切断,于其外下方找到肾静脉、生殖静脉,同法夹闭并切断,在肾下极与腰大肌之间分离并寻找输尿管,于中上段交界处用两枚Hem-o-lok夹闭后切断,提起近端将肾下极至肾门之间的组织完全游离。于Gerota筋膜外彻底游离肾脏,整块切除。将切除的肾脏放入标本袋,延长腰部切口后取出,再次检查创面,放气腹,腋后线穿刺孔放置并固定引流管,缝合切口。对照组不使用组织粉碎器清理腹膜后脂肪,余手术操作同前。
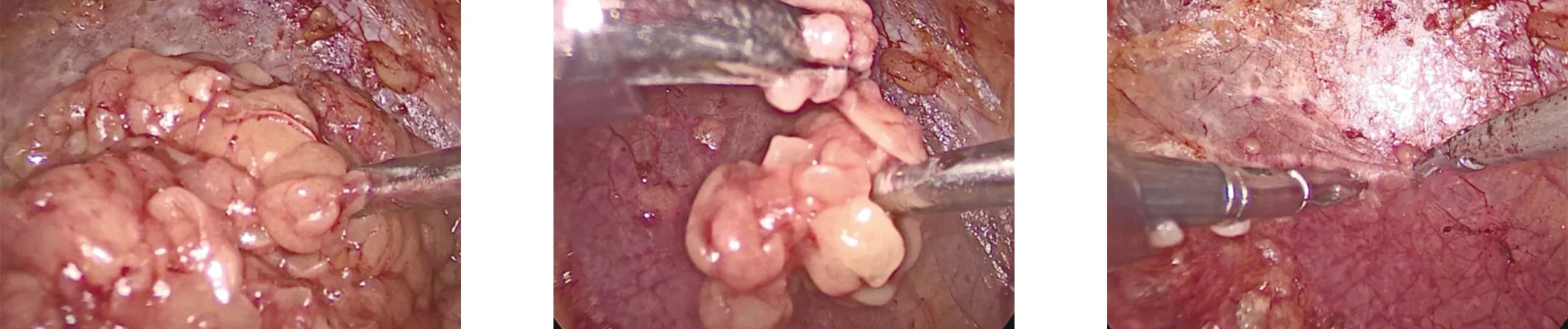
图1 已游离的腹膜后脂肪 图2 正在吸引粉碎游离脂肪的组织粉碎器 图3 已清除腹膜后脂肪的腹膜后空间
1.3 观察指标 (1)术前各组患者临床资料(年龄、体重、BMI、ASA分级、肿瘤位置及大小、肿瘤临床分期、术前血肌酐值);(2)术中数据,包括手术时间(切开皮肤至患侧肾脏完整取出)、估计失血量(根据手术记录及吸引器罐中液体判断);(3)术后数据:腹腹后引流管引流量、围术期并发症发生情况(利用Clavien-Dindo分级系统进行评估)及总住院时间。
1.4 统计学处理 采用SPSS 25.0软件进行数据分析。连续变量以均数±标准差描述,组间比较采用独立样本t检验,P<0.05为差异有统计学意义;分类变量用构成比或率描述,组间比较采用χ2检验,检验水平α为0.05。
1.5 术后随访 嘱患者术后1个月门诊复查肾功能,后每半年定期复查血肌酐值、尿素、泌尿系B超、CT等,记录患者门诊是否出现术后并发症、肿瘤复发转移情况。
2 结 果
2.1 纳入患者一般情况 各亚组中患者年龄、性别、BMI、ASA分级、肿瘤位置、肿瘤大小、肿瘤分期、术前血肌酐值等差异无统计学意义(P>0.05),见表1、表2。

表1 肥胖组患者临床资料的比较
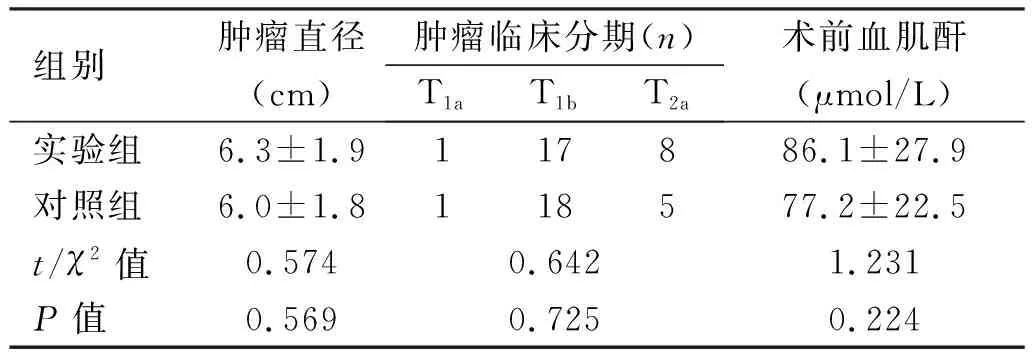
续表1
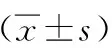
表2 非肥胖组患者临床资料的比较

续表2
2.2 术中与术后相关指标的比较 实验组中,术中清除腹膜后脂肪时间1.0~6.3 min,肥胖组使用组织粉碎器时间平均(4.1±1.3)min,非肥胖组使用组织粉碎器时间平均(2.4±1.0)min,两者差异有统计学意义(P<0.001)。
在肥胖组与非肥胖组中,实验组手术时间、术中失血量、腹膜后总引流量均少于对照组,差异有统计学意义(P<0.05);在围术期并发症及住院时间方面,两组差异无统计学意义(P>0.05)。见表3、表4。
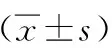
表3 肥胖组患者术中及术后相关指标的比较
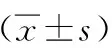
表4 非肥胖组患者术中及术后相关指标的比较
2.3 术后病理及术后随访 术后病理:实验组中肾透明细胞癌87例,肾乳头状细胞癌11例,颗粒细胞癌3例,嫌色细胞癌3例;对照组中肾透明细胞癌93例,肾乳头状细胞癌8例,颗粒细胞癌1例,嫌色细胞癌2例。经过组织粉碎器吸引出的游离腹膜后脂肪经过病理分析明确为脂肪组织细胞,未发现癌细胞等异型细胞。
在肥胖亚组中,实验组中位随访时间15(3~32)个月,3例患者失访,其中2例患者疾病进展,1例因肺转移死亡,1例因局部复发而死亡;1例患者死于其他原因,总生存率为86.8%,无疾病进展生存率为86.8%。对照组中位随访时间12(3~30)个月,2例患者失访,2例疾病进展,1例因肺转移而死亡,1例发现对侧肾上腺远处转移,无局部复发;2例患者死于其他原因,总生存率为75.0%,无疾病进展生存率为70.8%。在非肥胖亚组中,实验组中位随访时间14(2~34)个月,10例患者失访,未发生局部复发,1例发生淋巴结转移,2例出现肺转移,1例于术后3个月死亡,3例死于其他原因,总生存率为97.1%,无疾病进展生存率为91.5%。对照组中位随访时间15(2~33)个月,失访8例;局部复发1例,远处转移3例,2例因脑转移死亡,2例因其他原因死亡,总生存率为95.9%,无疾病进展生存率为80.2%。局部复发及发生转移的患者均在T2a期。总生存率及无疾病进展生存率差异均无统计学意义(P>0.05)。见表5、表6。生存曲线见图4。

表5 肥胖组患者术后随访情况的比较(n)

表6 非肥胖组患者术后随访情况的比较(n)
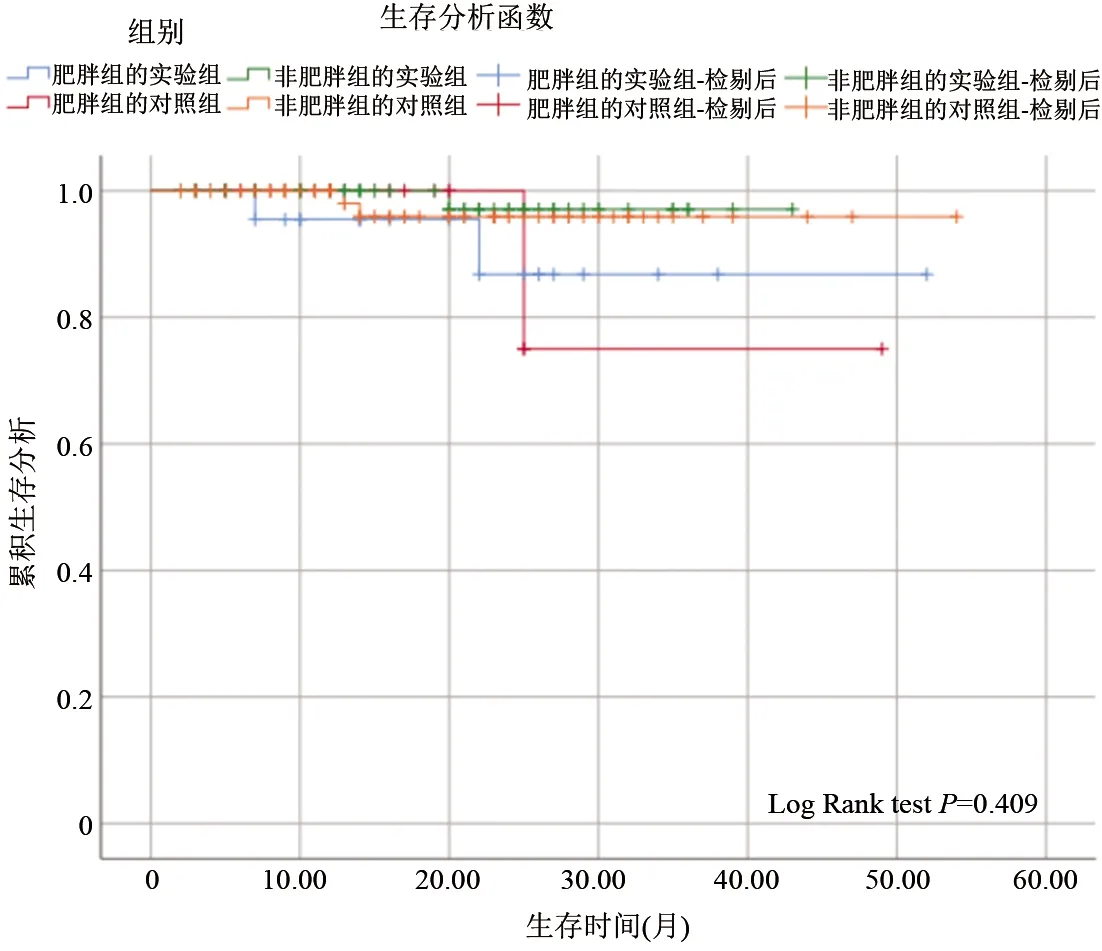
图4 Kaplan-Meier生存曲线
3 讨 论
自Clayman等[7]报道首例腹腔镜肾癌根治术后,越来越多的泌尿外科医生开始掌握此技术,其最初用于治疗肾脏良性疾病,后来逐渐应用于肾脏恶性肿瘤的治疗;随着微创技术的不断发展,腹腔镜下肾癌根治术已成为许多局限性肾癌患者的标准术式。此后,Gaur等[8]又报道了首例经腹膜后腹腔镜肾癌根治术。目前腹腔镜外科手术已被广泛应用于肾脏恶性肿瘤的治疗。
腹腔镜下肾癌根治术有经腹膜后与经腹腔两种途径,与经腹腔入路相比,经腹膜后入路因分离组织少、损伤轻、对腹腔内脏器干扰较小进而肠道并发症发生率较低,更加符合外科快速康复理念,利于术后恢复,但经腹膜后入路易受腹膜后脂肪的影响,且这些脂肪通过Trocar不容易完整取出,常规放置于腹腔后腔内,腹膜后腔本身空间狭小,过多的游离脂肪堆积往往造成术野不清,会对术者的操作造成较大影响,缺乏滋养血管的游离脂肪可导致术后腹膜后引流量增加,进而可能成为术后切口感染的促进剂,影响术后恢复。组织粉碎器可对大块软组织进行吸引切割,已普遍应用于普通外科及妇产科领域[2-3],在泌尿外科手术中,前列腺剜除术是应用组织粉碎器最多的场景[9-10]。近年出现将组织粉碎器应用于新领域的报道,如杨帆等[11]应用于清除膀胱肿瘤所致的硬质血块填塞。Yang等[12]所发表的回顾性研究表明,组织粉碎器能彻底清除术中游离的腹膜后脂肪,增加手术操作空间,整体视野更加清晰,从而降低腹膜后腹腔镜下肾癌根治术的难度。本研究中清除腹膜后脂肪时间平均(2.8±1.3)min。
这是关于组织粉碎器应用于腹膜后腹腔镜肾癌根治术的进一步前瞻性研究,我们通过先前的经验,先分为肥胖组(BMI≥28 kg/m2)与非肥胖组(BMI<28 kg/m2)两个亚组,结果显示,在两个亚组中,应用组织粉碎器的实验组能进一步拓展腹膜后空间,利于术者的操作,降低了手术难度,缩短了手术时间。手术时间越长,提示手术难度越大,术中出血量也会相对增加,实验组进而减少了术中出血量。本研究实验组术后腹膜后引流管总引流量减少也再次证明了我们的假设,但并发症发生率、总住院时间两组差异无统计学意义,这与Yang等[12]的结果类似。本研究中,为了将手术难度控制在相同的水平,我们尽可能将手术指征限定在T1b期、T2a期,腹膜后引流量可能影响引流管拔除时间,进而影响总住院时间,但本研究结果显示各亚组总住院时间并无明显缩短(P>0.05)。为了降低肿瘤扩散的风险、术后切缘的阳性率,我们未对取下的患侧肾脏使用组织粉碎器进行粉碎[13-18]。我们将患者粉碎吸出的腹膜后脂肪病理送检,发现并无肿瘤细胞浸润,再一次证明了本研究的安全性。本研究进一步证明了组织粉碎器应用于腹膜后腹腔镜下肾癌根治术的优越性,尤其肥胖患者,腹膜后脂肪的及时清除提供了更大的手术操作空间,获得更加宽广的视野,利于术者操作。这里还需要再次强调“无瘤原则”,组织粉碎器不能应用于Gerota筋膜内肾周脂肪的清除,肾周脂肪组织应与肾脏一并整块切除。
本研究的主要局限性是肥胖组的患者纳入例数较少,这可能也是非肥胖亚组中实验组手术时间稍长于肥胖亚组的原因之一,需要更多的入组患者,进一步证明对患者的有利性。
综上所述,腹膜后腹腔镜肾癌根治术中应用组织粉碎器清除腹膜后脂肪利于缩短手术时间,尤其对于肥胖的局限性肾癌患者,在减少术中出血、腹膜后引流量方面具有更显著的优势,利于术者操作,值得临床上进一步推广。
