氯化锂对人Tenon囊成纤维细胞增生抑制作用的机制研究
2021-10-27邹会会刘姗姗梁玲范晓军王继兵
邹会会 刘姗姗 梁玲 范晓军 王继兵
1德州市人民医院眼科 潍坊医学院附属德州市人民医院 253014;2潍坊眼科医院 潍坊医学院硕士研究生培养基地 261041
青光眼滤过手术是治疗青光眼常用的方法,术后人眼Tenon囊成纤维细胞(human Tenon capsule fibroblasts,HTFs)过度增生导致瘢痕化是青光眼滤过手术失败的主要原因。目前临床上常用的抗瘢痕抗代谢药物有丝裂霉素C和5-氟尿嘧啶[1-2],临床实践证实这类药物能抑制滤过通道组织的瘢痕化,提高青光眼手术的成功率,但药物相关的毒性作用和不良反应不容小觑。青光眼术后滤过通道瘢痕化一直是困扰医学界的难题,探索不同机制的抑制瘢痕化药物对于提高滤过手术的成功率具有重要意义。研究发现,在创伤愈合过程中缝隙连接细胞间通讯(gap junctional intercellular communication,GJIC)功能下降,提示GJIC功能降低对创伤愈合具有重要的促进作用[3]。已有研究通过划痕负荷法观察到氯化锂对体外培养的成纤维细胞具有上调GJIC的作用,同时发现其能够促进大鼠肉芽组织的成熟,并且肉芽组织成纤维细胞GJIC的表达水平影响伤口愈合过程中肉芽组织沉积物的质量和数量[4]。研究表明,体外培养的HTFs具有较强的GJIC功能,通过连接蛋白(connexin,Cx)43介导GJIC赋予细胞能够相互传递信息的能力,提示在人眼创伤愈合过程中GJIC在成纤维细胞功能同步化方面发挥着重要作用[5]。本课题组先前的研究证实,作为GJIC上调剂的氯化锂、芹黄素对体外培养的HTFs具有增生抑制作用,且氯化锂在40~160 mmol/L范围内对HTFs的增生抑制作用呈时间和浓度依赖性[6-7]。本研究拟探讨氯化锂对HTFs的增生抑制作用是否与上调GJIC功能有关,以期为氯化锂用于青光眼滤过手术提供依据。
1 材料与方法
1.1 材料
1.1.1标本来源 收集2019年4月于德州市人民医院眼科行斜视手术的1例11岁女性斜视患者的Tenon囊组织。本研究经德州市人民医院伦理委员会批准(批文号:2019-023),标本提供者知晓本研究目的并签署知情同意书。
1.1.2主要试剂及仪器 氯化锂、荧光黄染料(Lucifer yellow dye,LY)、罗丹明-葡聚糖(Rhodamine-Dextran,RD)(美国Sigma公司);DMEM培养基、胎牛血清(美国HyClone公司);鼠抗人波形蛋白(vimentin)单克隆抗体(OTI5D7,北京中杉金桥生物技术有限公司);FITC标记的兔抗鼠IgG二抗(ab6724,英国Abcam公司);鼠抗人Cx43单克隆抗体(CX-1B1,美国Invitrogen公司);逆转录试剂盒、实时荧光定量PCR试剂盒(大连宝生物工程有限公司)。Forma CO2培养箱(美国Thermo Fisher公司);光学倒置显微镜(TH4-200,日本Olympus公司);PCR仪、实时定量PCR仪(澳大利亚Corbett公司);激光扫描共焦显微镜(德国Leica TCS SPE公司)。
1.2 方法
1.2.1HTFs培养 将斜视手术中所取的结膜下Tenon囊组织块剪成1 mm×1 mm×1 mm的小组织块,接种于培养皿中,周围滴加1 ml含体积分数15%胎牛血清、100 U/ml(商品单位)青霉素、100 U/ml链霉素的DMEM培养基,置于37 ℃、体积分数5% CO2培养箱中培养3 h,待组织块贴壁牢固后,向培养皿中加入5 ml DMEM培养基,使组织块浸入其中,进行传代培养,取第4代细胞用于实验。
1.2.2HTFs鉴定 将生长良好的第4代HTFs接种于6孔板中,生长达85%融合后,采用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,质量分数4%多聚甲醛溶液固定60 min,PBS洗3次,每次3 min,体积分数0.3% TritonX-100室温孵育20 min,PBS洗3次,每次3 min,质量分数10%正常山羊血清封闭液37 ℃孵育30 min,弃去封闭液,加入鼠抗人vimentin单克隆抗体(1∶ 200)4 ℃过夜,PBS洗3次,每次3 min,加入稀释的FITC标记兔抗鼠IgG二抗(1∶ 100)37 ℃孵育2 h,PBS洗3次,每次3 min,荧光显微镜下观察并拍照。采用PBS代替一抗作为阴性对照。
1.2.3HTFs分组及处理 将细胞体透亮、细胞质丰富的第4代细胞接种于6孔板,待细胞达60%~70%融合后,将6孔板培养的细胞分成对照组和氯化锂处理组,对照组加入不含氯化锂的细胞培养基,氯化锂处理组加入含80 mmol/L氯化锂的细胞培养基,继续培养48 h。
1.2.4细胞划痕染料示踪法评估GJIC功能 取6孔板培养的细胞,弃去培养液,用PBS洗涤细胞3次,加入相对分子质量为457.24、质量浓度为0.5 g/L的LY 1 ml和相对分子质量为70 000、质量浓度为0.5 g/L的RD染料1 ml,用手术刀片在平皿底部轻轻划数条线,静止5 min,吸出染液,PBS洗3次,去除游离的荧光染料及脱落的细胞。滴加4%多聚甲醛固定20 min后置于光学显微镜下观察并拍照,记录偶联指数。RD只能局限于划痕旁损伤的细胞中,不能通过GJIC传递,LY可以通过GJIC传递。偶联指数=呈现黄绿色荧光的LY标记细胞数/呈现红色荧光的RD标记细胞数,偶联指数越高,与GJIC相关联的成纤维细胞数量越多。实验重复3次,取平均值。
1.2.5细胞免疫荧光法检测HTFs中Cx43的表达和定位 取6孔板培养的细胞,弃去培养液,用PBS洗涤细胞3次,每次3 min。4%多聚甲醛固定60 min,PBS洗3次,每次3 min。体积分数10%正常山羊血清封闭液37 ℃孵育30 min,弃去封闭液,加入稀释的鼠抗人Cx43抗体(1∶ 250)4 ℃过夜,PBS洗3次,每次3 min,加入稀释的FITC标记的兔抗鼠IgG二抗(1∶ 100)37 ℃孵育2 h,PBS洗3次,每次3 min,Hoeschst33258染核20 min,PBS洗3次,每次3 min。采用体积分数50%无荧光缓冲甘油封片,在激光扫描共焦显微镜下观察并拍照。Cx43主要分布于细胞相连处的细胞膜上,呈绿色荧光,细胞核呈蓝色荧光。
1.2.6实时荧光定量PCR法检测HTFs中Cx43 mRNA表达 取6孔板中的培养细胞,按照说明书提取总RNA,将其逆转录为cDNA。Cx43正向引物序列为5’-ATAGACGGATCTGAGTGCCTGAA-3’,反向引物序列为5’-GCTCCAGTCACCCATGTTG-3’;GAPDH正向引物序列为5’-GCACCGTCAAGGCTGAGAAC-3’,反向引物序列为5’-TGGTGAAGACGCCAGTGGA-3’。反应条件为95 ℃预变性5 s;95 ℃变性30 s,58 ℃退火及延伸20 s,循环40次。采用熔解曲线验证扩增产物纯度。以GAPDH为内参照,各实验组采用3管平行扩增,重复3次。采用2-△△Ct法计算Cx43 mRNA相对表达量。
1.2.7Western blot法检测HTFs中Cx43蛋白表达 收集HTFs,加入细胞裂解液提取细胞总蛋白,测定蛋白浓度,样品在95 ℃下变性5 min,每孔蛋白上样量为30 μg,行聚丙烯酰胺凝胶电泳,电转至聚偏氟乙烯膜上。质量分数5%脱脂奶粉封闭1 h,加入鼠抗人Cx43单克隆抗体(1∶ 250)4 ℃过夜,PBS漂洗,加入辣根过氧化物酶标记的羊抗鼠IgG(1∶ 2 500)室温孵育1 min,X线曝光,以β-actin作为内参,进行图像扫描分析。Cx43蛋白相对表达量=Cx43蛋白条带灰度值/β-actin条带灰度值。
1.3 统计学方法
采用SPSS 21.0统计学软件进行统计分析,计量资料数据经Shapiro-Wilk检验证实符合正态分布,以mean±SD描述,采用Levene检验证实组间数据资料方差齐,计数资料以频数和百分数描述。采用均衡分组单因素干预两水平研究设计,对照组与氯化锂处理组间偶联指数、Cx43 mRNA和蛋白相对表达量比较均采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 HTFs鉴定
HTFs组织块接种后约8 d可见细胞由组织块周围游离出来,细胞呈典型的长梭形,细胞体透亮,细胞质丰富,细胞核呈圆形或椭圆形。3周左右长满培养皿并融合,细胞呈单层放射状或涡旋状贴壁生长。培养细胞的细胞质中可见vimentin阳性表达,呈均匀的绿色荧光,细胞核为无荧光暗区(图1)。根据取材部位、细胞形态及免疫荧光检测可确定为HTFs。

图1 培养细胞中vimentin免疫荧光染色图(FITC ×400,标尺=40 μm) 培养细胞的细胞质中vimentin呈阳性表达,为绿色荧光Figure 1 Immunofluorescence staining of vimentin in cultured cells (FITC ×400,bar=40 μm) Vimentin-positive expression (green fluorescence) was observed in the cytoplasm
2.2 2个组HTFs偶联指数比较
细胞划痕染料示踪实验显示,氯化锂处理组LY传递的细胞层数明显增多(图2)。氯化锂处理组细胞偶联指数为9.04±0.53,明显高于对照组的4.94±0.39,差异有统计学意义(t=-18.79,P<0.01)。
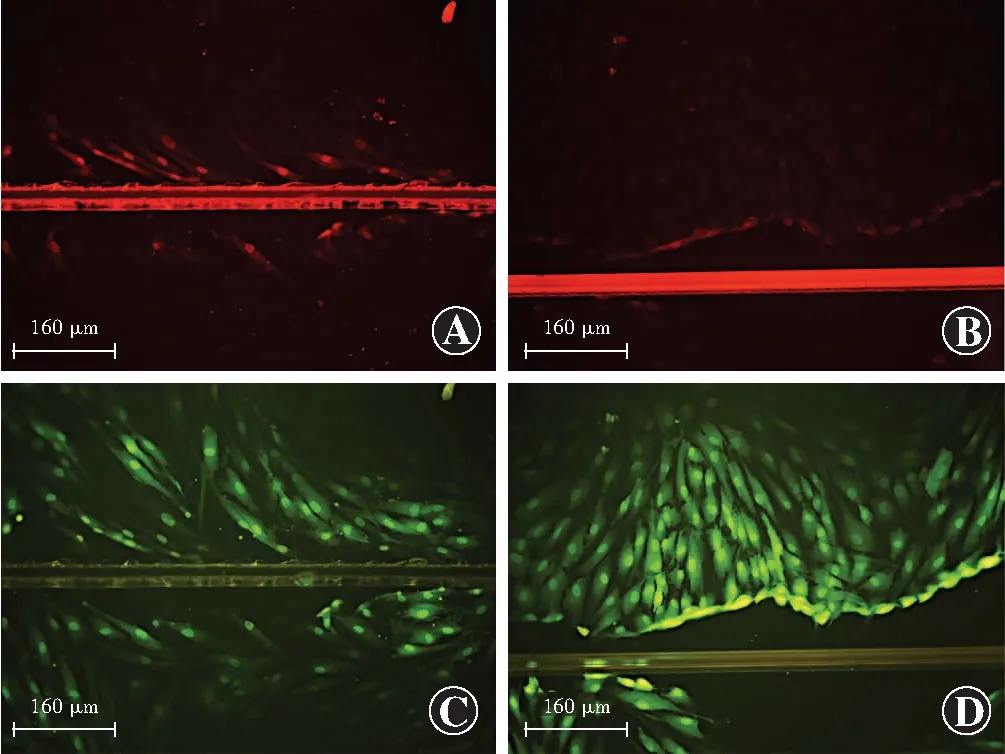
图2 2个组HTFs细胞划痕染料示踪法测定(×100,标尺=160 μm) 带有RD染料的细胞呈红色荧光,带有LY染料的细胞呈绿色荧光,RD仅局限于划痕旁损伤的细胞中,LY通过GJIC向周围细胞内传递,氯化锂处理组LY传递的细胞层数明显增多 A:对照组RD荧光染色 B:氯化锂处理组RD荧光染色 C:对照组LY荧光染色 D:氯化锂处理组LY荧光染色Figure 2 Scrape-loading and dye transfer of HTFs in the two groups (×100,bar=160 μm) Cells with RD dye showed red fluorescence and cells with LY dye presented green fluorescence.RD was restricted to cells with parascratch damage,and LY could be delivered to the surrounding cells through GJIC.The number of cell layers stained with LY was significantly increased in the LiCl treatment group A:Control group with RD staining B:LiCl treatment group with RD staining C:Control group with LY staining D:LiCl treatment group with LY staining
2.3 2个组HTFs中Cx43的表达及定位比较
免疫荧光染色结果显示,对照组HTFs中Cx43荧光呈点状分布于细胞相连处的细胞膜上,呈绿色荧光,氯化锂处理组HTFs中Cx43荧光强度较对照组明显增强(图3)。
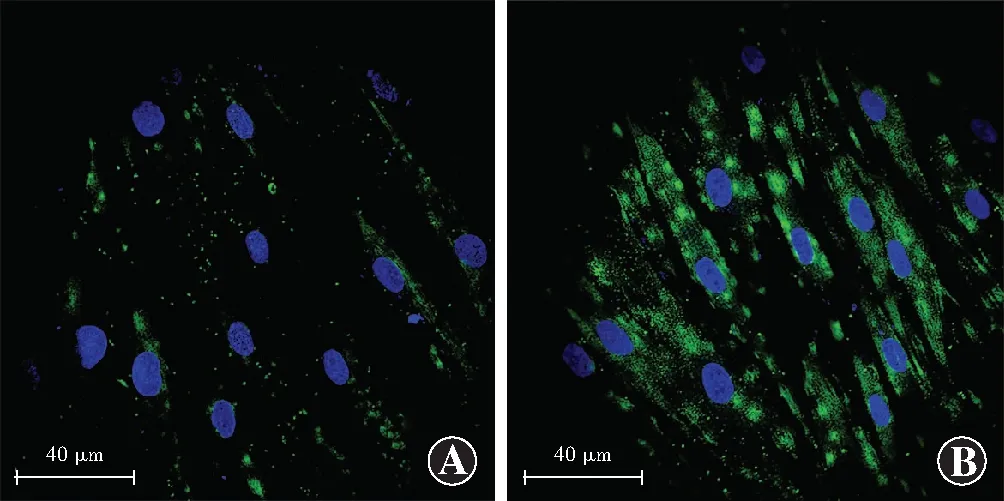
图3 2个组HTFs中Cx43免疫荧光染色图(Hoeschst33258 ×400,标尺=40 μm) Cx43主要分布于细胞相连处的细胞膜上,呈绿色荧光,细胞核呈蓝色荧光;与对照组相比,氯化锂处理组Cx43染色明显增强 A:对照组 B:氯化锂处理组Figure 3 Immunofluorescence staining of Cx43 in HTFs of the two groups (Hoeschst33258 ×400,bar=40 μm) Cx43 expression (green fluorescence) was observed in the cell membrane between adjacent cells,and the nuclei showed blue fluorescence.Compared with the control group,Cx43 staining was obviously enhanced in the LiCl treatment group A:Control group B:LiCl treatment group
2.4 2个组HTFs中Cx43 mRNA表达比较
对照组Cx43 mRNA的相对表达量设为1,氯化锂处理组Cx43 mRNA的相对表达量为1.97±0.23,明显高于对照组,差异有统计学意义(t=-14.426,P<0.05)。
2.5 2个组HTFs中Cx43蛋白表达比较
Western blot检测结果显示,氯化锂处理组Cx43蛋白表达条带亮度显著强于对照组;氯化锂处理组Cx43蛋白相对表达量为0.871±0.057,明显高于对照组的0.446±0.028,差异有统计学意义(t=-11.682,P<0.01)(图4)。
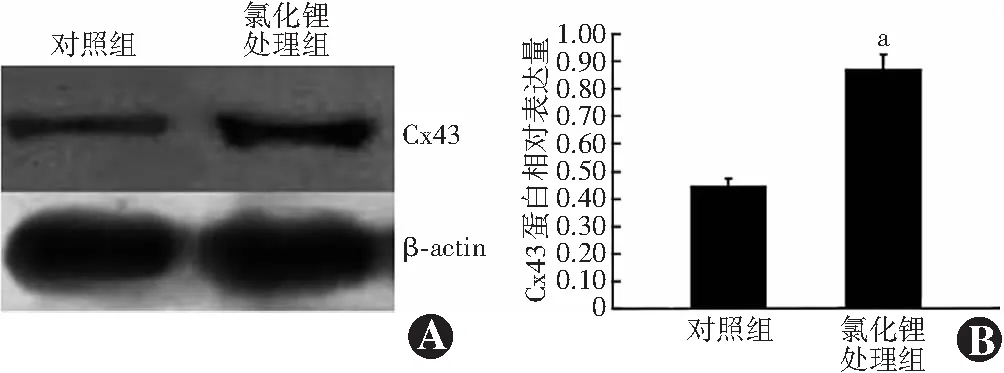
图4 2个组Cx43蛋白表达比较 A:Western blot法检测Cx43蛋白表达电泳图 与对照组比较,氯化锂处理组HTFs中Cx43蛋白表达条带明显增强 B:2个组Cx43蛋白相对表达量比较 与对照组比较,aP<0.05(独立样本t检验,n=3) Cx:连接蛋白;β-actin:β肌动蛋白Figure 4 Comparison of Cx43 protein expression between the two groups A:Electrophoretogram of Cx43 protein expression by Western blot Compared with the control group,the expression band of Cx43 protein in the LiCl treatment group was significantly enhanced B:Comparison of the relative expression levels of Cx43 protein between the two groups Compared with the control group,aP<0.05 (Independent-samples t test,n=3) Cx:connexin
3 讨论
青光眼是以病理性眼压升高造成特征性视神经损害和视野缺损的一组疾病,若不及时进行有效治疗会致盲。2020年全球原发性青光眼患病人数超过7 600万,2040年将超过1亿[8]。中国是青光眼患者人数较多的国家,2020年中国青光眼患者人数约为2 100万,致盲人数达567万[9-10]。对于药物难以控制的青光眼,滤过性手术是首选的治疗方法。为了提高手术成功率,术中常规应用丝裂霉素、5-氟尿嘧啶等抗代谢药物来抑制滤过通道的纤维瘢痕化,但术后滤过泡渗漏、疱疹感染、化脓性眼内炎、慢性低眼压、低眼压性黄斑病变和角膜上皮细胞毒性等并发症也随之增多,使得其临床应用效果不佳[11]。因此,寻求新的瘢痕愈合调控方法成为眼科界面临的挑战。
缝隙连接是细胞与外界环境进行离子交换的膜通道结构,对于维持细胞内外离子动态平衡具有重要作用[12]。Cx43是哺乳动物体内表达广泛的Cx,某些信号分子与Cx43的羧基端特定位点相互作用可以调节缝隙连接通道的开放与关闭[13]。缝隙连接在创伤愈合的研究主要集中于皮肤,有研究证实,与正常成纤维细胞相比,增生性瘢痕中成纤维细胞间通讯受到抑制,瘢痕疙瘩中成纤维细胞间通讯被阻断[14]。另有研究发现,正常成纤维细胞一旦相互接触后则停止生长,而增生性瘢痕中的部分成纤维细胞和瘢痕疙瘩中成纤维细胞接触后仍继续增生[15-16]。这些研究表明,细胞间正常的通讯功能被抑制可能是导致瘢痕形成的原因之一。有研究发现,创伤后1~2 d,伤口边缘细胞中Cx43的表达及细胞间的通讯连接功能短暂降低以促进细胞增生,随着伤口的不断愈合,Cx43的表达量逐渐升高,形成更多的GJIC,以便于细胞间的信息交流,而大量增生的细胞会逐渐凋亡[17]。降低伤口处Cx43蛋白的表达水平会显著加快伤口愈合的速度和质量,具体表现在角化细胞迁移和增生加快、纤维细胞分化为肌成纤维细胞的速度加快、肉芽组织形成及成熟提前等[18-21]。这些研究提示我们,在创伤愈合过程中,缝隙连接蛋白表达异常和GJIC功能异常可能是细胞增生活跃导致瘢痕形成的原因之一。青光眼术后术区成纤维细胞过度增生导致瘢痕形成是手术失败的主要原因,然而其瘢痕化和皮肤中瘢痕形成的原因是否一致,通过GJIC调节剂能否对青光眼滤过术区成纤维细胞进行有效干预仍不清楚,这是本课题研究的重点。
本实验采用氯化锂干预体外培养的HTFs 48 h,结果显示HTFs间偶联指数明显高于对照组,证实氯化锂具有上调GJIC功能的作用。氯化锂处理组Cx43 mRNA和蛋白的相对表达量明显高于对照组,对照组Cx43荧光呈点状分布于细胞相连处的细胞膜上,氯化锂处理组Cx43荧光染色明显增强,证实氯化锂能够促进Cx43表达。由此推断,氯化锂增强GJIC功能是抑制HTFs增生的机制之一。这不仅为氯化锂应用于抗青光眼滤过手术瘢痕化提供了证据,也为调控青光眼滤过术后瘢痕化的治疗提供了新的思路。然而,这一实验是基于体外培养的HTFs完成,而氯化锂在活体内的抑制作用是否与体外一致,以及GJIC调节剂的确切疗效和安全范围等仍有待进一步在动物体内验证。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明邹会会:实验研究的执行人,完成数据整理与分析及论文写作;刘姗姗:参与实验研究和实验结果分析;梁玲:协助完成细胞培养中的取材部分,参与指导实验研究;范晓军:参与数据整理与统计分析;王继兵:本研究的设计者,制定整体的研究目标,指导并修改论文
