慢病毒介导PEDF基因修饰人脐带间充质干细胞的定量蛋白质组学研究
2021-10-27蒋依琳张晓敏邵先锋安金颖苏琳蒋元丰李筱荣
蒋依琳 张晓敏 邵先锋 安金颖 苏琳 蒋元丰 李筱荣
天津医科大学眼科医院 天津医科大学眼视光学院 天津医科大学眼科研究所 天津市视网膜功能与疾病重点实验室 天津市眼科学与视觉科学国际联合研究中心 300384
新生血管性眼病是一类常见的眼部疾病,其发生与病理条件下眼部血管内皮生长因子(vascular endothelial growth factor,VEGF)水平升高密切相关,抗VEGF药物可在一定程度上发挥治疗新生血管性眼病的效果,然而,长期使用抗VEGF药物存在促进纤维血管膜产生和造成视网膜萎缩等风险[1]。因此,探索具有VEGF抑制作用的新型新生血管治疗制剂对于眼部新生血管性疾病的治疗具有重要意义。色素上皮衍生因子(pigment epithelium-derived factor,PEDF)最早发现于人视网膜色素上皮细胞的条件培养基中,被认为具有神经保护特性[2]。随后的研究发现PEDF可通过诱导活化内皮细胞凋亡和拮抗VEGF从而发挥抑制血管生成的作用[3-4],是天然存在的有效抗新生血管因子。PEDF在血浆中半衰期较短,外源性给药不易达到理想的治疗效果,其临床转化受到限制。间充质干细胞(mesenchymal stem cells,MSCs)技术的飞速发展和基因修饰技术的兴起为PEDF的临床应用带来了希望。MSCs是一类具有自我更新、高度增生、多向分化、归巢迁移、低免疫原性特点的成体干细胞,具有损伤修复、神经保护、免疫抑制、营养、基因工程载体等作用。研究表明,MSCs在炎症、退行性疾病、免疫性疾病中均可发挥一定的治疗作用[5-7]。在眼科领域,已证实MSCs可用于治疗视网膜及视神经病变、眼部外伤、干眼等眼部疾病[8-9]。基因修饰技术通过基因组修饰改变细胞遗传物质,改善和增强生物细胞功能[10]。PEDF基因修饰MSCs有望发挥二者的协同作用,增强对眼科相关疾病的治疗作用。经PEDF基因修饰的MSCs作为治疗新生血管性疾病和神经退行性疾病的新型生物制剂,目前已用于脑、肺脏、肝脏和肠道肿瘤的治疗研究[11-14];在眼科领域,研究发现PEDF基因修饰MSCs对糖尿病大鼠的视网膜组织具有保护作用[15]。基因修饰在改变细胞目的基因表达水平的同时可引起细胞的一系列变化,但目前尚未有研究对此进行深入探讨。蛋白质组学技术可用于探索细胞内蛋白的种类及动态变化,为基因修饰后MSCs蛋白质组学及功能特点的研究提供新思路。本研究拟采用定量蛋白质组学技术对慢病毒介导PEDF基因修饰后的人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)中蛋白表达量进行测定,结合基因本体论(Gene Ontology,GO)分析和Reactome信号通路显著性富集对差异蛋白进行生物信息学分析,为深入了解PEDF基因修饰后hUCMSCs的功能变化提供实验依据,为其应用于新生血管性眼病的临床治疗奠定基础。
1 材料与方法
1.1 材料
1.1.1细胞来源 慢病毒介导PEDF基因修饰的hUCMSCs和正常hUCMSCs由北京贝来生物科技有限公司提供。
1.1.2主要试剂及仪器 磷酸盐缓冲液(phosphate bufferd saline,PBS)(美国Gibco公司);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);二硫苏糖醇(dithiothreotol,DTT)、碘乙酰胺(iodoacetamide,IAA)、尿素、钒酸钠、氟化钠、脱氧胆酸钠(美国Sigma公司);蛋白酶抑制剂、磷酸酶抑制剂(瑞士Roche公司);胰蛋白酶(美国Progema公司)。96孔板(美国Corning公司);CO2细胞培养箱(美国Thermo Scientific公司);Triple TOF 6600质谱仪、ekspert nanoLC 415液相色谱仪(美国AB Sciex公司)。
1.2 方法
1.2.1慢病毒介导的PEDF基因修饰hUCMSCs蛋白质谱样本的制备 以3株不同脐带来源的正常hUCMSCs为对照组(批号:B00361、B00160、B00055),以3株慢病毒介导PEDF基因修饰的对照组同源hUCMSCs作为实验组(批号:PEDF-17015、PEDF-17003-2、PEDF-17003-1),对照组及实验组细胞均为P5代。室温条件下1 000×g离心5 min,使用预冷的PBS清洗细胞3次,加入8 mol/L尿素裂解液,室温下裂解5 min。将样本置于冰上进行超声破碎,超声能量为35%,超声3 s,停3 s,超声时长为2 min。20 ℃条件下14 000×g离心10 min。取上清液,采用BCA法测定样本蛋白浓度。每个样本取等量蛋白,加入终浓度为10 mmol/L的DTT 37 ℃孵育1 h,断开蛋白二硫键。加入终浓度为40 mmol/L的IAA室温条件下避光孵育1 h进行烷基化反应。在集合管上标记样本编号,采用150 μl甲醇溶液平衡相对分子质量10 000超滤管2次,20 ℃下14 000×g离心5 min。加入50 mmol/L的碳酸氢铵(NH4HCO3)平衡液300 μl冲洗2次。每管加入100 μg处理后的样本,4 ℃条件下14 000×g离心20 min。加入NH4HCO3溶液300 μl,清洗3次,更换收集管,加入NH4HCO3溶液75 μl至超滤管中,加入3 μg胰蛋白酶,37 ℃孵育12~16 h。用移液枪吹打混匀超滤管中的样本,4 ℃条件下14 000×g离心20 min,加入NH4HCO3溶液50 μl冲洗2次,向收集管中加入体积分数1%甲酸溶液终止酶切反应,60 ℃真空蒸干后,每管加入0.1%甲酸水溶液30 μl重悬获得肽段样本,采用NanoDrop微量分光光度计测定肽段浓度。
1.2.2质谱检测法鉴定细胞中可定量蛋白及其表达 样本进行高pH反向分馏处理后,取1.5 μg肽段,用含0.1%甲酸、体积分数2%乙腈的水溶液以3 μl/min流速将其加载至C18预柱上(100 μm×2 cm,C18填料规格为3 μm、120 A)。使用不同梯度的洗脱剂洗脱预柱,洗脱剂为97.9%乙腈、体积分数2%水和0.1%甲酸,洗脱肽段经分析柱(150 μm×15 cm,C18填料规格为1.9 μm、120 A)分离并进入质谱检测。洗脱剂梯度为0 min-5%、2 min-10%、65 min-22%、91 min-35%、92 min-80%、105 min-80%、106 min-5%、120 min-5%,流速为500 nl/min。数据采集模式为SWATH。质谱采集参数:飞行时间质谱(time of flight mass spectrometer,TOF-MS)累加时间为0.05 s,二级采用高灵敏扫描方式,可变窗口数为100个,每个窗口累加时间为30 ms,质量扫描范围为100~1 500,使用SWATH Variable Window Calculator_V1.1程序计算每个可变窗口的质量范围。
1.2.3质谱数据的生物信息学分析 对SWATH模式采集的数据进行定量,定量时参数设置:每个蛋白选取6个肽段,每个肽段选取6个离子对,肽段可信度为99%,假阳性率为1%,排除修饰肽段,峰值提取窗口为10 min,质量偏差50 ppm以内。每10 min选取2个内源性肽段进行保留时间矫正,输出峰面积作为原始定量值。对所获定量值进行log2转换,使其分布接近正态分布。采用R语言preprocessCore包中的normalize.median函数对log2转换后的数据进行归一化,去除无基因名字的蛋白,对所获数据进行生物信息学分析。采用R语言corrplot包进行Pearson相关分析,采用火山图和聚类分析热图观察组间差异蛋白表达情况,采用R语言clusterProfiler包进行GO分析和Reactome信号通路富集,采用String 11.0数据库分析蛋白-蛋白间相互作用,作用强弱以节点大小和连线粗细表示。
1.3 统计学方法
采用R语言stats包t.test函数进行统计分析,计量资料经直方图检验接近正态分布,采用均衡分组单因素干预两水平研究设计,实验组与对照组间蛋白表达差异比较采用独立样本t检验,差异表达倍数>1.5且P<0.05的蛋白为差异蛋白。
2 结果
2.1 慢病毒介导的PEDF基因修饰后hUCMSCs蛋白表达变化
质谱分析共鉴定出5 361个可定量蛋白。与对照组相比,实验组慢病毒介导的PEDF基因修饰后差异表达倍数>1.5且P<0.05的蛋白共432个,其中上调蛋白219个,包括丝氨酸蛋白酶抑制剂家族F成员1(serpin family F member 1,SERPINF1)、DEAD-box家族螺旋酶59(DEAD-box helicase 59,DDX59)、血小板反应蛋白1(thrombospondin 1,THBS1)等;下调蛋白213个,包括Ⅰ型胶原蛋白α1链(collagen type Ⅰ alpha 1 chain,COL1A1)、COL18A1等(图1,2)。Pearson相关分析显示,实验组与对照组样本组内及组间蛋白表达量相关系数均≥0.96,表明数据具有极高重复性(图3)。
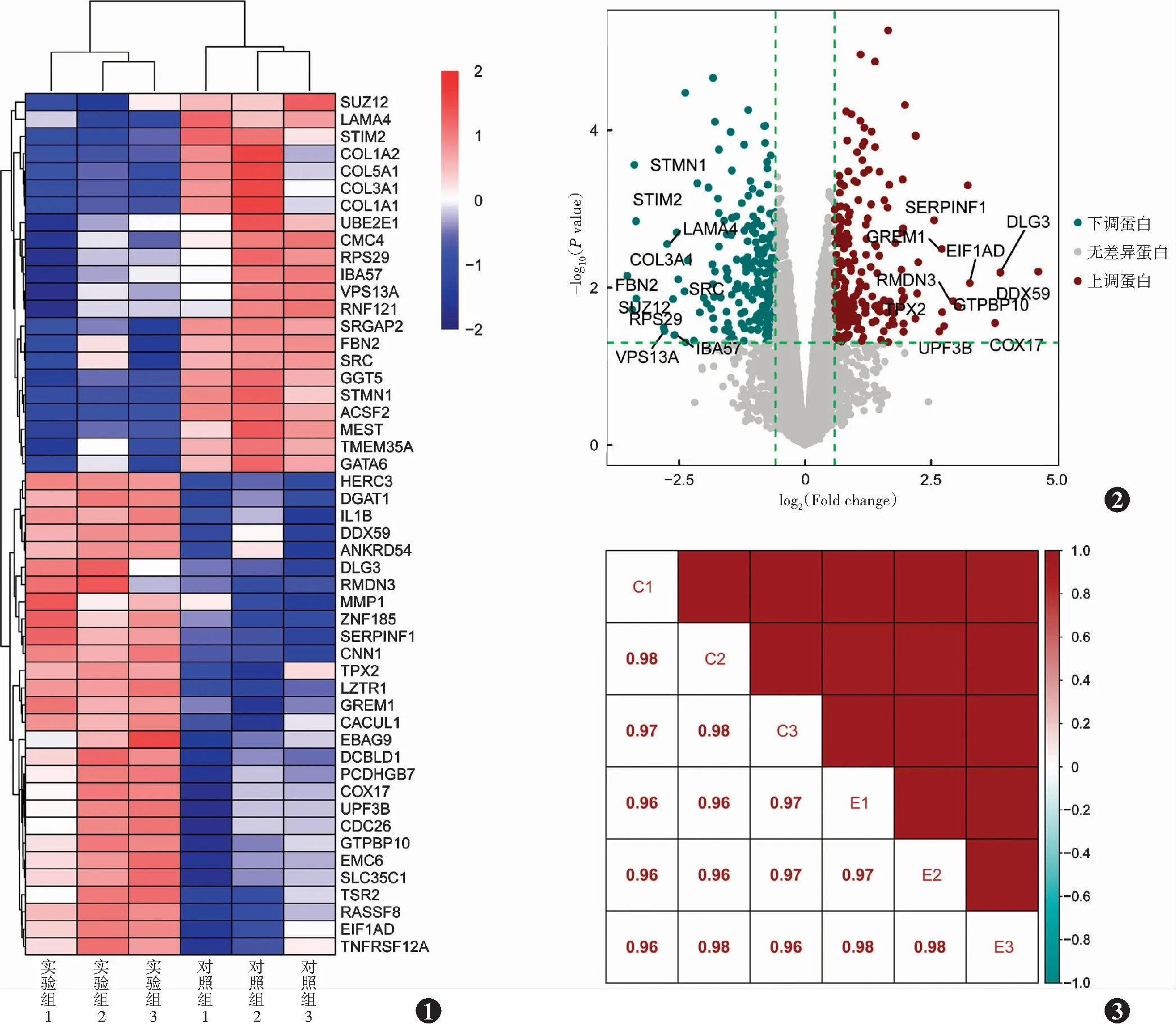
图1 实验组和对照组差异蛋白聚类热图 实验组为慢病毒介导PEDF基因修饰的hUCMSCs,对照组为正常hUCMSCs。右侧为差异蛋白基因,红色方格代表上调蛋白,蓝色方格代表下调蛋白 COL1A2:Ⅰ型胶原蛋白α2链;IL:白细胞介素;DDX:DEAD-box家族螺旋酶;SERPINF:丝氨酸蛋白酶抑制剂家族F成员 图2 慢病毒介导的PEDF基因修饰后差异蛋白火山图 红点表示上调蛋白,绿点表示下调蛋白 COL3A1:Ⅲ型胶原蛋白α1链;SERPINF:丝氨酸蛋白酶抑制剂家族成员F;DDX:DEAD-box家族螺旋酶 图3 实验组和对照组样本间差异蛋白表达量Pearson相关分析 C:对照组,为正常hUCMSCs;E:实验组,为慢病毒介导PEDF基因修饰的hUCMSCsFigure 1 Heat map of differentially expressed proteins between the experimental group and control group Cells in the experimental group were hUCMSCs with PEDF gene modification mediated by lentivirus,and cells in the control group were normal hUCMSCs.On the right were the genes of differentially expressed proteins.Red squares represented up-regulated proteins,and blue squares were down-regulated proteins COL1A2:collagen type Ⅰ alpha 2 chain;IL:interleukin;DDX:DEAD-box helicase;SERPINF:serpin family F member Figure 2 Volcano plots of differentially expressed proteins after PEDF gene modification medicated by lentivirus Red dots indicated up-regulated proteins,and green dots were down-regulated proteins COL3A1:collagen type Ⅲ alpha 1 chain;SERPINF:serpin family F member;DDX:DEAD-box helicase Figure 3 Pearson correlation analysis of samples between the two groups C:Normal group with the normal hUCMSCs;E:Experimental group with PEDF gene-modified hUCMSCs mediated by lentivirus
2.2 慢病毒介导的PEDF基因修饰后差异蛋白GO和Reactome信号通路分析
GO分析结果显示,与对照组相比,实验组慢病毒介导的PEDF基因修饰后上调蛋白参与纤维蛋白溶解、细胞外结构构建、一氧化氮介导的信号转导调节、转运蛋白活性调节等生物学进程,位于细胞-基质连接、焦点连接等处,显著富集的分子功能包括肌动蛋白结合、蛋白质-脂质复合物结合、脂蛋白颗粒结合、细胞外基质结构组成等;下调蛋白参与的生物学进程包括仲醇及胆固醇生物合成、甾醇生物合成调控、辅酶代谢、肽酶活性调节、细胞-基质黏附等,分布于胶原三聚体、胶原蛋白细胞外基质、内质网腔等处,显著富集的分子功能包括具有抗拉强度的细胞基质结构组成、血小板衍生生长因子结合、辅酶结合、氧化还原酶活性调节等(图4)。

图4 慢病毒介导的PEDF基因修饰后差异蛋白GO分析 纵坐标为基因注释富集条目;横坐标为校正后P值,该值越小表示富集越显著 A:上调蛋白 B:下调蛋白Figure 4 GO analysis result of differentially expressed proteins after PEDF gene modification mediated by lentivirus The ordinate showed the enrichment of GO annotation terms,and the abscissa showed the corrected P value.The smaller the P value,the more significant the enrichment A:Up-regulated proteins B:Down-regulated proteins
Reactome信号通路分析结果显示,实验组慢病毒介导的PEDF基因修饰后上调蛋白主要参与胰岛素样生长因子结合蛋白(insulin like growth factor binding protein,IGFBP)调节IGF的运输和摄取及翻译后蛋白质磷酸化等通路,下调蛋白主要参与细胞外基质构成、糖皮质激素代谢等通路(图5)。

图5 慢病毒介导的PEDF基因修饰后差异蛋白参与的信号通路分析 纵坐标为Reactome信号通路富集条目;横坐标为参与相应通路的差异蛋白数目与鉴定出的总蛋白数比值;点的颜色表示校正后P值,该值越小,表示参与相应信号通路的差异蛋白富集越显著;点的大小表示参与相应信号通路的差异蛋白数目,该点越大,表示该通路中差异蛋白数目越多 A:上调蛋白 B:下调蛋白 IGFBP:胰岛素样生长因子结合蛋白;NMDA:N-甲基-D-天冬氨酸;SREBP:固醇调节元件结合蛋白;PTK:酪氨酸激酶Figure 5 Reactome pathway analysis result of differentially expressed proteins after PEDF gene modification mediated by lentivirus The ordinate showed the enriched Reactome pathways and the abscissa showed the ratio of the number of proteins in each pathway to the number of differentially expressed proteins.The color of the dot displayed the corrected P value.The smaller the P value,the more significant the enrichment of differential proteins involved in the corresponding signaling pathway.The size of the dot indicated the number of differentially expressed proteins involved in the corresponding signaling pathway.The larger the dot,the greater the number of differential proteins in the pathway A:Up-regulated proteins B:Down-regulated proteins IGFBP:insulin like growth factor binding protein;NMDA:N-methyl-D-aspartic acid;SREBP:sterol regulatory element binding protein;PTK:phosphotyrosinekinase
2.3 慢病毒介导PEDF基因修饰后差异蛋白相互作用
差异蛋白相互作用分析显示,上调蛋白中,THBS1、COL13A1、载脂蛋白B等与其他差异蛋白具有较强的相互作用;下调蛋白中,COL1A1、COL18A1、整合素亚基β5等与其他差异蛋白具有较强相互作用,其中COL1A1与SERPINF1相互作用明显(图6)。

图6 慢病毒介导的PEDF基因修饰后差异蛋白相互作用网络 差异蛋白及其相互作用以节点和连线表示,红点代表上调蛋白,蓝点代表下调蛋白。点的颜色深度表示差异蛋白变化倍数,颜色越深表明变化倍数越大;点的大小表示与该蛋白具有相互作用的蛋白数;连线表示蛋白间相互作用可信度 COL1A1:Ⅰ型胶原蛋白α1链;THBS:血小板反应蛋白Figure 6 Interaction network of differentially expressed proteins after PEDF gene modification mediated by lentivirus Differentially expressed proteins and their interactions were represented by dots and lines.Red dots represented up-regulated proteins,and blue dots exhibited down-regulated proteins.The depth of the dot color indicated the fold change of the differential proteins.The darker the color,the greater the fold change.The size of the dot indicated the number of proteins that had an interaction with the protein.The line indicated the credibility of the interaction between the proteins COL1A1:collagen type Ⅰ alpha 1 chain;THBS:thrombospondin
3 讨论
年龄相关性黄斑变性、糖尿病视网膜病变和新生血管性青光眼等眼病均可出现眼部新生血管,严重危害患者视力,病变发生和发展与眼部VEGF水平密切相关。对VEGF有拮抗作用的PEDF及与PEDF有协同作用的MSCs近年来受到眼科研究者的高度关注。本研究对慢病毒介导的PEDF基因修饰后hUCMSCs蛋白质组学变化进行分析,以期为探索更有效的新生血管性眼病治疗方法提供新思路。
MSCs来源广泛,不同来源的MSCs功能特点有所不同,目前研究中所涉及的MSCs主要来自骨髓、脐带、脂肪组织和沃顿胶等。MSCs表达多种生物活性分子,可通过旁分泌的方式或细胞外囊泡介导调节组织微环境[16]。近年来,有研究采用蛋白质组学技术探索不同类型MSCs及其分泌组的蛋白质表达水平,以深入了解MSCs的功能及作用机制。Islam等[17]对多种组织来源MSCs分泌组行蛋白质组学分析,结果表明hUCMSCs中血小板衍生生长因子β1、血小板衍生生长因子D和单核细胞趋化蛋白1等参与细胞信号传递的蛋白表达水平显著上调,而基质金属蛋白酶、丝氨酸蛋白酶抑制剂和补体因子等分解代谢相关蛋白表达水平显著下调,深入研究发现hUCMSCs具有较好的抗炎和营养作用。Qiu等[18]进行的蛋白质组学分析表明,MSCs衍生的胞外囊泡中半乳糖凝集素3结合蛋白、穿透素3和脑啡肽酶等蛋白可参与免疫调节、神经保护和多个器官疾病的治疗。尽管MSCs相关蛋白质组学研究较多,但针对基因修饰后MSCs蛋白质组学改变的研究尚未见报道。慢病毒属于逆转录病毒,对靶细胞毒性低,具有低免疫原性和较高转染效率的特点,可作为载体携带外源性目的基因转染至宿主细胞中,通过将外源基因整合至宿主细胞基因上实现目的基因的长时间稳定表达。本研究通过观察慢病毒介导PEDF基因修饰的hUCMSCs蛋白质组学变化情况,探索慢病毒介导的PEDF基因修饰对细胞产生的影响。
本研究结果表明,慢病毒介导PEDF基因修饰后的hUCMSCs共有432个蛋白表达水平发生显著改变。其中SERPINF1,即PEDF显著上调,表明慢病毒介导的基因修饰实现hUCMSCs中PEDF过表达。DEAD-box家族RNA解旋酶参与转录、mRNA剪接、翻译起始、RNA转运和衰变等过程,在RNA代谢中发挥至关重要的作用[19]。本研究中,DEAD-box家族RNA解旋酶中的DDX59显著上调。研究表明,DDX59参与大脑发育,编码该蛋白的基因突变可导致中枢和外周神经系统发育受损[20]。目前,尚未有研究将DDX59应用于神经系统疾病的治疗,其是否可与PEDF协同发挥眼部神经保护作用有待进一步探索。上调蛋白THBS1在调节生理性和病理性血管生成中起关键作用,已有研究将其应用于肿瘤治疗,结果表明其可通过抑制肿瘤血管形成起到抗肿瘤作用[21]。另有研究发现,在化学性角膜灼伤中,移植的MSCs可通过旁分泌THBS1、白细胞介素(interleukin,IL)-10、转化生长因子-β(transforming growth factor-β,TGF-β)、IL-6等可溶性因子发挥抗炎和抗血管生成的治疗作用[22]。THBS1对眼部新生血管性疾病的治疗作用及其机制有待进一步研究。此外,研究证实THBS1可通过激活内源性TGF-β诱导MSCs增生,是MSCs重要的调节因子[23]。本研究结果表明,慢病毒介导PEDF基因修饰hUCMSCs后可引起THBS1表达水平升高,有望增强hUCMSCs抗血管生成和增生能力,协同PEDF发挥眼科疾病治疗作用。
细胞外基质为干细胞提供结构支持,参与干细胞功能调节的信号传导。研究表明,细胞外基质是MSCs多种生化和机械信号的储存库,这些信号可通过细胞表面受体-蛋白相互作用进行传导,进而影响细胞信号通路,改变细胞功能[24]。本研究结果显示,COL1A1与PEDF间相互作用较强,该蛋白与COL1A2、COL3A1和COL5A1等蛋白均为下调蛋白,参与细胞外基质结构组成,表明慢病毒介导PEDF基因修饰后的hUCMSCs中多个参与细胞外基质构成的蛋白表达水平发生显著改变,细胞功能可能由此受到明显影响。
研究表明,IGF系统在干细胞生物学中发挥重要作用,IGF可促进MSCs增生并减少其凋亡,促进MSCs自我更新和发挥多能性[25]。本研究表明,IGFBP调节的IGF运输和摄取通路明显上调,可增强hUCMSCs结合和摄取IGF的能力,从而优化自身功能。
综上所述,本研究结果显示慢病毒介导PEDF基因修饰的hUCMSCs中DDX59、THBS1表达水平升高,有望与PEDF发挥协同作用,应用于眼部新生血管性疾病及神经退行性病变的治疗。此外,COL1A1等细胞外基质构成相关蛋白表达水平的改变及IGFBP调节IGF运输和摄取通路的上调影响hUCMSCs的信号传导,优化细胞功能,提升其眼科临床应用价值。未来可依据本研究分析结果深入探讨,寻找慢病毒介导PEDF基因修饰hUCMSCs的治疗靶点,进一步探索慢病毒介导PEDF基因修饰的hUCMSCs在眼部新生血管性疾病治疗中的作用及机制。本研究为系列研究的一部分,整体研究周期较长,后续实验中我们将对质谱分析结果进行验证并对蛋白功能进行探索,进一步探讨慢病毒作为独立因素可能带来的影响。
利益冲突所有作者均声明不存在利益冲突
志谢感谢北京贝来生物科技有限公司刘拥军、刘广洋提供hUCMSCs细胞样本,为本研究的顺利开展做出重要贡献
