绒山羊毛囊生长规律及调控机制的研究进展
2021-10-21张嘉会于政权邓学梅
张嘉会,于政权*,邓学梅
(1.中国农业大学生物学院,农业生物技术国家重点实验室,北京 100193;2.中国农业大学动物科学技术学院,畜禽育种国家工程实验室,北京 100193)
哺乳动物的毛发由表皮分化产生,在昼夜或季节更替时可维持动物体温恒定,在日常活动中也可发挥感知及防护的功能。毛囊(Hair Follicle)是产生毛发的组织单元,对经济型哺乳动物毛囊生长发育进行的持续研究推动了动物纤维生产领域的发展。其中,羊绒作为一种比羊毛更加纤细柔软且具有高保温效果的动物纤维,是重要的世界性经济产物之一。羊绒的主要产地在中国,目前,中国绒山羊种类主要包括内蒙古绒山羊、辽宁绒山羊、陕北绒山羊、河西绒山羊和柴达木绒山羊[1],羊绒总产量高且品质优良[2]。
绒山羊皮肤中的毛囊分为初级毛囊(Primary Hair Follicle)和次级毛囊(Secondary Hair Follicle),其生长具有周期性循环的特点,不断重复经历快速增殖的生长期(Anagen)、细胞凋亡控制的退化期(Catagen)和稳定静息状态的静止期(Telogen)[3]。初级毛囊产生长而粗的有髓质羊毛纤维,主要起到保护作用;次级毛囊产生短而细的无髓质羊绒纤维,具有高强度保温能力[4]。绒山羊的次级毛囊经历一个完整的生长周期大约需要1年,已有大量研究显示,其生长周期除了受到环境或营养等因素的影响外,主要由季节性光照导致血清中褪黑素水平波动进行调控[5]。但目前,在基因水平上解析绒山羊次级毛囊周期性生长的调控机制,还需进一步探究。
本文介绍了绒山羊毛囊的结构特点和生长规律,总结了褪黑素对羊绒产量的影响,并综述了近年来在对调控绒山羊毛囊生长发育的基因筛选、部分lncRNA 的调控作用机制以及对绒山羊进行基因编辑以改善羊绒产量与品质的研究,为进一步促进我国羊绒产业发展提供一定参考。
1 绒山羊毛囊的结构特点
不同种类哺乳动物的被毛形态差异很大,但其毛囊结构较为一致[6]。如图1 所示,毛囊由多种细胞层以同心圆状排列组成,最外层为结缔组织鞘,其可将毛囊与真皮分隔开。结缔组织鞘向内依次为外根鞘(Outer Root Sheath,ORS)、内根鞘(Inner Root Sheath,IRS)、毛干(Hair shaft,SH),其中内根鞘包含4 种细胞层,由外至内依次为伴生层、Henle 层、Huxley 层以及内根鞘角质层;毛干包含3 种细胞层,由外至内依次为毛干角质层、皮质层、髓质层[7]。毛囊下部结构被称为毛球(Hair Bulb),为突出的椭圆形增厚结构,包含未分化的基质细胞(Matrix Cell)和黑色素细胞(Melanocytes)。毛囊最下方是真皮乳突(Dermal Papilla),由一群紧密排列的间充质细胞组成,通过向上传递信号来确定毛干的大小、形状、黑色素生成及沉积,对于毛干的形态发生起着重要的引导作用[8]。
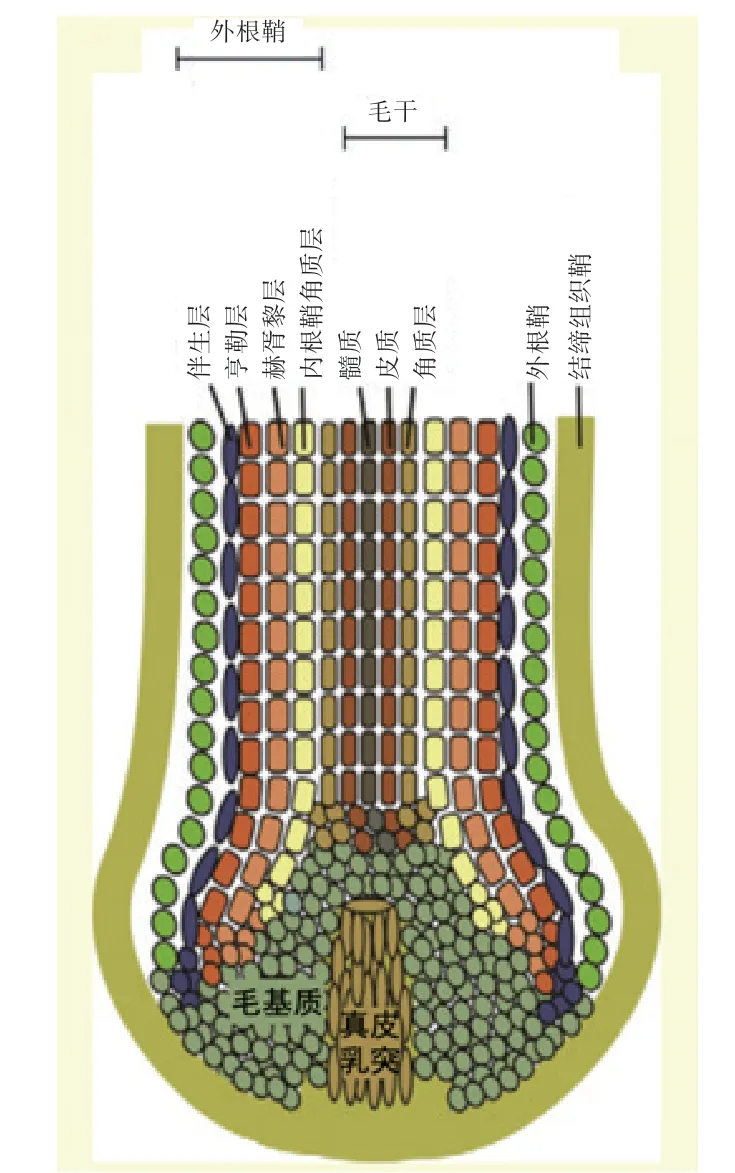
图1 毛囊细胞层排布示意图[7]
毛囊上部结构在生长周期内维持静态,主要包含漏斗管(Infundibulum)、峡管(Isthmus)、皮脂腺(Sebaceous Gland)和隆突区(Bulge)。漏斗管开口向上延伸至皮肤表面,隆突区位于皮脂腺下方与远端外根鞘的交汇处,是毛囊干细胞(Hair Follicle Stem Cells,HFSCs)所在区域[9]。在退化期,毛囊形态会发生显著变化,其下部结构随着细胞凋亡而不断皱缩,毛囊总长度不断减小,真皮乳突逐渐裸露在毛球之外。凋亡持续发生直至隆突区附近时停止,基质细胞和内根鞘完全消失,外根鞘形成新的次级毛胚芽(Secondary Hair Germ,SHG)和隆突区结构[10],而旧隆突区中仍会储存一部分干细胞,参与毛囊的损伤修复。此时退化期结束,毛囊会以这个形态度过静止期,进入新的生长期,开始毛囊的再生过程(图2)。

图2 毛囊不同生长时期的结构对比[11]
2 绒山羊毛囊的生长及其调控因素
夏至后日照时间缩短,此时次级毛囊进入生长期,时间为8—11 月;冬至后日照时间不断延长,次级毛囊进入退化期,羊绒逐渐停止生长,时间为12 月至次年2 月;3—7 月时次级毛囊处于静止期,此阶段羊绒发生脱落[12-13]。季节性光照变化导致绒山羊体内褪黑素的分泌发生波动,可通过调节绒山羊血清中褪黑素浓度变化,从而调控羊绒周期性生长。
2.1 褪黑素可调控绒山羊毛囊周期性生长 褪黑素(n-乙酰-5-甲氧基色胺)是一种高度保守的吲哚,主要由松果体产生,在调节哺乳动物生理周期、青春期发育、季节性适应等生理功能中发挥重要作用[14]。褪黑素受体1 型(MT1)和褪黑素受体2 型(MT2)为细胞膜受体,类视色素相关的孤核激素受体(RZR/ROR)为核受体,这两类受体均属于具有高亲和力的G 蛋白偶联受体。褪黑素主要通过上述受体发挥其生物学功能[15]。已有研究显示,对成年绒山羊使用外源褪黑素可以刺激羊绒在非生长期生长,但会导致其提前脱落,因此限制了褪黑素在羊绒生产中的实际应用[16-17]。而在春夏两季以皮下埋植的方式使用褪黑素则可衔接次级毛囊的自然生长期,在不影响绒山羊繁殖性能的情况下增加产绒量,同时可提升绒毛纤维细度[18]。褪黑素对毛囊生长周期的调控作用具有物种差异性、性别差异性以及剂量依赖性[19]。对褪黑素处理过的绒山羊进行长期研究显示,褪黑素可提升羊绒纤维的重量、长度和密度,同时缩减了纤维直径,但只在该生长周期起作用,而对下个周期没有持续影响[20]。研究还发现,褪黑素可提前激活次级毛囊进入生长期,并增加绒山羊皮肤中活跃次级毛囊的数量,从而提升羊绒产量[20]。
褪黑素可通过影响催乳素(PRL)分泌来影响绒山羊毛囊的生长[21],其能够抑制毛球角质形成细胞增殖来促使毛囊提前进入退化期[22]。另外,催乳素受体的表达与毛囊生长周期一致[23],当光照时间增加时,催乳素浓度上升,诱导羊绒脱落;当光照时间缩短,催乳素浓度相应降低,促进羊绒生长[24-25]。此外,褪黑素也可通过胰岛素样生长因子(IGF)、血小板衍生生长因子(PDGFA)等细胞因子调控绒山羊毛囊的周期性生长[22]。
2.2 调控绒山羊毛囊生长发育的基因筛选 羊绒产量问题一直是限制羊绒市场持续扩大的重要原因[26]。探究绒山羊不同生长周期内差异性表达基因(Different Expression Gene Set,DEGs)的功能和作用机制,对阐明羊绒生长调控具有重要作用。因此,寻找调控绒山羊SHF 的基因及通路成为此领域的研究热点。
通过对绒山羊毛囊进行二代测序、DEGs 筛选及通路分析,绒山羊毛囊周期性生长的分子调控机制被逐渐揭示。有研究发现,KAP3-1、KRTAP 8-1和KRTAP 24-1基因与羊绒生长周期正相关,其调控规律与羊绒生长周期一致[27];在内蒙古绒山羊次级毛囊中发现FGF5、FGFR1和RRAS基因可影响内蒙古绒山羊毛囊的生长发育[28];MAPK、PI3K-Akt、Ras 及Rap1 等信号通路在绒山羊毛囊生长周期过程中发挥重要的调控作用[29]。此外,K4 蛋白和铜蓝蛋白在毛囊的生长周期内阶段性表达,其中K4 在毛囊生长期初期高水平表达,而在退化期几乎不表达,可以作为指示羊绒生产起始与结束的标记,从而确定羊绒采收的最佳时间,提高羊绒产量[30]。最近,Jin 等[31]利用SNP 芯片对优秀产绒品种内蒙古绒山羊、辽宁绒山羊与非产绒品种的黄淮山羊进行基因分型检测,从众多候选基因中筛选出WNT10A和CSN3可能参与羊绒生产;Tβ4、ARHGAP6、SHF-DPCs与绒山羊SHF 的生长发育密切相关,其中Tβ4可以促进羊绒生长发育,是提高羊绒产量的一个潜在靶点[32],并筛选出了Tβ4、ARHGAP6、ADAMTS15、CHRD、SPARC、SPOCK1等作为提高羊绒性能的关键候选基因。由此可见,绒山羊的毛发生长周期受到多种基因的调控,是个复杂的生物学过程。
2.3 非编码RNA 对绒山羊毛囊生长发育的调控作用在对绒山羊毛囊的测序及转录组分析的研究中显示,miRNA 不仅在绒山羊胚胎毛囊的形态建成中起着关键作用[33],也可促进绒山羊次级毛囊生长[34]。miRNA 是一类长度为20~24 nt 的内源lncRNA[35]。已有研究显示,miR-203、miR-31、miR-196a、miR-195 等miRNA 与毛囊的生长发育相关[36-40],涉及Wnt、BMP 等多种信号通路的调控。另外,Zhang 等[41]筛选出chi-miR-150、chimiR-151-5p、chi-miR-196a、chi-miR-196b、chi-miR-30b-5p、chi-miR-9-5p 6 个miRNA 与绒山羊毛囊生长周期调控密切相关,并发现Chi-miR-30b-5p 在静止期高表达,可通过靶向CaMKIIδ 抑制DP 细胞增殖。除miRNA 外,circRNAs 也可能在绒山羊次级毛囊的生长中发挥调节作用,有研究发现,circRNA-1926 可通过作用于miR-148a/b-3p 来增强CDK19 的表达,从而促进绒山羊SHF 干细胞的分化[42]。
2.4FGF5对羊绒纤维长度的影响 FGF 是成纤维细胞生长因子,FGF5在哺乳动物毛囊生长中具有重要功能,是人类毛发生长的关键调节因子,可诱导毛囊退化[43]。在多种哺乳动物的研究中发现,FGF5能够抑制毛囊细胞的增殖和分化,参与调控毛发的长度性状[44-47]。绒山羊次级毛囊的毛干长度与羊绒的产量密切相关,其次级毛囊生长期持续时间越长,毛干长度越长,因此羊绒产量也越高。FGF5 受体(FGFR1)在绒山羊皮肤初级毛囊和次级毛囊的真皮乳突细胞中均有表达[48],FGF5突变后,毛囊细胞持续增殖分化导致毛囊延缓进入静止期,从而可显著增加羊绒纤维长度。绒山羊FGF5的5'-UTR 中1 个新SNP 的等位基因频率与短毛山羊存在很大差异,该位点突变引入了1 个起始密码子,导致FGF5 蛋白提早编码,这可能是导致绒山羊长毛表型的自然突变[49]。
随着CRISPR/Cas9 技术的诞生,许多研究对多个品种羊进行了基因编辑,希望从根源上实现对产绒山羊品种的改良。Wang 等[50]验证了CRISPR/Cas9 系统在大型动物模型中的适用性和有效性,实现对山羊FGF5和MSTN2种功能基因的同步编辑[51],并制造出长毛且SHF 数量增多的FGF5基因修饰山羊;Li 等[52]成功制造了FGF5s异位表达的转基因绵羊共20 只,在存活的12 只转基因绵羊中均观察到FGF5s的异位表达,且毛长明显长于非转基因对照。Zhang 等[53]鉴定了羊属FGF5(oFGF5)基因序列,利用CRISPR/Cas 系统成功构建了FGF5 敲除绵羊,进一步揭示了FGF5调控毛囊发育的进化生物学及结构生物学特性。这些研究为产绒品种羊的优化改良提供了思路,为羊绒产业的持续扩大奠定了基础。
3 结 语
羊绒是一种保温效果优秀的动物纤维,由绒山羊的次级毛囊产生,通过延长次级毛囊的生长期、缩短静止期,可以提升产绒量。大量研究表明,使用褪黑素可提升羊绒纤维的质量指标,并增加绒山羊皮肤中活跃次级毛囊的数量,从而提升羊绒产量。但褪黑素的效果维持时间短,且在使用中存在诸多不确定因素,导致无法从根源上稳定改善产绒。因此,近年来,许多研究致力于揭示提高羊绒产量潜在基因靶点,筛选出了FGF5、Tβ4、KAP3-1等关键调控基因,并发现众多LncRNA参与绒山羊次级毛囊的调控过程。目前已有研究人员对多种绒山羊及绵羊进行基因编辑,这些研究的积累为产绒及产毛羊品种的不断优化奠定了基础,为进一步扩大羊绒生产规模提供了借鉴,具有重要科学意义。
