DHA 对动物脂代谢的调控作用及其在畜牧生产中的应用研究进展
2021-10-21黄超勇张海波张进明黎力之廖晓鹏关玮琨郭冬生
黄超勇,张海波,张进明,黎力之,廖晓鹏,袁 安,关玮琨*,郭冬生*
(1.宜春学院生命科学与资源环境学院,江西省高等学校硒农业工程技术研究中心,宜春学院继续教育学院,江西宜春 336000;2.江西省养蜂研究所,江西宜春 336000)
二十二碳六烯酸(Docosahexaenoic Acid,DHA)含22 个碳原子和6 个双键,因其第1 个双键位于甲基末端起第3 个碳原子上,属于n-3 系列多不饱和脂肪酸[1]。DHA 可以促进动物胰高血糖素样肽1(Glucagon-likr Prptide-1,GLP-1)合成释放,一方面激活磷酸腺苷激活蛋白激酶(AMP-activated Protein Kinase,AMPK)通路,降低乙酰辅酶A 羧化酶(Acetyl CoA Carboxylase,ACC)、脂肪酸合成酶(Fatty Acid Synthetase,FAS)、硬脂酰辅酶A 去饱和酶-1(Stearly Coenzymea Desatu rase-1,SCD-1)等脂肪合成酶活性,减少脂肪沉积[2];另一方面还可上调脂解酶表达水平,抑制载脂蛋白合成,加速清除血浆中甘油三酯(Triglyceride,TG),促进脂肪分解[3-4]。此外,DHA 通过阻碍蛋白激酶B(Protein Kinase B,PKB/Akt)磷酸化,抑制磷脂酰肌醇-3 激酶(Phosphatidylinositol 3-Kinase and Protein Kinase B,PI3K-Akt)信号通路,阻碍核因子-кB 抑制蛋白α(Inhibitor-αof Nuclear Transcription FactorκB,IκBα)及IкK(Inhibitor Kappa kinase,IкK)磷酸化过程,调节核因子κB(Nuclear Factor Kappa-B,NF-κB)通路,降低下游肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)分泌,抑制锚定于脂滴表面的生理屏障Penlipin 蛋白表达,阻碍脂肪细胞分化,调控脂代谢[5-7]。且DHA 通过抑制NF-κB 活性,降低COX-2基因及黏附分子表达水平,减少细胞膜磷脂质中花生四烯酸和二十烷类物质等促炎因子表达,调节动物生理状态,促进脂肪代谢[8]。目前,较缺乏DHA 通过调控AMPK 和NF-кB 通路来影响动物脂代谢方面的系统综述。本文就DHA 对动物脂代谢调节机制和其在畜牧生产中的研究现状进行阐述,以期为DHA 在畜禽生产中的应用提供理论依据。
1 DHA 概述
1.1 DHA 来源与合成 DHA 主要由海洋细菌和微藻合成,通过水生食物链,在海洋鱼类脂质中积累[9]。DHA 产生菌包括从极地地区和深海中分离出的嗜冷菌和嗜压菌,也有从河口和浅海中分离的中温菌,主要是革兰氏阴性菌,如希瓦氏菌、莫拉克斯氏菌和科尔韦尔氏菌等[10]。而在商业生产中,隐甲藻、裂殖壶菌和金棘藻等微藻已成为获得DHA 的主要来源[11-13]。在DHA 的生物合成途径中,α-亚麻酸在Δ6 去饱和酶作用下形成十八碳四烯酸,再由延伸酶5 延伸形成二十碳四烯酸,在Δ5 去饱和酶作用下形成二十碳五烯酸(Eicosapentaenoic Acid,EPA),EPA 经延伸酶5 和延伸酶2 作用形成二十二碳五烯酸(Docosapentaenoic Acid,DPA),DPA 在延伸酶2 作用下得到二十四碳五烯酸,经Δ6 去饱和酶作用形成二十四碳六烯酸,最后在过氧化物酶作用下β-氧化形成DHA[14-15]。
1.2 DHA 功能 DHA 不仅能参与机体免疫,抗氧化损伤,还对调控机体能量代谢具有重要作用[16]。研究发现,DHA 通过激活Akt 信号通路,抑制白细胞介素1(Interleukin 1,IL-1)、TNF-α、NF-кB 等炎性因子,从而发挥促进机体免疫的作用[17]。Flaga 等[18]分别以0、9、18、27 g/d DHA-RA(DHA 海藻)饲喂犊牛14 d 后,发现随饲粮中DHA 添加水平的提高,IL-1 含量显著降低,TNF-αmRNA、NF-кBp65mRNA 表达水平呈线性下降。Geng 等[19]用DHA 处理小鼠初级小胶质细胞后,发现超氧化物歧化酶(Superoxide Dismutase,SOD)活性显著提高,细胞中血红素氧合酶1 水平显著上升,机体内抗氧化基因表达上调,动物抗氧化损伤作用增强。研究表明,对创伤性脑损伤大鼠给予DHA 治疗,其皮质丙二醛含量、谷胱甘肽过氧化酶活性、SOD 活性恢复,血红素加氧酶活性提高,核因子E2 相关因子2 表达上调,缓解机体氧化应激[20]。DHA 还可通过抑制氧化固醇与肝X 受体(Liverxreceptorα,LXRα)结合,降低胆固醇调节元件结合蛋白(Sterol Regulstory Elementbinding Protein,SREBP)转录水平,下调ACC、FAS、SCD-1等基因表达调控脂代谢[21-22]。以LXRα激动剂处理小鼠原代肝细胞后,较对照组相比,SREBP-1、FAS、ACC基因表达水平显著上调,后以DHA 处理该细胞24 h,SREBP-1、FAS、ACC水平均显著降低[23]。
2 DHA 通过AMPK 和NF-кB 通路调控动物脂代谢
2.1 DHA 介导AMPK 信号通路调控脂代谢 DHA通过激活GPR120 促进GLP-1 合成释放,同时上调AMPK、PPARα表达,抑制脂肪合成,促进脂解。研究发现,给予小鼠0.10 mL 500 μg/kg DHA 后,结肠中G蛋白偶联受体120(G-protein Coupled Receptor 120,GPR120)表达水平提高,GLP-1 分泌量显著升高[24]。GLP-1 具有降低血浆中三酰甘油脂蛋白-载脂蛋白B-48浓度,激活脂解酶并抑制载脂蛋白合成,加速TG 清除及脂肪降解。GLP-1 可激活AMPK,抑制ACC 磷酸化,促进成熟脂肪细胞降解[25]。Morishita 等[26]试验发现,雄性小鼠腹腔注射60 nmol/100 μL DHA 5 min 后,血浆中GLP-1 浓度显著提高,15 min 后DHA 组GLP-1浓度达到峰值21.60 nmol/100 μL,较对照组提高13.30 nmol/100 μL;结肠中GLP-1 浓度的上升伴随小鼠脂肪细胞对胰岛素敏感性增强,基础胰岛素同比增长0.88 pmol/(kg·min),肝脏中AMPK、PPARα表达水平显著提高,脂解增强,脂肪含量降低。另外,利用0、0.15、0.30、0.45 mmol/L DHA 处理牛肝细胞后,随DHA 浓度增高,在AMPK 上游通路中,肝脏激酶B1(Liver Kinase B1,LKB1)表达水平提高,AMPKα活性显著增强[27]。对肥胖胰岛素抵抗小鼠补充DHA 后可恢复PPARα-AMPK-LKB1 水平,且在DHA 与抗氧化剂羟基酪氨酸联合饲喂时完全恢复,同时,AMPK 磷酸化的增加导致ACC 抑制和丙二酰辅酶A(Malonyl-CoA,MCA)耗竭,机体脂肪合成降低[28]。
在AMPK 下游通路中,AMPKα磷酸化可降低SREBP-1 和碳水化合物反应元件结合蛋白转录水平,下调FAS、ACC及硬脂酰辅酶A 去饱和酶(Stearoyl Coenzyme A Desaturase,SCD-1)基因表达,减少脂肪合成[29]。研究发现,经DHA 处理小鼠原代肝细胞12 h后,在AMPK 下游通路中,SREBP-1 前体蛋白水平降低,FAS、ACC、SCD-1表达显著下调[30]。利用DHA 微藻粉(含DHA 10.3%)饲喂肉仔鸡1 周后,DHA 处理组日增重提高13.13%,耗料增重比降低14.08%;饲喂2 周后,DHA 处理组较对照组血液中ACCmRNA 表达量降低68.63%,停饲DHA 1 周后,处理组中ACCmRNA表达量降低38.24%[31]。总 之,在DHA 调 控AMPK 通路中,一方面,DHA 通过激活GPR120 提高GLP-1 合成释放,促进AMPKα磷酸化,抑制动物机体内ACC、FAS、SCD-1 等多种脂肪合成酶的活性;同时,提高GLP-1 水平可促进PPARα、过氧化物酶酰基辅酶A 氧化酶2 和长链脂酰辅酶A 脱氢酶等mRNA 表达,加速脂肪氧化分解。另一方面,随DHA 摄入增加,LKB1 活性提高,增强AMPKα活性,抑制ACC,促进MCA 损耗,抑制脂肪合成,调控脂代谢(图1)。
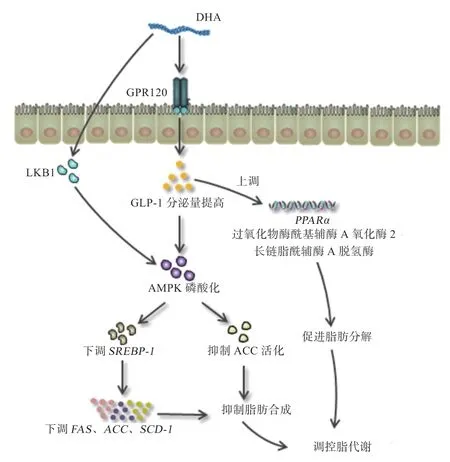
图1 DHA 介导AMPK 信号通路调节动物脂代谢
2.2 DHA介导NF-κB通路调控脂代谢DHA一方面阻碍Akt 磷酸化,抑制PI3K-Akt 信号通路,使NF-κB p65mRNA 表达下调,减弱NF-κB 通路活性。研究发现,以40 μmol DHA 处理大鼠脑星型胶质细胞0~10 min 后,Akt 磷酸化水平逐渐减弱,表明DHA 可显著阻碍Akt激酶磷酸化[32]。对LPS 刺激后的仔猪饲喂100 mg/kg含5% DHA 鱼油4 h 后,腓肠肌肌肉中Akt 和FOXO1蛋白质磷酸化及丰度显著降低,NF-κB p65mRNA 表达水平下降,NF-κB 通路活性减弱,其下游TNF-α分泌减少,仔猪肌肉中蛋白质浓度增高,腓肠肌肌肉萎缩恢复[33]。另一方面,DHA 还可抑制IκK 活性,使NF-κB活化关键因子IκBα磷酸化受阻,阻碍NF-κB 通路激活。利用含25 μmol/L DHA 的5% 胎牛血清培养基培养小胶质细胞24 h 后,DHA 处理组TLR4 表达水平增高,IκK 磷酸化受抑制,IκBα表达水平下降,显著降低NF-κB 通路下游TNF-α、IL-6 释放量[37]。沈云海等[34]利用DHA 干预大鼠肝脏中NF-κB 通路及其下游细胞因子TNF-α的mRNA 表达水平发现,TNF-α含量较对照组下降26.92%。TNF-α分泌量降低可以下调同源异形盒基因Msx2 表达,使Wnt/β-catenin 信号通路活性降低,作为脂肪酸转运蛋白和脂肪酸转运酶基因的关键因子——过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator-activated Receptorγ,PPARγ)表达上调,加快细胞对脂肪酸摄取利用,促进脂解[35]。且TNF-α水平下降还可下调SREBP-1表达,降低FAS 分泌量,抑制脂质合成[36]。
此外,NF-κB 通路活性下降常伴随其下游COX-2基因表达水平降低,抑制花生四烯酸代谢,减少细胞膜磷脂质中花生四烯酸和二十烷类物质等促炎因子表达,降低脂肪因子(Fasting-induced Adipose Factor,Fiaf)分泌量,阻碍脂蛋白脂肪酶(Lipoprotein Lipase,LPL)抑制因子合成,促进脂肪降解[38]。研究发现,分别以0、10、40 μmol/L DHA 处理雄性大鼠,发现脑血管生成素-2、内皮生长因子表达显著下调,抑制COX-2表达,并随DHA 添加量增大,COX-2 蛋白分泌量逐渐降低[39]。Leyre 等[40]发现,利用富含DHA 的鱼油以5 g/d 饲喂大鼠24 d 后,LPL 活性显著提高,机体脂沉积向氧化转变,脂肪含量降低。综上所述,DHA 通过阻碍Akt 和IκBα磷酸化,抑制NF-κB 通路活性,下调其下游细胞因子TNF-α表达水平,不仅可以通过下调Msx2表达来抑制Wnt/β-catenin 通路,促进PPARγ表达,加速脂解,还具有下调SREBP-1表达、降低FAS 分泌量、抑制脂肪合成的作用。NF-κB 通路活性下降还可降低COX-2基因表达,减少Fiaf 分泌,抑制LPL 抑制因子合成,促进脂肪降解,调节动物机体脂代谢(图2)。
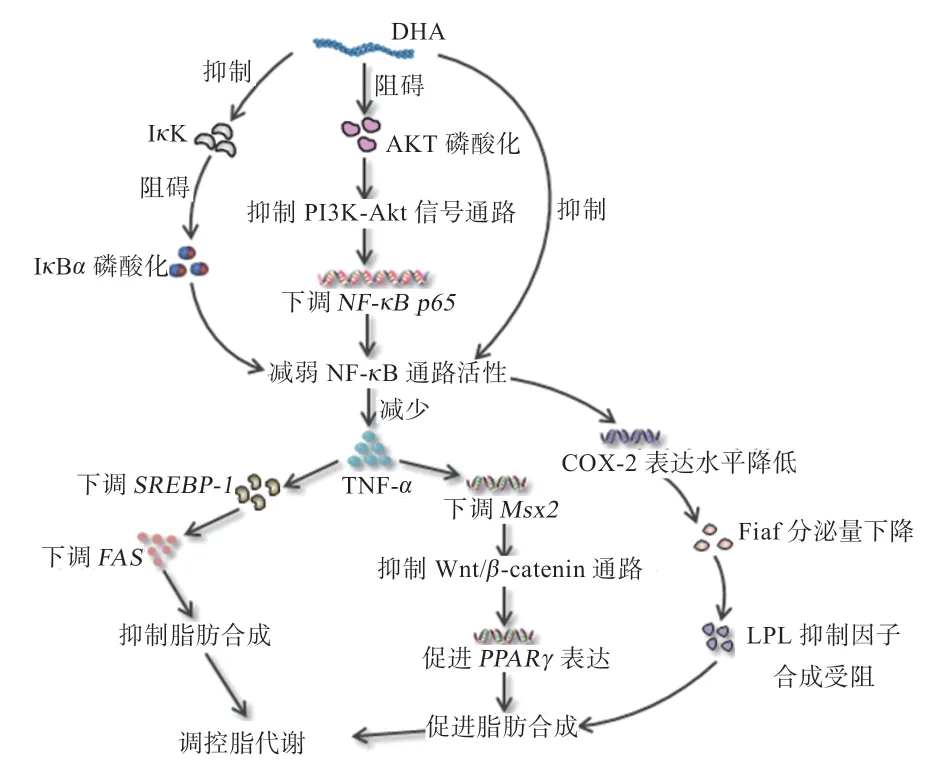
图2 DHA 介导NF-кB 信号通路调节动物脂代谢
3 DHA 在畜牧生产中的应用
DHA 在畜牧生产实践中发挥着重要作用,具体应用见表1。

表1 DHA 在畜牧生产实践中的应用
3.1 畜禽动物 在饲粮中添加DHA 可激活葡萄糖转运基因,促进肠道对葡萄糖的消化吸收,提高机体多种代谢酶活性,加速仔猪生长,降低体脂率,还可提高肉鸡饲料利用率,并能改善反刍动物精液产量和质量,增强种畜繁殖性能。Gabler 等[41]发现,在妊娠母猪日粮中添加160 mg/d DHA 后,母猪所产仔猪的葡萄糖转运基因SGLT1、GLUT2表达上调,仔猪空肠内外葡萄糖含量约增加4 倍,显著促进肌糖原合成水平,提高断奶仔猪日增重。仔猪饲喂添加富含 DHA 日粮后,显著增加了血浆中天门冬酰胺、谷氨酰胺、β-丙氨酸等氨基酸浓度,脑、肝脏中三磷酸鸟苷环化水解酶、还原性辅酶Ⅱ和四氢生物蝶呤等活性均显著增强,可调节仔猪肝脏、肌肉和血浆中氨基酸组成,加快机体代谢,提高仔猪生长速率[42]。利用152.6 g/kg DHA 饲喂生长猪28 d 后,皮下脂肪及腰部DHA 含量上升,胰岛素样生长因子-1(Insulin-like Growth Factors -1,IGF-1)mRNA 水 平显著提高,促进骨骼肌蛋白形成,促进动物生长[43]。肉鸡饲喂含37 g/kg DHA 饲粮14 d 后,与对照组相比,肉鸡的平均采食量提高251 g,肌肉脂肪含量降低44%,肉鸡平均体重增加319 g,并提高了饲料转化率[44]。此外,利用103 g/kg DHA 饲喂荷斯坦奶牛63 d 后,采精量增加3.04 mL,精子浓度提高0.21×109/mL,精子渐进运动率和活力分别增加4.28%、2.99%,精子异常率下降5.49%,解冻后较对照组精子渐进运动率和活力分别增加4.07%、7.06%,可改善动物繁殖性能[45]。综上可知,DHA 可显著上调机体IGF-1及葡萄糖转运基因SGLT1、GLUT2表达,促进动物对蛋白质及葡萄糖的吸收转化,提高淀粉酶及肠道蛋白酶等多种酶活性,同时影响机体脂肪合成,改善动物生产性能;摄入适量DHA 可改善反刍动物精液产量和质量,增强精子渐进运动及精子活力,降低精子异常率,还可显著恢复解冻后精子活力,并对母畜生殖器官的生长发育、卵子受精率、孵化率及幼龄动物存活率也具有积极作用,增强动物繁殖性能。
3.2 水产动物 在饲粮中添加DHA 可提高水产动物肠道营养吸收和生长性能,并能促进繁殖相关细胞及器官成熟,提高动物繁殖力及幼苗存活率。研究发现,以8、10、12、16、20 g/kg DHA 藻 油(含DHA 50%)饲喂中华鳖稚鳖,随饲料中DHA 水平增加,胃淀粉酶活性显著升高,当饲料DHA 水平为12 g/kg 时,胃淀粉酶活性达到峰值284.80 U/g prot,中华鳖稚鳖增重率达到最大值379%,粗蛋白质消化率最大值为64.8%,较对照组提高16.12%[46]。由此表明,饲粮中添加1.2%DHA 时可显著提高中华鳖稚鳖粗蛋白消化率,促进机体生长发育。利用1.00% DHA 藻粉(含DHA6.5 g/kg)饲喂鲤幼鱼14 d 后,SOD、过氧化氢酶、谷草转氨酶活性均分别提高14.89%、1.19%、1.97%,较对照组增重15.13 g[47]。Sophie 等[48]研究发现,DHA 为鱼类性腺磷酸甘油酯中磷脂酰胆碱和磷脂酰乙醇胺的重要组分,对鱼类生殖细胞活力及生殖器官发育成熟具有积极作用。研究发现,以14.10 g/kg DHA 饲喂西伯利亚鲟鱼幼苗后,繁殖力增长11.60 g/kg,受精率、孵化率及幼苗存活率分别提高22.65%、10.90%、14.43%[49]。总之,饲粮中添加DHA 可促进水产动物胃淀粉酶、过氧化氢酶、谷草转氨酶等多种酶活性,提高粗蛋白质消化率,加快水产动物生长速率,改善动物生产性能。此外,摄入适量DHA 可提高鱼类性腺磷酸甘油酯含量,促进性腺发育成熟,并对水产动物孵化率及幼苗存活起显著积极作用。
4 小结与展望
DHA 调 控AMPK 和NF-кB通路参与动物机体脂代谢调节:①DHA 通过激活GPR120 提高GLP-1 合成释放,促进AMPKα磷酸化,抑制SREBP-1表达,调控动物机体内ACC、FAS、SCD 等多种脂代谢酶的活性;DHA 还可提高LKB1 活性,上调AMPKα表达,抑制动物机体内ACC 活化,减少脂肪合成;同时,DHA 可提高GLP-1 水平,上调PPARα表达,促进过氧化物酶酰基辅酶A 氧化酶2、长链脂酰辅酶A 脱氢酶等脂肪酸β氧化相关mRNA 表达,加速脂肪氧化分解。②DHA 不仅阻碍Akt 和IκBα磷酸化,还可直接作用于NF-κB 活化关键因子IкBα,使其磷酸化受阻,共同抑制NF-κB 通路,降低下游细胞因子TNF-α表达。TNF-α水平降低一方面可下调Msx2表达,抑制Wnt/β-catenin 通路,促进PPARγ磷酸化,加速脂解;另一方面,还可使SREBP-1表达下调,降低FAS 分泌量,抑制脂肪合成。此外,DHA 抑制NF-κB 通路活性还下调COX-2基因表达,抑制Fiaf 分泌,阻碍LPL 抑制因子合成,促进脂解。目前,DHA 在维护动物机体健康、调控动物机体脂代谢、改善畜禽生产繁殖性能中有重要作用。但对于如何快速稳定合成DHA、DHA 是否参与更多细胞因子调控脂代谢等问题尚未明确,并且DHA在畜牧生产中对改善畜禽生产、繁殖性能的具体应用较少,还需进一步探究。
