全自动核酸血液筛查系统COBAS S201 标本离心时限和检测时限的性能验证
2021-10-20于艳涛刘志泉陈永飞李交蒋燕梁丽雯
于艳涛,刘志泉,陈永飞,李交,蒋燕,梁丽雯
佛山市顺德区中心血站 (广东佛山 528300)
相较于酶联免疫吸附试验,核酸检测可以大幅度缩短检测窗口期,降低经输血传播疾病的残余风险,提高血液筛查的安全性[1]。根据我国《卫生事业发展“十二五”规划》的要求,采供血机构应实现“到2015年底,血液筛查核酸检测基本覆盖全国”的工作要求,目前,国内多数采供血机构基本实现了核酸检测的全覆盖,使核酸检测系统在献血者血液筛查中得到广泛应用,而检测系统运行状态的好坏将直接影响血液检测的结果和质量。《血站质量管理规范》中即提出了对于新设备或其使用过程中的变化,应建立和实施确认程序,以保证设备在正式使用前符合预期的使用要求[2]。目前,虽然行业标准和指南中明确指明初装机时需对核酸检测系统进行性能验证,但未指明具体验证方法[3]。结合本实验室实际工作的需要,本研究总结了将罗氏核酸检测系统应用于本实验室血液筛查的离心时限和检测时限的确认内容和确认方法,旨在为中小采供血单位顺利开展核酸检测提供参考,现报道如下。
1 材料与方法
1.1 材料
1.1.1 设备
Hamilton STAR全自动混样仪(瑞士);COBAS Ampliprep全自动核酸分离纯化仪(瑞士);COBAS TaqMan全自动医用PCR分析系统(瑞士);Hettich 460R低温高速离心机(德国);Heal Force HF safe 900生物安全柜(上海力康)。
1.1.2 试剂与耗材
COBAS TaqScreen MPX 二代检测试剂盒(MPX v2.0),批号215559;清洗液,批号Y04719;以及罗氏配套原装进口耗材。
1.1.3 标本
全血标本:来源于顺德区中心血站无偿献血者,使用非可替乙二胺四乙酸二钾(dipotassium dihydrogen ethylenediaminetetraacetate,EDTA-K2)核酸分离胶试管(批号A170838B)留取8 ml 静脉血。
阳性样本与第三方质控:来源于北京康彻思坦生物乙型肝炎病毒(hepatitis B virus,HBV)DNA 标准物质,浓度水平50 IU/ml(批号201709006);丙型肝炎病毒(hepatitis C virus,HCV)RNA 标准物质,浓度水平200 IU/ml(批号201708007);人类免疫缺陷病毒(human immunodeficiency virus,HIV)RNA标准物质,浓度水平1 000 IU/ml(批号201709007)。
阴性样本:来源于已检测无反应性的无偿献血者标本。
1.2 方法
根据罗氏COBAS S201 v2.0试剂说明书中的检测(单检)灵敏度,计算我们日常检测(6混样)3个检测限的灵敏度,见表1。

表1 核酸检测试剂的灵敏度(IU/ml)
1.2.1 标本离心时限的性能验证
根据表1计算浓度,用康彻思坦HBV DNA、HCV RNA及HIV RNA 标准物质分别与献血者新鲜全血标本稀释至3个检测限的相近浓度(表2),充分混匀后分别在4 h、24 h、3 d 内离心后立即检测。
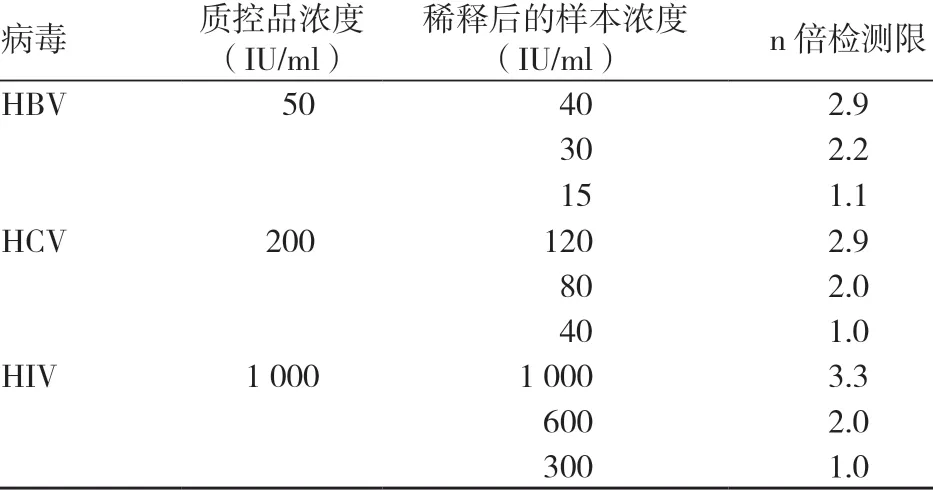
表2 标本稀释方案
以上每个浓度样本均留取相同3支分别与5支已知阴性的样本随同日常标本进行6混样检测;稀释用献血者标本经立即离心后随同日常标本进行6混样检测。
1.2.2 标本检测时限的性能验证
根据表1计算浓度,用康彻思坦HBV DNA、HCV RNA及HIV RNA 标准物质与献血者新鲜全血标本(EDTA-K2核酸分离胶试管)稀释至3个检测限的相近浓度(稀释方案同表2),每个浓度样本均留取相同3支,充分混匀后立即离心,分别在24 h、3 d、5 d 和7 d 内检测。
1.3 统计学处理
采用SPSS 22.0统计软件对数据进行多因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 标本离心时限的性能验证结果
3个检测限浓度的样本分别进行4 h、24 h、3 d 内的离心检测,全部结果均呈反应性,同浓度3支标本的检测结果均值见表3。经多因素方差分析,不同离心时限间HBV DNA 的循环阈值(cycle threshold,CT 值)比较,差异无统计学意义(F=0.517,P=0.631);不同离心时限间HCV RNA 的CT 值比较,差异无统计学意义(F=2.669,P=0.184);不同离心时限间HIV RNA 的CT 值比较,差异无统计学意义(F=0.089,P=0.917)。
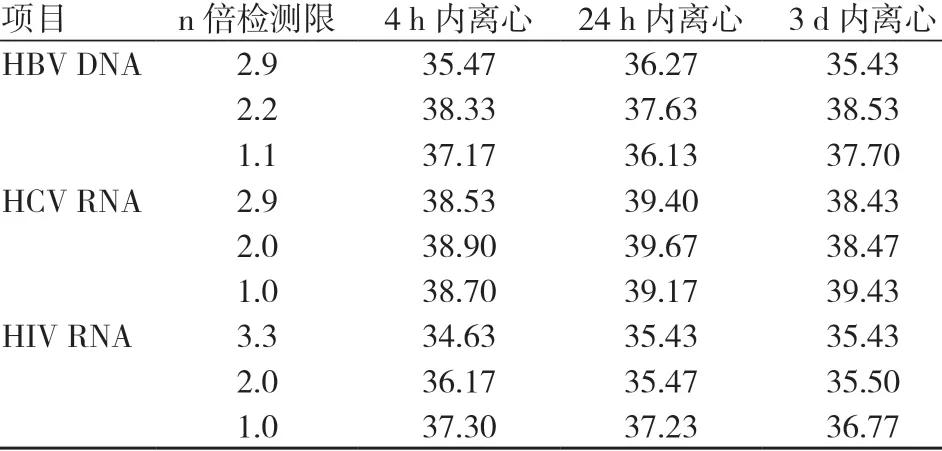
表3 不同时间段的离心检测结果(CT 值) (n=3)
2.2 标本检测时限的性能验证结果
3个检测限浓度的样本分别在24 h、3 d、5 d 及7 d 内检测,相同浓度不同时间段的检测结果均值见表4。经多因素方差分析,不同检测时限间HBV DNA 的CT 值比较,差异无统计学意义(F=0.830,P=0.524);不同检测时限间HCV RNA 的CT 值比较,差异无统计学意义(F=0.871,P=0.506);不同检测时限间HIV RNA 的CT 值比较,差异无统计学意义(F=0.296,P=0.827)。
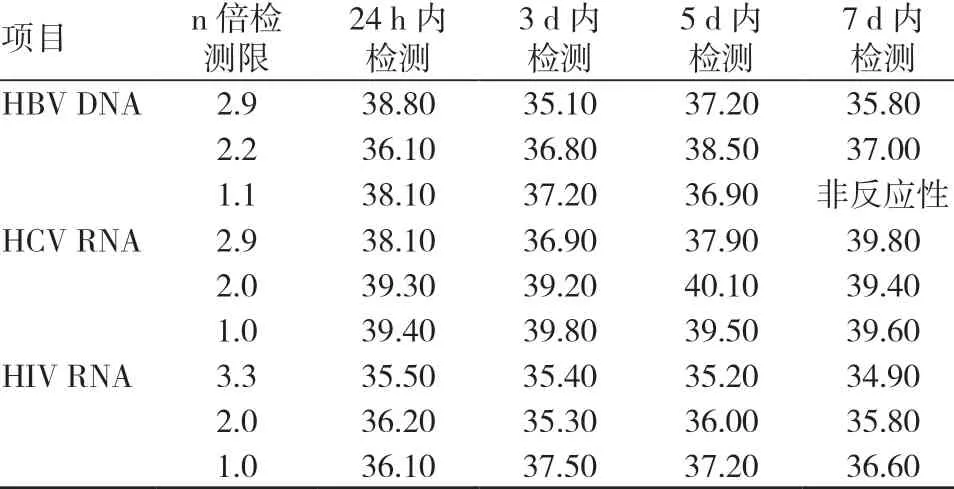
表4 不同时间段的检测结果(CT 值) (n=3)
3 讨论
待核酸检测系统装机后,实验室工作人员对检测系统的性能了解主要来自厂家的介绍和说明书文件,因此,验证核酸检测系统的关键性能参数成了实验室质量管理中的瓶颈[3]。不同血站系统的核酸检测模式及标本检测量可能不同,血站应建立适合自己实验室需求的方法确认计划,并进一步验证性能参数。本研究的验证试验即是在未进行集中检测,年采血量在12吨,检测模式为血清学结果阴性的标本才进行核酸检测这一模式下制定的,适用于中小血站,并可为其提供借鉴。
在对设备检测系统进行性能验证时,实验室会更多关注灵敏度、特异度、检测通量、防污染能力等方面的要求。作为质量控制的一部分,分析前质量控制尤为重要,因此,对核酸标本采集后离心时限及检测时限的性能验证十分必要,也是非常重要的环节。核酸检测对检测标本的要求严格,基因扩增是具有高灵敏度的检测技术,不恰当的标本采集、保存和处理过程容易造成假阳性或假阴性结果,因此,对检测前过程的控制极其重要[4]。尤其中小血站,当无法达到标本采集后立即离心或流动采血点未能配制配套专用标本离心机时,确认离心时限很有必要。
本试验结果显示,在罗氏COBAS S201 v2.0检测系统上,使用罗氏二代核酸检测试剂(MPX v2.0)将3个不同检测灵敏度核酸标本于采集后分别在4 h、24 h、3 d 内离心,并进行HBV DNA、HCV RNA 及HIV RNA 3个项目的检测,结果均呈反应性,与核酸试剂说明书上标注的标本离心时间为3 d 一致,符合性能要求。作为过程输出的检测结果的时效性要求也很强,血站的血液检测周期决定着血液在血站的隔离时间,只有尽快完成血液检测,才能保证血液能够被及时发往临床应用[4]。有些血站系统应用的核酸检测设备无法对标本进行血清学和核酸同步检测,只能待血清学检测出结果,包括血清学初检阳性标本再复检出结果后,阴性标本才能进入下一步的核酸检测环节,这样的检测模式对检测时限的确认亦非常必要。本试验结果显示,3个不同检测灵敏度核酸标本于采集后分别在24 h、3 d、5 d 及7 d 内进行HBV DNA、HCV RNA 及HIV RNA 3个项目的联合筛查,除7 d 内二次离心1倍检测限的HBV 检测结果为无反应性外,其余均呈反应性,与系统检测性能于说明书上标注的检测时限(1周内)基本一致。因此,为了保证检测结果的可靠性,我们严格将日常检测时限控制在了5 d 内,以便保证检测结果的有效性和准确性。
本研究所用的样本均为利用全血标本稀释到所需浓度再离心,与临床实际样本类型一致,与大多数实验室用血浆稀释到所需浓度检测相比,结果更具可靠性;通过验证试验,我们对罗氏COBAS S201 v2.0核酸检测系统标本离心时限和检测时限有了更全面的了解。在设计核酸检测系统确认方案时,除考虑满足法规要求外,还需考虑实验室具体需求、成本等因素,因地制宜地开展确认工作,通过确认工作的开展,最大限度地降低检测风险,确保检测结果准确,保证血液安全。依据WS/T 514-2017《临床检验方法检出能力的确立和验证》[5]标准规定,应对相应性能指标确认。设备和方法的确认是对采供血机构质量体系进行监控和持续改进的重要手段,确认工作是一项极其重要、繁杂且需不断探索的工作[6](不仅限于此),但检测系统的性能验证是设备、试剂和方法投入使用前必须的环节,可从程序和性能上保证检测结果的准确、有效[7-8]。
