不同载体材料尼莫地平固体分散体性质研究*
2021-10-20张宇佳王立强郑稳生
李 明,张宇佳,王立强,郑稳生△
(1.中国医学科学院北京协和医学院药物研究所·药物传输技术与新型制剂北京市重点实验室,北京 100050;2.北京元延医药科技股份有限公司,北京 101102)
尼莫地平为1,4-二氢吡啶衍生物Ca2+通道阻滞剂,通过抑制Ca2+进入细胞,从而抑制血管平滑肌收缩[1-3]。药理学研究显示,尼莫地平通过作用于Ca2+通道相关神经元受体和脑血管受体,发挥保护神经元,改善脑供血,增加脑部缺血的耐受力[4-5]。目前,其剂型包括片剂、缓释片、控释片、胶囊剂、胶丸剂、注射剂等,用于缺血性脑血管病、偏头痛、轻度蛛网膜下腔出血所致脑血管痉挛,突发性耳聋及轻中度高血压等疾病的治疗。依据生物药剂学分类,尼莫地平属生物药剂学分类系统(BCS)Ⅱ类化合物[6],溶解度低,渗透性高,故溶出速度是限制人体药物吸收的关键因素[7]。将难溶性药物制备成固体分散体是提高药物溶解度,改善生物利用度的常用方法[8-9]。固体分散体能显著增加难溶性药物的溶出速度及溶解速度,但传统方法制备得到的固体分散体存在产品物理稳定性差、工艺重复性差、后续处理困难等缺点,难以进行工业化生产[10]。喷雾干燥是制备固体分散体的有效技术,溶剂以极快的速度蒸发,使载体溶液快速转化为固体载体颗粒,伴随着溶剂蒸发形成无定形的固体分散体[11-12],可实现连续化生产,药物增溶效果显著,操作过程中的参数严格可控,工艺重复性好[13]。本研究中通过喷雾干燥技术,以共聚维酮S630、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物(Soluplus)及L,M,H型醋酸羟丙甲纤维素琥珀酸酯(HPMCAS)、聚乙烯吡咯烷酮(PVP)K29/32(简称PVP K30)为载体材料制备尼莫地平固体分散体,通过偏光显微镜(PLM)、差示扫描量热法(DSC)、X射线衍射(XRD)和傅里叶变换红外光谱(FTIR)等技术对不同载体的固体分散体性质进行表征,包括微观形态学特征、热行为特征、分子间相互作用特征与无定形特征,通过动力溶解度试验和稳定性试验分析其溶出特性和稳定性特征,并探讨载体材料对固体分散体的影响,为其工业化生产的应用提供参考。现报道如下。
1 仪器与试药
1.1 仪器
BT125D型分析天平(德国赛多利斯公司,精度为十万分之一);SD220型喷雾干燥机(深圳信宜特科技有限公司);MiniFlex 600型X射线衍射仪(日本理学公司);Q2000型差示扫描量热仪(美国TA公司);NICOLET5700型傅里叶变换红外光谱仪(Thermo Electron Corporation公司);LC-1020A型、LC-20AT型、LC-2030A型高效液相色谱仪,GC2030型气相色谱仪(日本Shimadzu公司);μDISS ProfilerTM型原位光纤溶出仪(美国Pion公司);RC806D型溶出仪(天津天大天发科技公司)。
1.2 试药
尼莫地平原料药(河北医科大学制药厂,批号为180801,纯度为99.5%);尼莫地平对照品(中国食品药品检定研究院,批号为100270-201403,纯度为99.7%);Soluplus(批号为36369336WO),K29/32(批号为0002342674),均购于巴斯夫(中国)有限公司;H型HPMCAS(HPMCAS HG,批 号 为65G-810004);M型HPMCAS(HPMCAS MG,批号为60G-810003),HPMCAS(HPMCAS LF,批号为NPD-0047),共聚维酮S630(批号为0002358298),均购于亚什兰化学贸易(上海)有限公司;甲醇(色谱纯,国药集团化药试剂有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 尼莫地平含量测定
2.1.1 色谱条件
色谱柱:DiamonsilPlusC18柱(250mm×4.6mm,5μm);流动相:甲醇-四氢呋喃-水(13∶26∶60,V/V/V);流速:1.5 mL/min;检测波长:235 nm;柱温:40℃;进样量:20μL。
2.1.2 样品与溶液制备
供试品溶液:取尼莫地平原料药60 mg,精密称定,置100 mL容量瓶中,加50 mL甲醇,超声处理5 min使溶解,加甲醇稀释至刻度,摇匀,滤过,即得。
空白载体材料溶液:取处方量载体材料,精密称定,置100 mL容量瓶中,加50 mL甲醇超声处理5 min使溶解,加甲醇稀释至刻度,摇匀,滤过,即得。
固体分散体溶液:取处方量载体材料和尼莫地平原料药,精密称定,置100 mL容量瓶中,加50 mL甲醇超声处理5 min使溶解,加甲醇稀释至刻度,摇匀,滤过,即得。
尼莫地平固体分散体:取处方量尼莫地平原料药,分别与不同载体材料共聚维酮S630,PVP K30,Soluplus,HPMCAS HG,HPMCAS MG,HPMCAS LF分别按1∶2,1∶3,1∶4比例进行混合,加入少量丙酮超声溶解,得到尼莫地平与载体材料的混合溶液。喷雾干燥机的工作条件:进风温度为95℃,排风温度为55℃,风机转速为1 200 r/min,蠕动泵转速为10 r/min,雾化压力为0.1 MPa。将混合液在该条件下进行喷雾干燥,置干燥器内冷却至室温,即得。
物理混合物:取处方量尼莫地平和载体材料,分别按1∶2,1∶3,1∶4比例混合,置研钵中充分研磨,移至自封袋内,充分振荡30 min,过筛,即得。
2.1.3 方法学考察
专属性试验:各成分保留时间见表1,高效液相色谱图见图1。在尼莫地平出峰位置处,杂质A,B,C及空白辅料、空白溶剂均无干扰峰,表明方法专属性良好。

表1 各成分保留时间及分离度Tab.1 Retention time and resolution of each compound
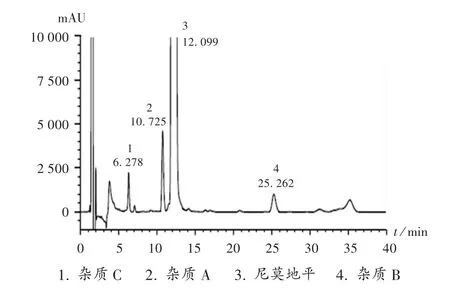
图1 尼莫地平含量的专属性试验高效液相色谱图(λ=235 nm)1.Impurity C 2.Impurity A 3.Nimodipine 4.Impurity BFig.1 HPLC chromatogram of the specific test of nimodipine(λ=235 nm)
线性关系考察:取尼莫地平对照品,精密称定,定量配制,得质量浓度分别为0.001 2,0.060 0,0.300 0,0.500 0,0.600 0,1.20 0 mg/mL系列对照品的溶液,按2.1.1项下色谱条件进样测定。以尼莫地平质量浓度(X,mg/mL)为横坐标、峰面积(Y)为纵坐标绘制标准曲线,得回归方程Y=50 908 013X+232 450,R2=0.999 7(n=6)。结果表明,尼莫地平质量浓度在0.001 2~1.202 0 mg/mL范围内与峰面积线性关系良好。
精密度试验:取尼莫地平溶液3份,同1日连续进样3次,检测,计算日内精密度;不同日进样3次,检测,计算日间精密度。结果日内精密度和日间精密度峰面积的RSD分别为0.07%和0.31%(n=6),表明仪器精密度良好。
稳定性试验:取同一批样品,分别于0,1,2,3,4,5,6,20,24 h时按2.1.1项下方法进样测定,记录峰面积。结果峰面积的RSD为0.01%(n=9),表明供试品溶液在24 h内稳定性良好。
加样回收试验:取尼莫地平固体分散体,分别加入低、中、高浓度的尼莫地平对照品溶液,超声溶解稀释后经0.22μm微孔滤膜,滤过,按2.1.1项下方法进样测定,以测定结果/理论浓度计算回收率。结果尼莫地平的回收率为98%~101%,均符合要求,表明方法准确度高。
定量限和检测限确定:取尼莫地平对照品适量,精密称定,加溶剂逐级稀释,精密量取20μL,按2.1.1项下色谱条件进样检测,当信噪比(S/N)为10时作为定量限,当S/N为3时作为检测限。结果定量限为1.2μg/mL,检测限为12 ng/mL。
2.2 尼莫地平固体分散体物象考察
2.2.1 PLM观察
取2.1.2项下尼莫地平固体分散体与物理混合物,以及尼莫地平原料药共聚维酮S630及PVP K30,Soluplus,HPMCAS,分别置PLM镜下观察并比较。结果见图2。由图2可知,尼莫地平以块状结晶体存在,固体分散体中未观察到明显晶体结构,判断药物以无定形形式存在。
2.2.2 DSC分析
采用DSC法考察不同载体热行为的差异。分别取2.1.2项下物理混合物及尼莫地平固体分散体、尼莫地平原料药、共聚维酮S630及PVP K30,Soluplus,HPMCAS,各5 mg,分别置样品池内。以空铝盘为参考池,程序升温(以10℃/min速率从25℃升至110℃,冷却至25℃,再以10℃/min的速率从25℃升至230℃),氮气流量为50 mL/min,记录各样品DSC热曲线。结果见图3。可见,尼莫地平原料药在124.76℃处有单一吸热峰,是在升温过程中逐渐熔融的吸热过程,为尼莫地平的熔点峰,表明尼莫地平存在明显晶型,载体材料无热吸收峰,不同载体材料制备的固体分散体中,于124.76℃处未出现任何吸热峰,即尼莫地平与上述所有载体材料经喷雾干燥后均成功制备为固体分散体,尼莫地平在其中以无定形形式存在。
2.2.3 XRD 分析
药物与载体材料形成固体分散体,两者发生相互作用产生新的晶型或无定形,图谱中将产生新的峰形或新的钝峰。因此,通过比较固体分散体与物理混合物的XRD图谱变化,可有效考察药物与载体材料的相互作用[14]。取2.1.2项下尼莫地平固体分散体、尼莫地平原料药、共聚维酮S630及PVP K30,Soluplus,HPMCAS。工作条件:Cu靶,Ka辐射,电压40 kV,电流40 mA;扫描方式:步进式扫描;扫描速度:0.2 s;扫描范围:5°~60°;探测器:LynxEye。结果见图4。
由图4可知,尼莫地平具有特征X射线衍射峰,说明其存在特定的晶体结构。所用载体材料无特征XRD峰,说明其均不存在特定的晶体结构。在尼莫地平与载体材料的物理混合物中,尼莫地平特征衍射峰的数量减少,说明载体材料的存在会不同程度地掩盖XRD,而尼莫地平仍以晶体形式存在。在不同载体材料制备的固体分散体中,尼莫地平的XRD峰均完全消失,说明此时尼莫地平的晶体结构已完全消失,以无定形的形式存在。

A.尼莫地平原料药 B.尼莫地平固体分散体图3 差示扫描量热曲线图A.Nimodipine API B.Nimodipine solid dispersionFig.3 DSC profile

A.尼莫地平 B.尼莫地平-PVP K30(1∶2) C.尼莫地平-S630(1∶2) D.尼莫地平-Soluplus(1∶2) E.尼莫地平-ASLF(1∶2) F.尼莫地平-ASMG(1∶2) G.尼莫地平-ASMG(1∶3)图2 偏光镜显微镜图(×400)A.Nimodipine B.Nimodipine-PVP K30(1∶2)C.Nimodipine-S630(1∶2)D.Nimodipine-Soluplus(1∶2)E.Nimodipine-ASLF(1∶2)F.Nimodipine-ASMG(1∶2)G.Nimodipine-ASMG(1∶3)Fig.2 PLM micrograph(×400)
2.2.4 FTIR分析
FTIR基于迈克尔逊干涉对红外光进行傅里叶变换原理,噪声低,光通量高,测量速度快,波数精度高,频率测量范围宽。通过固体分散体样品图谱上特征吸收峰的位置与强度,可有效推测药物与载体间的相互作用及结晶化程度[15]。采用溴化钾(KBr)压片法分别对尼莫地平原料药、尼莫地平固体分散体进行FTIR检测,波数范围为400~4 000 cm-1,扫描次数60次,分辨率4.0 cm-1。
尼莫地平固体分散体FTIR图谱见图5。可见,红外吸收特征区中,3 291 cm-1处为仲胺基N—H伸缩振动吸收峰,1 695 cm-1处为C=O伸缩振 动吸收峰,1 621 cm-1,1 495 cm-1处为C=C伸缩振动吸收峰,1 524 cm-1处为N=O伸缩振动吸收峰,1 346 cm-1处为仲胺基C—N伸缩振动吸收峰,1 023 cm-1处为仲胺基中的C—O伸缩振动吸收峰;不同载体固体分散体中,N—H,C=O,C=C,C—N吸收峰消失,是由于尼莫地平在固体分散体中占比较小,高分子材料吸收峰会掩盖这些化学键的红外吸收峰;不同载体固体分散体中N—H,C=O,C—C,C—N会发生波数偏移或谱线变宽,这是因为尼莫地平在固体分散体制备过程中与载体材料发生了氢键结合。
2.2.5 动力溶解度试验
以原位光纤技术考察不同固体分散体中尼莫地平的动力溶解度。分别取尼莫地平原料药和固体分散体20 mg,分别置含有15 mL的去离子水、pH 6.8磷酸盐缓冲溶液(PBS)、含0.3%十二烷基硫酸钠(SLS)的pH 4.5醋酸盐缓冲溶液(ABS)中。设置工作条件:磁力搅拌速度为300 r/min,测定温度为37℃,光纤探头为2 mm,全波长检测,分析波长为352~362 nm,取样时间为1 min和4 min,10~120 min间隔5 min(取样,共23个),检测总时间为120 min。结果见图6。可知,所有样品中尼莫地平均表现出最低的溶解度。不同载体材料、不同比例制备的固体分散体对尼莫地平的增溶效果不等,说明尼莫地平的增溶效果受载体材料的种类及其与药物比例的影响。
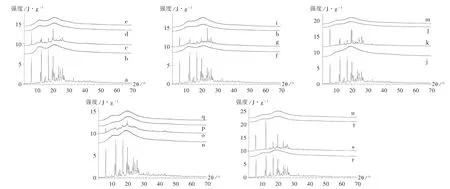
a.尼莫地平 b.PVP K30 c.尼莫地平与PVP K30物理混合 d.尼莫地平-PVP K30固体分散体 e.尼莫地平-PVP K30固体分散体加速f.共聚维酮S630 g.尼莫地平与共聚维酮S630物理混合h.尼莫地平-共聚维酮S630固体分散体i.尼莫地平-共聚维酮S630固体分散体加速j.Soluplus k.尼莫地平与Soluplus物理混合l.尼莫地平-Soluplus固体分散体m.尼莫地平-Soluplus固体分散体加速n.ASMG o.尼莫地平与ASMG物理混合p.尼莫地平-ASMG固体分散体q.尼莫地平-ASMG固体分散体加速r.ASHG s.尼莫地平与ASHG物理混合t.尼莫地平-ASHG固体分散体u.尼莫地平-ASHG固体分散体加速图4 X射线衍射图a.Nimodipine b.PVP K30 c.Physical mixture of nimodipine and PVP K30 d.Nimodipine-PVP K30 solid dispersions e.Accelerated test of nimodipine-PVP K30 solid dispersions f.Copovidone S630 g.Physical mixture of nimodipine and copovidone S630 h.Nimodipine-copovidone S630 solid dispersions i.Accelerated test of nimodipine-copovidone S630 solid dispersions j.Soluplus k.Physical mixture of nimodipine and Soluplus l.Nimodipine-Soluplus solid dispersions m.Accelerated test of nimodipine-Soluplus solid dispersions n.ASMG o.Physical mixture of nimodipine and ASMG p.Nimodipine-ASMG solid dispersions q.Accelerated test of nimodipine-ASMG solid dispersions r.ASHG s.Physical mixture of nimodipine and ASHG t.Nimodipine-ASHG solid dispersions u.Accelerated test of nimodipine-ASHG solid dispersionsFig.4 XRD pattern
以PVP K30为载体材料制备的尼莫地平固体分散体中,比例为1∶3和1∶4时载药量最高。比例为1∶3时溶解度为876μg/mL,短时间处于超饱和状态;随着试验的进行,饱和状态被打破,在溶出过程中部分溶液贴杯壁首先析出,作为晶种诱发尼莫地平析出,使整个体系溶解度降低。
以共聚维酮S630为载体材料制备的尼莫地平固体分散体中,比例为1∶3时载药量最高。此时尼莫地平的溶解度为281μg/mL,动力溶解度提高3倍。
以Soluplus为载体材料制备的尼莫地平固体分散体中,比例为1∶4时的载药量最高。此时,尼莫地平的溶解度为417μg/mL,动力溶解度提高4倍。
以HPMCAS为载体材料制备的尼莫地平固体分散体中,不同型号、不同比例的固体分散体均可有效提高尼莫地平的动力溶解度。在L,M,H型HPMCAS所制备的固体分散体中,药物与载体材料比例为1∶3时的溶解度提高2倍。
因此,喷雾-冷冻干燥法可有效制备尼莫地平固体分散体,且所制备的尼莫地平固体分散体的溶解度均增加。
2.2.6 稳定性试验
取适量固体分散体装入离心管,置温度为40℃、相对湿度为75%的恒温恒湿箱中,放置2个月后测试固体分散体的DSC及动力溶解度结果见图7。结果显示,以PVP K30为载体材料的固体分散体中,1∶2,1∶3,1∶4的固体分散体分别于90.27,96.10,94.48℃处出现热吸收峰,说明PVP K30制备的固体分散体经加速条件处理后有晶体析出,稳定性较差;以共聚维酮S630为载体材料制备的固体分散体中,1∶2,1∶3,1∶4的固体分散体分别在85.30,82.86,84.30℃处出现热吸收峰,说明共聚维酮S630制备的固体分散体经加速条件处理后有晶体析出,稳定性较差;以Soluplus和L,M,H型HPMCAS载体材料所制备的固体分散体中均未出现新的热吸收峰,说明这2种载体所制备的固体分散体在该加速条件下稳定性较好。

图7 加速试验DSC图谱Fig.7 DSC spectrogram of the accelerated test

A.尼莫地平 B.尼莫地平-PVP K30(1∶2) C.尼莫地平-PVP K30(1∶3) D.尼莫地平-PVP K30(1∶4) E.尼莫地平-共聚维酮S630(1∶2) F.尼莫地平-共聚维酮S630(1∶3) G.尼莫地平-共聚维酮S630(1∶4) H.尼莫地平-Soluplus(1∶2) I.尼莫地平-Soluplus(1∶3) J.尼莫地平-Soluplus(1∶4) K.尼莫地平-ASHG(1∶2) L.尼莫地平-ASHG(1∶3) M.尼莫地平-ASLF(1∶2) N.尼莫地平-ASLF(1∶3) O.尼莫地平-ASMG(1∶2) P.尼莫地平-ASMG(1∶3)图6 尼莫地平溶出曲线A.Nimodipine B.Nimodipine-PVP K30(1∶2)C.Nimodipine-PVP K30(1∶3)D.Nimodipine-PVP K30(1∶4)E.Nimodipine-Copovidone S630(1∶2)F.Nimodipine-Copovidone S630(1∶3)G.Nimodipine-Copovidone S630(1∶4)H.Nimodipine-Soluplus(1∶2)I.Nimodipine-Soluplus(1∶3)J.Nimodipine-Soluplus(1∶4)K.Nimodipine-ASHG(1∶2)L.Nimodipine-ASHG(1∶3)M.Nimodipine-ASLF(1∶2)N.Nimodipine-ASLF(1∶3)O.Nimodipine-ASMG(1∶2)P.Nimodipine-ASMG(1∶3)Fig.6 Dissolution profile of nimodipine
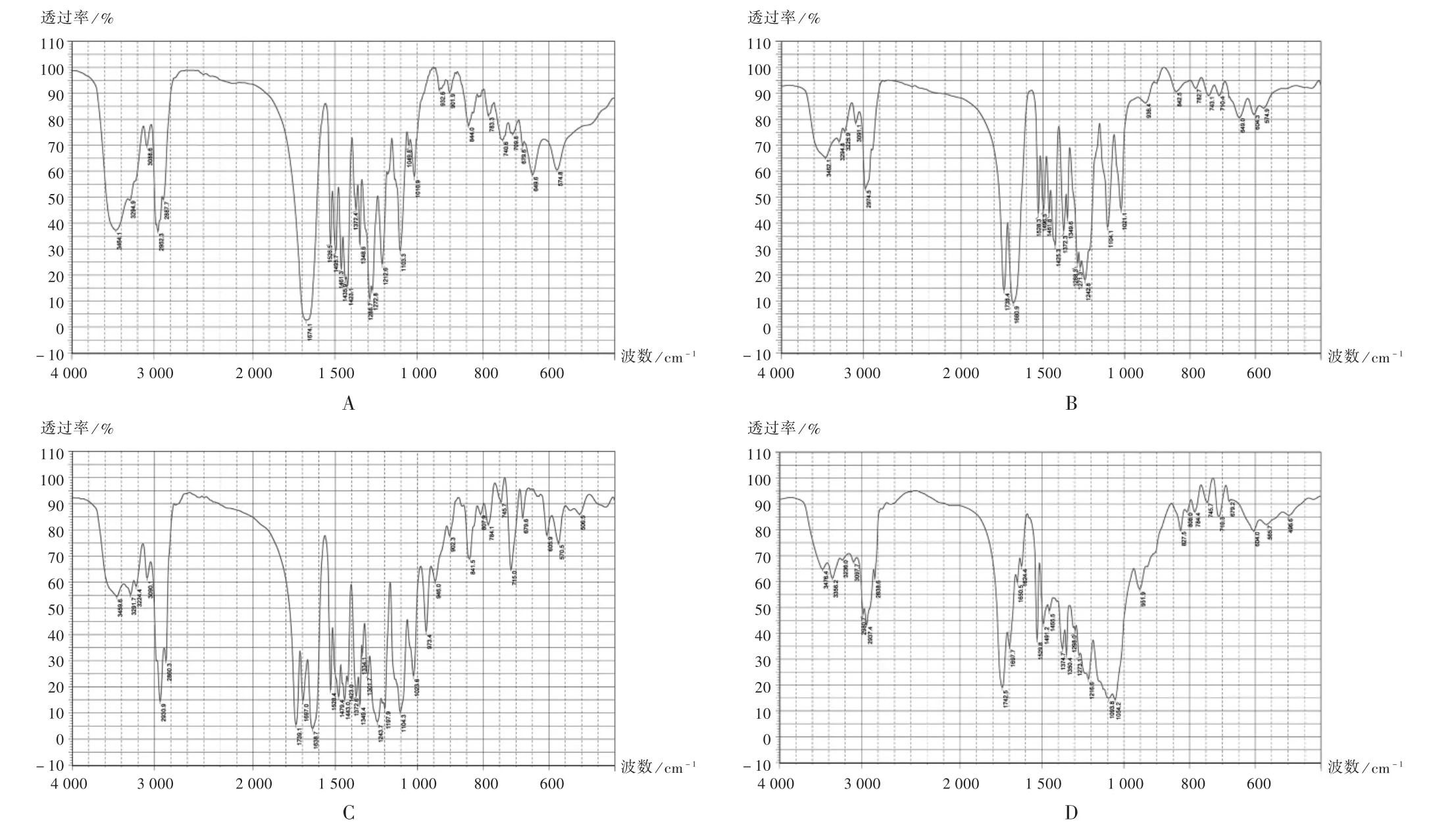
A.尼莫地平-PVP K30 B.尼莫地平-共聚维酮S630 C.尼莫地平-Soluplus D.尼莫地平-HPMCAS图5 傅里叶变换红外光谱图A.Nimodipine-PVP K30 B.Nimodipine-Copovidone S630 C.Nimodipine-Soluplus D.Nimodipine-HPMCASFig.5 FTIR spectrogram
3 讨论
参考文献[16-19],第1代固体分散体载体材料多为尿素、糖、有机酸等晶体;第2代载体材料为天然及全合成的聚合物,其中天然材料以纤维素衍生物如羟丙基甲基纤维素、乙基纤维素、羟丙基纤维素或淀粉衍生物为代表,合成聚合物以PVP、聚乙二醇、聚甲基丙烯酸酯等为代表;第3代载体材料是可以自乳化的表面活性剂,如泊洛沙姆408、吐温80等。目前以第2代载体材料为主,为固体分散体的工业化生产提供了充实的材料基础。
载体材料对固体分散体的理化性质如溶解度、溶出速度、结晶形态等产生极大影响,但其影响机制仍处于探索阶段[20]。随着制剂学技术的不断发展,载体材料与药物的作用机制将逐渐明晰[21]。本研究中选择已成功实现工业化量产且安全性得到充分探究的第2代载体材料共聚维酮、Soluplus、HPMCAS、PVP K30制备尼莫地平固体分散体,以期为固体分散体制剂的发展提供更多数据支持。
尼莫地平是BCSⅡ类化合物,低溶解度限制其生物利用度及符合临床需求剂型的开发。本研究中制备了基于不同载体的尼莫地平固体分散体,并通过PLM,DSC,XRD,FTIR等技术对所制备固体分散体的理化性质进行充分探讨。结果显示,尼莫地平与不同载体材料采用喷雾干燥技术制备的固体分散体以无定形的形式存在,可有效改善其溶解度,同时保持了较好的稳定性。
综上所述,通过喷雾干燥技术可将尼莫地平与合适的载体材料制备为固体分散体,为药物的开发提供了新方向。
