陕西省2017年至2019年医疗器械生产企业现场检查情况分析
2021-10-20胡碧荣
胡碧荣
(陕西省药品技术审核查验中心,陕西 西安 710065)
陕西省目前有医疗器械生产企业524家,其中一类269家,二类235家,三类29家。陕西省医疗器械产业较弱,企业规模以中小型为主,生产实力强、品种科技含量高的大型企业占比不高,多数企业产品品种单一,创新能力不强[1]。实施《医疗器械生产质量管理规范》(以下简称《规范》)是监管生产过程,提高医疗器械产品质量的重要手段,也是保障公众用械安全的重要举措[2-3]。本研究中,结合《医疗器械生产质量管理规范现场检查指导原则》等4个原则[4]的要求,汇总了陕西省2017年至2019年295家医疗器械生产企业质量管理规范现场检查情况,分析企业存在的问题并提出建议,旨在为本省医疗器械生产企业日常监管提供数据支持,为企业质量管理体系的改进提供参考。现报道如下。
1 现场检查企业基本情况
由表1可知,依据《规范》[2]开展现场检查共136家,占46.10%;依据《医疗器械生产质量管理规范附录无菌医疗器械》[5]开展现场检查共70家,占23.73%;依据《医疗器械生产质量管理规范附录植入性医疗器械》[6]开展现场检查共15家,占5.08%;依据《医疗器械生产质量管理规范附录定制式义齿》[7]开展现场检查共66家,占22.37%;依据《医疗器械生产质量管理规范附录体外诊断试剂》[8]开展现场检查共8家,占2.71%。
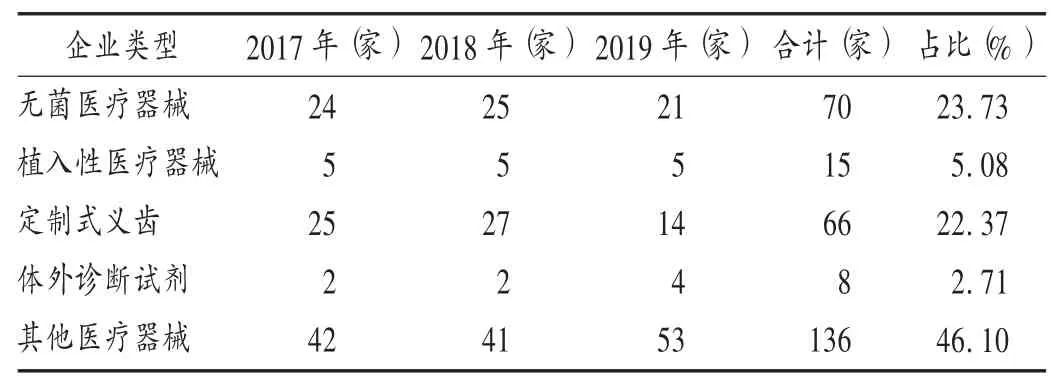
表1 不同企业类型医疗器械生产企业现场检查分布(n=295)Tab.1 Distribution of the on-site inspection for different types of medical device manufacturers(n=295)
由表2可知,首次注册及延续注册启动类现场检查共157家,占53.22%;生产许可及注册事项变更类现场检查共94家,占31.86%;监督检查及其他类现场检查共44家,占14.92%。
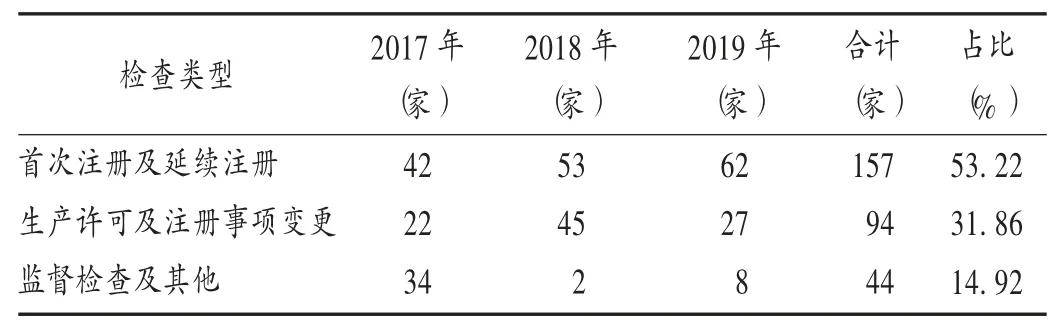
表2 不同检查类型医疗器械生产企业现场检查分布(n=295)Tab.2 Distribution of different on-site inspection types for medical device manufacturers(n=295)
2 结果与分析
2.1 结果
总体情况:由表3可知,2017年至2019年现场检查的295家医疗器械生产企业中,21家企业未通过检查,274家企业整改后符合要求。
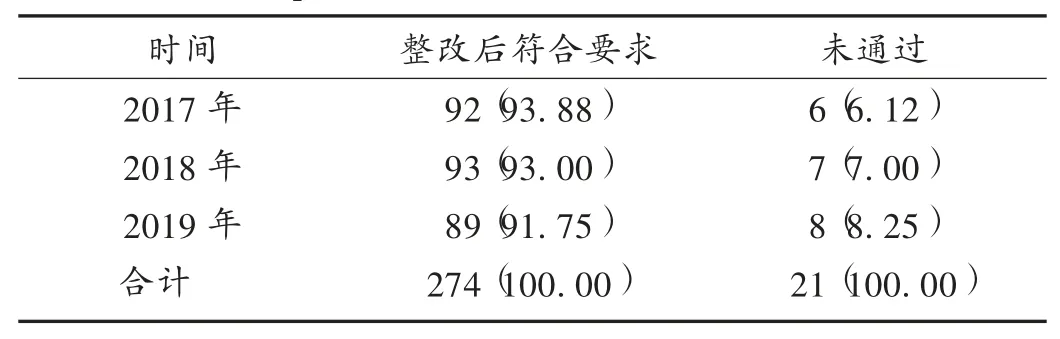
表3 医疗器械生产企业现场检查结果[家(%)]Tab.3 On-site inspection results of medical device manufacturers[n(%)]
缺陷项目分布情况:2017年至2019年现场检查的295家医疗器械生产企业中,不符合项共2 513条。其中,一般缺陷项目2 453项,严重缺陷项目60项。详见表4。可见,一般缺陷项目逐年增多,严重缺陷项目逐年减少,说明随着《规范》的深入实施,企业的法规认知和规范意识逐步提升,质量管理体系正在持续改进和不断优化。由图1可知,质量控制章节出现13次,生产管理章节出现12次,机构和人员章节出现7次,采购章节出现5次。可见,生产管理、质量控制、机构和人员章节是企业质量管理体系问题的重灾区,同时采购、文件管理、不良事件监测分析和改进章节也值得重视。由此推测,企业在厂房与设施、设备等硬件管理方面存在较多问题,与企业规模小、实力弱、投入不足有一定关系。随着企业质量意识的提升,盈利能力的增加,规模的不断扩大,这一问题将得到有效解决。
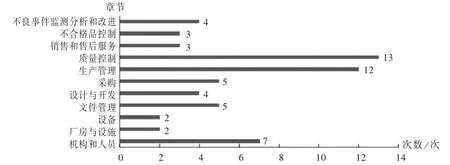
图1 医疗器械生产企业现场检查严重缺陷项目分布Fig.1 Distribution of serious defects in on-site inspection of medical device manufacturers
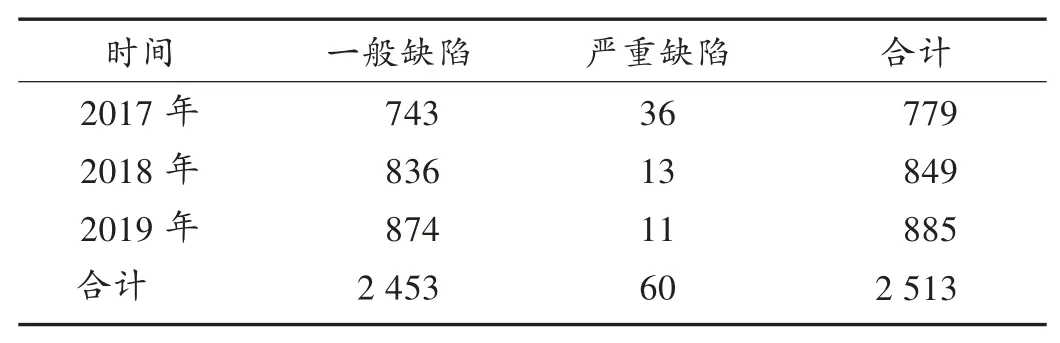
表4 医疗器械生产企业现场检查缺陷项目分布(项)Tab.4 Distribution of defect items in on-site inspection of medical device manufacturers(item)
2.2 质量管理体系薄弱环节分析
2.2.1 综合分析
陕西省医疗器械生产企业整体质量管理水平不高,出现的不符合项目较多,企业内审、自查和纠错能力不足,表现在历次检查不符合项相同或相似,各章节不符合条款相对集中。如2017年,厂房与设施章节2.6.2项“仓储问题”出现次数最多(34次),机构和人员章节1.4.1项“部门负责人任职能力考核问题”和生产管理章节7.6.2项“批生产记录”并列第2(28次),质量控制章节8.4.2项“检验记录问题”到第3(21次);2018年,厂房与设施章节2.6.2项仍列第1(38次),生产管理章节7.6.2项和设备章节3.2.2项“设备状态标识”并列第2(27次);2019年数据高频不符合项也基本一致。
2.2.2 单项分析
由图2可知,厂房与设施、设备、生产管理、质量控制章节出现不符合项频率较高,不符合主要内容包括以下5个方面。
厂房与设施章节:仓储区域划分问题突出,如仓储区无待检区、退货召回区,物料未按规定区域存放,物料存放要求不明确,设施不能满足存储环境要求;货位卡及台账信息不全;压差表、温度计等设施配备、安装配备问题;洁净区管道密封、传递窗、互锁装置故障问题;物料卡内容不完整等。有源医疗器械和诊断试剂生产企业还存在生产区域划分不明确,生产工具、原材料、中间产品存放混乱等问题[9]。
设备章节:生产设备、检验设备验证记录问题,如缺少验证计划、验证记录不全、验证结果未运用(与实际运行参数不一致)等;使用、维护保养和操作规程及记录问题,如未建立设备操作、维护保养规程或内容不全,未按规程要求建立记录等;洁净区管理方面,空调系统维护保养问题,如未建立空调系统维护保养记录,未查见初中效滤过滤网清洁更换记录。水系统维护保养问题,如纯化水系统使用维护保养标准操作规程未明确具体的日常保养方法[10],存在盲管、水质监测记录不全等。
生产管理章节:批生产记录不全,如①未记录物料批号、设备编号、工艺参数、无操作人员签字等。②有源医疗器械未记录生产设备和工艺参数、部分工序无记录。③无菌医疗器械关键工序工艺参数记录及生产批与灭菌批之间的关系记录常出现问题。④生产工艺规程、作业指导书的要求与批生产记录之间无法对应;工艺规程中设置的工序与批生产记录中设置的工序不一致;工序参数在工艺规程中有要求,但记录中未设置等。⑤物料进入洁净区程序存在问题,如未明确物料进入洁净区的净化要求,未查见物料进入洁净区的流转记录。
质量控制章节:《医疗器械生产企业质量控制与成品放行指南》明确要求,“企业应当根据强制性标准以及经注册或者备案的产品技术要求、产品交付要求、企业内部控制标准等制定成品检验规程”[11]。现场检查实践中,企业经常不能区分标准与规程的关系,检验项目往往不能涵盖强制性标准和产品技术要求的内容。另外,建立的原材料、中间产品、半成品的标准不清晰,检验规程中具体检验项目的检验方法不明确,存在记录缺失现象。企业关注成品和关键原材料较多,往往忽视辅助材料(如初包装材料)要求,对于中间产品、半成品的检验要求也不够重视,检验方法和检验原始记录问题高发。
其他:除高发不符合项的章节外,以下项目也均为高发条款,如机构和人员章节的部门及岗位职责权限划分项,文件管理章节的文件更改和作废文件管理项,设计与开发章节的设计转换记录项,采购章节的供应商审计销售项,销售和售后服务章节的销售记录项,不合格品控制章节的不可返工产品处置规定项,不良事件监测分析和改进章节的数据分析和内审项目。
2.2.3 原因分析
分析不同类型企业检查数据得知,义齿、有源类、无菌植入等企业平均缺陷条款较多。以2018年为例,义齿企业不符合项268项,平均不符合9.9项;有源类企业不符合项346项,平均不符合8.4项;无菌植入企业不符合项215项,平均不符合7.1项。从条款总数来看,义齿和有源类企业缺陷条款占比较大,企业平均不符合项数值高,一定程度反映了这类企业规模较小、实力较弱,人员素质较低,质量管理意识较低。分析其原因,认为存在问题较多的企业往往存在管理制度和管理实际“两张皮”现象,这类企业虽按要求制订了质量手册、程序文件、记录表格等,但在管理实际中不能按文件要求执行或不能完全执行。一是企业质量管理人员数量不足,素质不高,自查能力、风险分析能力和纠正预防能力不够。二是企业质量管理体系文件与企业管理实际不贴和,发现问题不能根据自身实际不断修改完善,导致执行越来越难。三是企业对质量管理体系文件认知不够,在法规用于注册产品、企业质量管理体系时认识有偏差,转化、落实不够。在检查实践中,经常发现企业未识别国标和行业标准等强制性标准,不能及时获取和学习注册产品强制标准的变更、相关规范文件的发布,出现企业产品技术要求、检验方法、原材料等引用标准和文件不是现行版本,以及未采用强制性标准。四是企业对员工培训不力,质量管理全员参与不够,导致员工不能合规执行,体系管理存在“真空”地带。
2.3 检查章节不符合项目分布
由图2可知,2017年检查章节不符合项目占前3位的是厂房与设施、质量控制、机构和人员3个章节,分别为138,121,96项;2018年占前3位的是厂房与设施、生产管理、设备3个章节,分别为140,124,106项;2019年占前3位的是厂房与设施、生产管理、质量控制3个章节,分别为133,125,119项。可见,机构和人员、章节不符合项目有所减少,文件管理、设计与开发、采购、生产管理章节不符合项目增加,特别是文件管理和设计与开发章节不符合项增长明显。

图2 医疗器械生产企业现场检查不符合项目按章节分布Fig.2 Distribution of non-conformance items by chapter in on-site inspection of medical device manufacturers
3 改进措施建议
3.1 监管部门
一是要加大法规宣传力度,督促企业学法,提升企业遵法守法及主体责任意识,抓好企业“关键人员”培训,提高企业自查能力和纠正预防能力,逐步完善体系,提高质量管理水平。二是要充分运用风险分析研判、数据分析等手段,确定监管重点和“短板”,重点监控高风险品种和加强企业监督检查力度,抓好部分定制式义齿、有源类小弱企业的教育培训,整体提升其质量管理水平,实现科学决策与长效监管,推动医疗器械产业健康发展[12]。三是要加强监管力量配备和监管能力建设,解决新形势下行业发展快、监管任务重、监管人员不足、能力不足等问题,在监督检查的同时分析企业表象问题下深层次原因,帮助企业发现及解决问题。
3.2 企业
一是要不断提升质量意识和主体责任意识,建立质量管理体系持续改进机制。二是要完善内部管理制度、相关程序、文件,使流程更加顺畅、文件记录更加贴合实际。三是要分层级、岗位开展有针对性的员工培训,培养其良好的自查、纠正预防和分析改进能力,提升企业质量管理的整体素养。
