不孕患者慢性子宫内膜炎与子宫内膜息肉的关系
2021-10-19刘程程舒思楠许梦梵金淑文魏雪源
惠 燕 刘程程 舒思楠 叶 红 许梦梵 金淑文 魏雪源
(1. 三峡大学 第一临床医学院[宜昌市中心人民医院] 妇科, 湖北 宜昌 443003; 2. 三峡大学 医学院, 湖北 宜昌 443002)
子宫内膜息肉(endometrial polyps,EPs)是子宫内膜常见的良性病变,是由子宫内膜腺增生过度和血管周围的基质增生所致,通常表现为单个或多个,无柄或有蒂,大小从几毫米到几厘米不等。据报道EPs患病率为7.8%~34.9%[1-3]。在不孕症女性中发病率高达32%。EPs的发病由多因素介导,包括肥胖、他莫昔芬治疗和雌激素治疗不平衡等[4,5]。这些因素可能通过增强雌激素受体途径而促进EPs的发展。但是最近研究发现,子宫内膜炎症可能在EPs的发病中起重要作用[6-8]。慢性子宫内膜炎(chronic endometritis,CE)是子宫内膜的持续性炎症,其特征在于子宫内膜基质中浆细胞的浸润[9]。而且目前研究表明,CD138免疫组化染色可以用于诊断CE,且可以提高浆细胞的检出率[10,11]。CE与子宫内膜的不同宏观表现有关,例如微息肉、间质水肿、局灶和弥漫性充血等,提示CE可能促进子宫内膜细胞增殖,进而在EPs的发生发展中发挥作用[12]。目前EPs和CE之间的相关性仍然未知。本研究拟通过比较不孕妇女中EPs患者和非EPs患者的临床特点,探究EPs与CE之间的相关性。
1 方法
收集2019年7月1日~2021年1月1日因不孕来我院行宫腔镜检查患者。该研究得到我院伦理委员会的审查及批准。
1.1 研究对象
不孕症患者在月经卵泡期行宫腔镜检查(其中包括三维彩超提示宫腔占位患者),同时行宫腔镜下定向宫腔组织取样活检,对所有组织样品行HE和免疫组织化学CD138染色。CD138阳性者诊断为CE,根据病理学诊断EPs。并根据有无EPs分为A组(经宫腔镜和HE诊断为EPs)和B组(经宫腔镜和HE诊断无EPs)。排除标准为:近期(≤3个月)抗生素或避孕疗法;子宫肌瘤、子宫内膜异位症、子宫腺肌病;需要免疫抑制治疗的自身免疫性疾病;胎盘残留;子宫内膜非典型增生;结核;近期宫腔镜检查息肉切除术(≤12个月);先前诊断为CE的女性。研究共纳入187例不孕患者,其中A组63例、B组124例。
1.2 宫腔镜检查
宫腔镜检查采用基于透镜的3 mm外径微型望远镜进行,配有5 mm外径手术护套(Storz,德国)。在月经周期的增生阶段(月经干净后3~12 d)由2名至少一年宫腔镜手术经验的生殖内分泌医生进行。使用生理盐水溶液(0.9%等渗氯化钠)作为扩张介质,实现子宫腔的扩张,使用数码相机系统进行(SONY上海索广映像有限公司)记录。在宫腔镜检查过程中,对子宫内全景进行彻底检查,以识别出EPs和CE的任何宏观体征[13]。A组所有患者均行宫腔镜息肉切除术(使用配套剪刀)。A组和B组患者均使用配套抓钳对无EPs的子宫内膜进行活检(针对存在CE的任何宏观体征)。
1.3 组织学分析
将子宫内膜样品固定在中性福尔马林中,然后包埋石蜡切片进行组织学分析。A组每位患者均分析了来自子宫内膜息肉和子宫内膜的两个独立样本。B组行子宫内膜标本分析。A组和B组均采用小鼠抗人CD138单克隆抗体(即用型,中国迈新公司)检测浆细胞。由一位不知道宫腔镜检查结果的病理医师评估结果。在高倍镜下(×400)观察存在1个浆细胞认为CE阳性。
1.4 数据内容及诊断标准
数据包括患者的年龄、身体质量指数(body mass index,BMI)、卵巢功能、不孕原因,EPs的大小(定义为宫腔镜检查前经阴道超声测量的EPs的主轴)和宫腔镜检查下的评估。EPs诊断标准:HE染色下EPs由子宫内膜组成,表面被覆一层立方上皮或低柱状上皮,未见其它异型。CE诊断标准:子宫内膜标本行CD138免疫组化染色,高倍镜下存在≥1个浆细胞。
1.5 研究终点
主要终点为比较有无EPs合并CE比例的差异。次要终点为比较EPs患者子宫息肉标本和子宫内膜标本中CD138表达的差异。
1.6 统计学方法
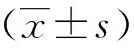
2 结果
2.1 两组间的一般情况比较
两组患者在年龄、BMI、卵泡刺激素(follicle stimulating hormone,FSH)、抗苗勒管激素(anti-Mullerian hormone,AMH)、窦卵泡数(antral follicle count,AFC)、不孕年限、不孕类型、不孕原因上,差异均无统计学意义(均P>0.05),见表1。
2.2 两组病检结果
宫腔镜检查发现A组的63例患者中,单个息肉有29例,≥2个息肉有34例。A组经CD138免疫组化染色证实CE有50例,无CE者13例,患病率为79.37%(50/63)。B组经CD138免疫组化染色证实CE者32例,无CE者92例,患病率为25.81%(32/124),见表2。A组CE的患病率明显高于B组,差异具有统计学意义(P<0.05)。

表2 两组CE患病率的比较
EPs患者中子宫内膜息肉标本CD138阳性率为79.37%(50/63),子宫内膜标本CD138阳性率为63.49%(40/63),两种标本的CD138阳性率差异有统计学意义(χ2=4.05,P=0.44),见表3。

表3 EPs患者子宫息肉标本和子宫内膜标本的CD138表达
3 讨论
本研究发现,EPs与非EPs患者的一般情况(年龄、BMI、FSH、AMH、AFC、不孕年限、不孕类型、不孕原因)差异无统计学意义,EPs女性的CE患病率较非EPs女性显著增高。我们通过宫腔镜下CE的宏观表现(局灶和弥漫性充血、微息肉、间质水肿等)进行定向活检,联合CD138免疫组化染色诊断CE,这是目前临床诊断CE的重要方法[14,15]。本研究结果与Cicinelli等[4]的研究发现相符。Cicinelli等[4]通过对240例EPs和240例无EPs的研究对象回顾性研究发现,EPs通常对CD138具有免疫反应性(76.67%),这提示CE在EPs的发病过程中可能发挥重要作用。
Carvalho等[16]研究发现,不孕患者中子宫内膜血管形态改变与CE和EPs相关,而且具有血管变化的EPs均具有CE的组织学证据。即使在单独EPs病例中,炎症改变与血管变化之间也存在显著关联。因此,EPs的血管轴实际上可能源自与CE相关的血管变化。同时CE的病理特征在于浅层的子宫内膜水肿变化,高基质细胞密度,上皮和基质之间的成熟解离以及子宫内膜间质浆细胞的浸润[17]。而CE的病理改变与子宫内膜微生物的定性和定量改变有关,主要是细菌(例如肠球菌、支原体、脲原体、衣原体、大肠杆菌和链球菌属等)感染[18,19]。并且在不孕女性宫腔镜检查中发现,患有CE女性的宫腔通常有微息肉(子宫内膜微小突起,平均直径1~2 mm的血管芯)[20]。因此,由于慢性炎症刺激子宫内膜血管轴的改变,引起微息肉逐渐增大形成EPs,可能代表子宫内膜局部变化的两个连续阶段。如本研究所示,EPs常合并CE,且EPs通常对CD138具有免疫反应性。
CE主要是由感染引起[18,19]。CE引起的子宫内膜修饰涉及的分子机制包括调节细胞增殖、凋亡的生长因子和细胞因子的异常表达,如下调白介素-11(interleukin-11, IL-11)、白介素-17(interleukin-17, IL-17)、趋化因子配体4(chemokine ligand 4, CCL-4)、胰岛素样生长因子1(insulin-like growth factor 1, IGF-1)、半胱氨酸蛋白酶8(caspase 8, CASP8)、转化生长因子β1(transforming growth factor β1, TGFβ1);上调胰岛素样生长因子结合蛋白1(insulin-like growth factor binding protein 1, IGFBP-1)、B淋巴细胞瘤-2(B-cell lymphoma 2, BCL-2)、凋亡相关因子Bcl-2相关X蛋白(BCL2-associated X protein, BAX)、CXC型趋化因子配体1(CXC-motif chemokine ligand 1, CXCL1)、CXC型趋化因子配体13(CXC-motif chemokine ligand 13, CXCL13)、白介素-17(interleukin-17, IL-17)、白介素-10(interleukin-10, IL-10)[21]。此外,Wu等[22]研究发现,CE患者中子宫内膜的雌激素受体α和β高于非CE子宫内膜,CE降低了子宫内膜的蜕膜化,而蜕膜化对于胚胎植入和维持妊娠有重要作用。CE通过减少雌激素的作用来减慢蜕膜的成熟,可能提示患有CE的女性子宫内膜生长存在额外刺激。由于慢性炎症引起相对过量的增殖刺激,将导致局部子宫内膜突起的发展,即EPs和微息肉。然而,由于缺乏明确的证据,其中的病理生理机制还有待进一步研究。
实际上,EPs本身可能直接导致CE的形成,如通过机械刺激子宫内膜作用。此外,在本研究中子宫内膜息肉标本和子宫内膜标本中CD138免疫反应阳性情况不一致,这种差异可能有以下几种原因。首先,当CE的影响并未扩散到整个子宫内膜时,EPs可能只存在于局部区域。从标本取材的代表性方面考虑,子宫内膜息肉标本获得CD138阳性的可能性大于子宫内膜标本。同时,我们不能排除由于取材的主观性而导致假阳性或假阴性的事实。另外,即使在弥漫性CE的情况下,CE消退后(即在抗生素治疗后),浆细胞浸润(CD138阳性)仍可能在EPs内持续存在。因此,本研究结论需要通过前瞻性研究来进一步证实。
本研究也存在一定的局限性,这是一项回顾性的研究,且EPs例数较少,不同医生宫腔内操作过程及相关因素都可能产生偏倚。另外,本研究中不孕女性CE与EPs之间的因果关系尚需进一步证明。同时,未来还需进一步评估CD138阳性和CD138阴性EPs之间可能存在的病理差异。
CE与EPs均影响子宫内膜容受性,其在不孕症患者中的发病率较高,可能是引起不孕症的重要原因。另外,EPs通常对CD138具有反应性,提示CE可能是EPs发病的重要因素。手术切除EPs后追加抗感染治疗,可以预防EPs的复发,为不孕症的治疗提供新思路。
