沙格列汀对1 型糖尿病小鼠GLP-1、胰高血糖素表达及胰岛α 细胞增殖、凋亡的影响①
2021-09-25吴美芬潘海燕刘裕晓黄兴丽韦晓丹
吴美芬 潘海燕 刘裕晓 黄兴丽 韦晓丹 武 革
(广东医科大学附属医院内分泌科,湛江524001)
糖尿病是世界范围内的常见病,长期易引发并发症,危害患者健康,近年其发病率逐渐升高。1 型糖尿病(type 1 diabetes mellitus,T1DM)是自身免疫介导引起胰岛β 细胞破坏、凋亡增加的自身免疫性疾病,在糖尿病中所占比例低于T2DM,但其临床症状较严重,多累及年轻人[1]。研究发现,T1DM 患者的高血糖往往与高血糖素血症有关,而胰高血糖素由胰岛α 细胞分泌[2]。胰高糖素样肽1(glucagonlike peptide-1,GLP-1)是一种促胰岛素肽,能促进胰岛β 细胞增殖并抑制其凋亡,主要由肠道L 细胞分泌,近年被发现可通过胰岛α 细胞合成胰高糖素原途径产生[3-5]。二肽基肽酶4(dipeptidyl peptidase 4,DPP4)抑制剂是近年广泛应用于糖尿病治疗的一类降糖药物,通过抑制GLP-1降解及胰高糖素分泌,增加体内胰岛素分泌发挥降糖作用[6]。沙格列汀是DPP4 抑制剂的一种,既往多用于治疗T2DM,临床疗效好,安全性高[7]。本研究将通过注射链脲佐菌素(streptozotocin,STZ)诱导建立T1DM 小鼠模型,研究沙格列汀对T1DM 小鼠GLP-1、胰高血糖素表达及胰岛α 细胞增殖、凋亡的影响,以期为临床治疗T1DM提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级健康C57BL/6小鼠55只,8~10 周龄,体重25~30 g(南方模式生物研究中心),严格按照小鼠饲养规则进行喂养,温度为25℃,湿度为50%,光照时间为8:00~20:00,饮用蒸馏水,饲养期间保持饲养房间整洁、通风,定时对鼠笼进行清理。实验动物及饲养条件符合《实验动物管理条例》要求。小鼠适应性饲养2周后用于后续实验。
1.1.2 主要试剂与仪器 STZ 自行配制:枸橼酸滴定生理盐水至pH值为4.2,然后进行高压灭菌,临用前以无菌酸化生理盐水将STZ 配制成2% 工作液。胰岛素(货号:0215504401)购自诺和公司;人GLP-1、人胰高血糖素ELISA 试剂盒、增殖细胞核抗原(pro‐liferating cell nuclear antigen,PCNA)抗体、Ki-67 抗体、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)抗体、GAPDH 抗体(货号:ab41969、ab267567、ab92552、ab15580、ab32503、ab181602)购自Abcam公司;辣根过氧化物酶标记的羊抗兔二抗(货号:0295G-HRP)购自美国Santa 公司;TUNEL 细胞凋亡检测试剂盒(货号:KFS197-SLG)购自北京百奥莱博科技有限公司;沙格列汀(货号:H20160088)购自阿斯利康制药有限公司;血糖仪(型号:HGM-114)购自达而泰(天津)实业有限公司;酶标仪(型号:MOD‐EL550)、化学发光成像系统(型号:ChemiDocXRS)购自美国Bio-Rad公司。
1.2 方法
1.2.1 动物模型制备 随机抽取45 只小鼠造模,剩余10 只作为正常组。造模前小鼠禁食不禁水12 h,称取空腹体重,按130 mg/kg STZ 给予小鼠单次腹腔注射。正常组小鼠同时间腹腔注射等量生理盐水。结束注射药物1 周后采集小鼠尾静脉血,测小鼠禁食6 h后血糖。连续2次血糖≥11.1 mmol/L诊断为T1DM。 造模期间未连续2 次血糖≥11.1 mmol/L 者4 只,死亡1 只,造模成功的40 只小鼠继续后续实验。
1.2.2 动物分组及给药方法 造模成功的小鼠随机分为模型组、胰岛素组、沙格列汀低剂量组、沙格列汀高剂量组(10 只/组)。胰岛素组皮下注射1 U胰岛素;沙格列汀低、高剂量组分别灌胃1、3 mg/(kg·d)沙格列汀,正常组、模型组小鼠均灌胃等体积生理盐水,1次/d,连续治疗4周。
1.2.3 血糖仪检测各组小鼠给药前后血糖水平
造模后各组小鼠于给药前、后禁食不禁水6 h 后采集尾静脉血,血糖仪检测血糖水平。
1.2.4 ELISA 法检测各组小鼠GLP-1 和胰高血糖素水平 给药结束后,麻醉小鼠进行心脏采血,收集的血样静置3 h 分离血清。ELISA 法检测小鼠血清GLP-1 和胰高血糖素水平,操作方法均按照试剂盒说明书进行。使用酶标仪测定吸光度值,波长为450 nm,取3次重复平均值,根据标准液吸光度结果与标准液浓度绘制标准曲线,得出换算方程,计算GLP-1和胰高血糖素水平。
1.2.5 免疫组化检测各组小鼠胰岛α 细胞增殖情况 取血后断颈处死,立即分离出胰腺组织,以体积分数0.9% 的冰生理盐水冲洗,用滤纸吸干残留水分。取近胰头的1/2 置于4% 多聚甲醛溶液中固定,24 h 后常规脱水透明,石蜡包埋,切片。将石蜡切片常规脱蜡水化,柠檬酸缓冲液修复抗原,滴加3%H2O2封闭内源性过氧化物酶,10% 山羊血清室温湿盒封闭,加入PCNA一抗(1∶6000)4℃孵育过夜,PBS 冲洗,加入辣根过氧化物酶标记的羊抗兔二抗(1∶5000)常温孵育1 h,PBS 冲洗,DAB 显色,水洗,苏木素复染,乙醇脱水,二甲苯透明,中性树胶封片。利用ImageProPlus 图像分析系统采集图像,每张片子取5个高倍视野(×400),计算增殖指数,增殖指数=增殖细胞数/细胞总数×100%。
1.2.6 TUNEL 法检测各组小鼠胰岛α 细胞凋亡情况 将石蜡切片脱蜡至水,柠檬酸缓冲液修复抗原,滴加3%H2O2封闭内源性过氧化物酶,滴加50 µl TUNEL 反应液,置于湿盒中,37℃孵育1 h,PBS 冲洗,滴加3%H2O2反应10 min,PBS溶液冲洗后,用含DAPI 的抗淬灭封片剂封片。利用ImageProPlus 图像分析系统采集图像,每张片子取5 个高倍视野(×400),计算凋亡指数,凋亡指数=凋亡细胞数/细胞总数×100%。
1.2.7 Western blot 检测各组小鼠胰腺组织中Ki-67、Bax 蛋白表达 RIPA 裂解液裂解胰腺组织,4℃离心后提取蛋白并定量,电泳、转膜、封闭后加入Ki-67、Bax、GAPDH 一抗(1∶500),4℃孵育过夜,TBST洗涤后加入辣根过氧化物酶标记的羊抗兔二抗(1∶5000),室温孵育1 h,免疫反应化学发光法显色,Tanon 600图像分析系统拍摄图像并分析条带灰度,目的蛋白相对表达量=目的蛋白灰度值/内参GAPDH灰度值。
1.3 统计学分析 数据处理采用SPSS24.0统计学软件。计量资料采用±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。当P<0.05时,差异有统计学意义。
2 结果
2.1 各组小鼠给药前后血糖水平 胰岛素组、沙格列汀低、高剂量组给药后血糖水平均显著低于给药前(P<0.05)。给药前,与正常组相比,模型组小鼠血糖水平均显著升高(P<0.05);模型组、胰岛素组、沙格列汀低、高剂量组小鼠血糖水平差异无统计学意义(P>0.05)。给药后,与对照组相比,模型组小鼠血糖水平均显著升高(P<0.05);与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠血糖水平均显著降低(P<0.05);胰岛素组与沙格列汀低剂量组小鼠血糖水平差异无统计学意义(P>0.05);与胰岛素组、沙格列汀低剂量组相比,沙格列汀高剂量组小鼠血糖水平显著降低(P<0.05)。见表1。
表1 各组小鼠给药前后血糖水平比较(±s,n=10,mmol/ L)Tab.1 Comparison of blood glucose levels before and af⁃ter administration(±s,n=10,mmol/ L)
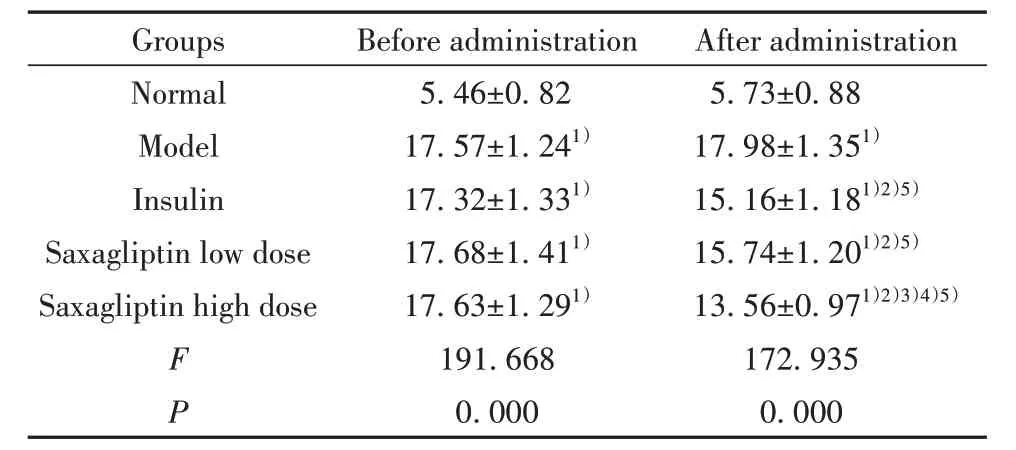
表1 各组小鼠给药前后血糖水平比较(±s,n=10,mmol/ L)Tab.1 Comparison of blood glucose levels before and af⁃ter administration(±s,n=10,mmol/ L)
Note:Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with insulin group,3)P<0.05;compared with low dose group of saxagliptin,4)P<0.05;com‐pared with before administration,5)P<0.05.
Groups Normal Model Insulin Saxagliptin low dose Saxagliptin high dose F P Before administration 5.46±0.8217.57±1.241)17.32±1.331)17.68±1.411)17.63±1.291)191.6680.000 After administration 5.73±0.8817.98±1.351)15.16±1.181)2)5)15.74±1.201)2)5)13.56±0.971)2)3)4)5)172.9350.000
2.2 各组小鼠血清GLP-1 和胰高血糖素水平 与正常组相比,模型组小鼠血清GLP-1水平显著降低,胰高血糖素水平显著升高(P<0.05);与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠血清GLP-1水平显著升高,胰高血糖素水平显著降低(P<0.05);胰岛素组和沙格列汀低剂量组小鼠血清GLP-1、胰高血糖素水平差异无统计学意义(P>0.05);与胰岛素组、沙格列汀低剂量组相比,沙格列汀高剂量组小鼠血清GLP-1 水平显著升高,胰高血糖素水平显著降低(P<0.05)。见表2。
表2 各组小鼠血清GLP-1、胰高血糖素水平比较(±s,n=10)Tab.2 Comparison of serum GLP-1 and glucagon levels in each group(±s,n=10)

表2 各组小鼠血清GLP-1、胰高血糖素水平比较(±s,n=10)Tab.2 Comparison of serum GLP-1 and glucagon levels in each group(±s,n=10)
Note:Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with insulin group,3)P<0.05;com‐pared with saxagliptin low dose group,4)P<0.05.
Groups Normal Model Insulin Saxagliptin low dose Saxagliptin high dose F P GLP-1(mmol/ L)15.22±1.185.94±0.821)7.91±0.961)2)7.66±1.041)2)10.85±1.131)2)3)4)74.5480.000 Glucagon(pg/ ml)48.18±2.6466.84±2.851)59.59±2.881)2)62.02±2.951)2)54.68±2.731)2)3)4)38.6830.000
2.3 各组小鼠胰岛α 细胞增殖情况 与正常组相比,模型组小鼠胰岛α 细胞增殖指数显著升高(P<0.05);与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠胰岛α 细胞增殖指数显著降低(P<0.05);胰岛素组和沙格列汀低剂量组小鼠胰岛α细胞增殖指数差异无统计学意义(P>0.05);与胰岛素组、沙格列汀低剂量组相比,沙格列汀高剂量组小鼠胰岛α细胞增殖指数显著降低(P<0.05)。见图1、表3。
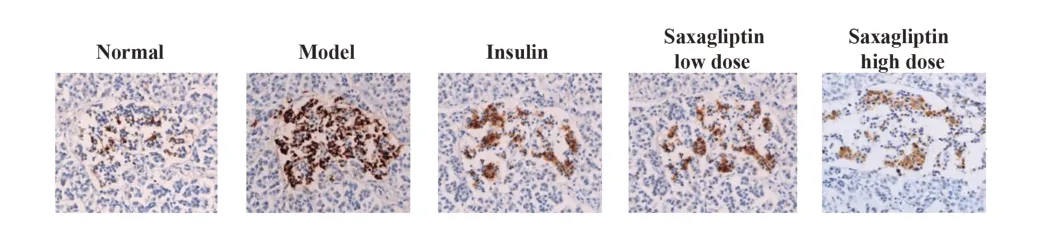
图1 免疫组化检测各组小鼠胰岛α细胞增殖情况(×400)Fig.1 Proliferation of islet α cells was detected by immu⁃nohistochemistry(×400)
表3 各组小鼠胰岛α细胞增殖指数比较(±s)Tab.3 Comparison of proliferation index of islet α cells in each group(±s)

表3 各组小鼠胰岛α细胞增殖指数比较(±s)Tab.3 Comparison of proliferation index of islet α cells in each group(±s)
Note:Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with insulin group,3)P<0.05;com‐pared with the low dose group of saxagliptin,4)P<0.05.
Groups Normal Model Insulin Saxagliptin low dose Saxagliptin high dose FP n 1010101010− −Proliferation index(%)24.87±1.3344.63±1.421)35.16±1.151)2)34.57±1.281)2)30.44±1.321)2)3)4)310.2340.000
2.4 各组小鼠胰岛α 细胞凋亡情况 与正常组相比,模型组小鼠胰岛α 细胞凋亡指数显著降低(P<0.05);与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠胰岛α 细胞凋亡指数显著升高(P<0.05);胰岛素组和沙格列汀低剂量组小鼠胰岛α细胞凋亡指数差异无统计学意义(P>0.05);与胰岛素组、沙格列汀低剂量组相比,沙格列汀高剂量组小鼠胰岛α细胞凋亡指数显著升高(P<0.05)。见图2、表4。

图2 TUNEL法检测各组小鼠胰岛α细胞凋亡情况(×400)Fig.2 Apoptosis of islet α cells was detected by TUNEL method(×400)
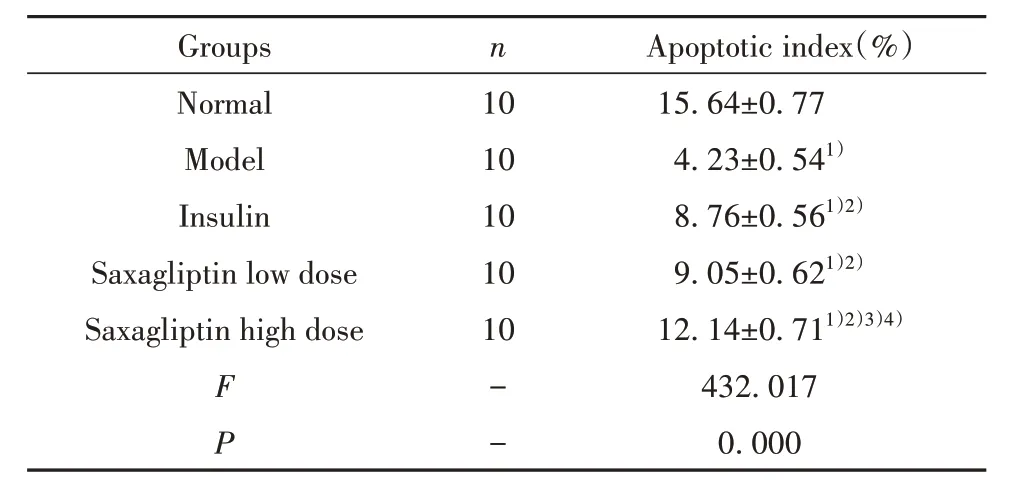
Note:Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with insulin group,3)P<0.05;com‐pared with low dose group of saxagliptin,4)P<0.05.
2.5 各组小鼠胰腺组织中Ki-67、Bax 蛋白表达情况 与正常组相比,模型组小鼠胰腺组织中Ki-67蛋白表达水平显著升高,Bax 蛋白表达水平显著降低(P<0.05);与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠胰腺组织中Ki-67 蛋白表达水平显著降低,Bax 蛋白表达水平显著升高(P<0.05);胰岛素组和沙格列汀低剂量组小鼠胰腺组织中Ki-67、Bax 蛋白表达水平差异无统计学意义(P>0.05);与胰岛素组、沙格列汀低剂量组相比,沙格列汀高剂量组小鼠胰腺组织中Ki-67 蛋白表达水平显著降低,Bax 蛋白表达水平显著升高(P<0.05)。见图3、表5。
表5 各组小鼠胰腺组织中Ki-67、Bax 蛋白表达水平比较(±s,n=10)Tab.5 Comparison of Ki-67 and Bax protein expression levels in pancreas of mice in each group(±s,n=10)
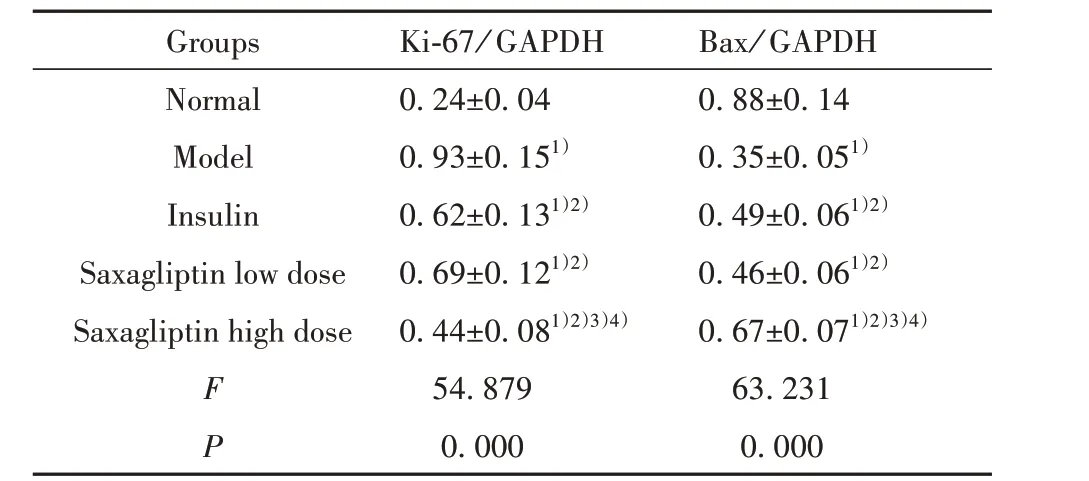
表5 各组小鼠胰腺组织中Ki-67、Bax 蛋白表达水平比较(±s,n=10)Tab.5 Comparison of Ki-67 and Bax protein expression levels in pancreas of mice in each group(±s,n=10)
Note:Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with insulin group,3)P<0.05;com‐pared with low dose group of saxagliptin,4)P<0.05.
Groups Normal Model Insulin Saxagliptin low dose Saxagliptin high dose F P Ki-67/ GAPDH 0.24±0.040.93±0.151)0.62±0.131)2)0.69±0.121)2)0.44±0.081)2)3)4)54.8790.000 Bax/ GAPDH 0.88±0.140.35±0.051)0.49±0.061)2)0.46±0.061)2)0.67±0.071)2)3)4)63.2310.000

图3 各组小鼠胰腺组织中Ki-67、Bax蛋白表达水情况Fig.3 Expressions of Ki-67 and Bax proteins in pancreas of mice in each group
3 讨论
糖尿病是一种严重的非传染性慢性疾病,是重要的公共卫生问题,分为T1DM、T2DM、妊娠期糖尿病(gestational diabetes mellitus,GDM)及特殊类型糖尿病4个类型。近年来,以儿童青少年为主的T1DM发病率逐年升高,在美国,T1DM 患者高达2500 多万人,相关治疗费用带来的潜在社会、经济负担越来越重[8-11]。目前T1DM 的发病机制尚未完全阐明,多认为是胰岛细胞受到自身免疫系统攻击而减少或损伤,从而导致一系列不可逆的破坏[12]。既往研究治疗对T1DM 胰岛细胞的影响主要集中在胰岛β细胞,针对胰岛α 细胞的研究较少[13]。本研究通过研究沙格列汀对胰岛α细胞增殖、凋亡的影响,以期为T1DM的临床治疗提供新思路。
本研究结果显示,模型组小鼠血糖水平较正常组显著升高,沙格列汀低、高剂量组小鼠血糖水平较模型组显著降低,提示沙格列汀可降低T1DM 小鼠血糖。GLP-1 是胰高血糖素原经剪切后的产物,作用于胰岛β 细胞可促进胰岛素的转录、合成与分泌,刺激胰岛β细胞的增殖和分化并抑制其凋亡,从而增加胰岛β 细胞数量[14-15]。胰高血糖素可促进血糖升高,正常情况下与胰岛素相互拮抗共同维持血糖稳定,胰高血糖素拮抗剂在临床应用中可有效维持血糖稳态、改善β细胞功能,延缓甚至逆转糖尿病病程[16]。王进红等[17]研究发现,沙格列汀可通过阻断GLP-1 降解调节胰岛素分泌,加强机体对葡萄糖的利用及对血糖水平的控制。本研究结果显示,与正常组相比,模型组小鼠血清GLP-1水平显著降低,胰高血糖素水平显著升高;与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠血清GLP-1水平显著升高,胰高血糖素水平显著降低,提示T1DM 的发生与GLP-1、胰高血糖素水平有关,沙格列汀治疗T1DM 可能通过影响GLP-1、胰高血糖素实现,与胰岛素作用效果一致,且高剂量沙格列汀治疗效果优于胰岛素。
胰岛α 细胞可通过分泌GLP-1 进而影响胰岛α细胞的增殖及功能,也可通过分泌胰高血糖素加速糖尿病进展[18-19]。本研究结果显示,与正常组相比,模型组小鼠胰岛α 细胞增殖指数显著升高,凋亡指数显著降低;与模型组相比,胰岛素组、沙格列汀低、高剂量组小鼠胰岛α细胞增殖指数显著降低,凋亡指数显著升高。Ki-67、Bax分别与细胞增殖、凋亡有关[20]。与正常组相比,模型组小鼠胰岛α 细胞中Ki-67 蛋白水平显著升高,Bax 蛋白水平显著降低;与模型组相比,胰岛素组、沙格列汀低剂量组、沙格列汀高剂量组小鼠胰岛α 细胞中Ki-67 蛋白水平显著降低,Bax 蛋白水平显著升高,提示T1DM 可导致小鼠胰岛α 细胞增殖、凋亡异常,沙格列汀、胰岛素均可通过抑制T1DM 小鼠胰岛α 细胞增殖并诱导其凋亡,推测沙格列汀可能通过影响胰岛α细胞增殖、凋亡进而影响GLP-1、胰高血糖素分泌,最终导致胰岛β细胞功能恢复正常,达到治疗T1DM的目的。
综上所述,沙格列汀可降低T1DM 小鼠血糖水平,可能是通过促进胰岛α细胞凋亡并抑制其增殖,进而促进血清GLP-1 表达,并抑制胰高血糖素表达发挥作用的。