环磷酰胺激活过氧化物酶体增殖物激活受体-γ介导细胞自噬减轻糖尿病肾病小鼠肾损伤的机制
2021-09-22李安琪余晓洋张文静王志刚张亚莉
李 燕,李安琪,余晓洋,张文静,吕 佳,王志刚,张亚莉,陈 蕾
(1西安交通大学第一附属医院肾脏病医院肾脏内科,西安 710061;2西安交通大学第一附属医院呼吸科;3西安交通大学第一附属医院血液净化科;*通讯作者,E-mail:chl1221@hotmail.com)
糖尿病肾病(diabetic nephropathy,DN)是发生在糖尿病患者中的肾脏性疾病,也是2型糖尿病患者死亡的主要原因之一。据统计,大约有40%的2型糖尿病患者最终发展为DN,并演变为终末期肾脏病,同时还增加了心血管类疾病的发生率[1,2]。尽管目前已开发出可控制DN的药理策略,但仍需全面了解调节DN进展的相关机制,探究更安全有效的方法来延缓DN进程,这也是当前DN研究的重点与热点内容。
环磷酰胺是一种烷化剂,已广泛应用于治疗人类和动物的多种类型癌症,具有抗炎和免疫抑制作用,并且能够有效杀死进入循环周期的细胞[3]。此外,环磷酰胺对肾病及肾病综合征具有治疗作用,可降低慢性肾小球炎症患者的BUN、SCr、MMP-2及24 h尿蛋白水平[4],但其在DN中的作用机制尚不明确。过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptors-γ,PPAR-γ)是细胞核激素受体,也属于核转录超家族成员之一,在调节脂质体和葡萄糖稳态中发挥关键作用,并已有研究发现,PPAR-γ能够抑制肝脏的纤维化[5,6]。本研究通过环磷酰胺作用于DN小鼠,并使用PPAR-γ抑制剂进行干预,从而探讨环磷酰胺调控PPAR-γ改善DN小鼠肾损伤的相关作用机制,以期为DN的诊治研究提供实验依据与思路。
1 材料与方法
1.1 实验动物
健康SPF级C57小鼠,体质量18-23 g,雌雄各半,由医院实验动物中心饲喂,饲养温度设置为(23±2)℃,12 h光照/黑暗交替循环,期间自由进食、饮水。本研究获得医院动物伦理委员会批准(批号:2020-0034)。
1.2 药品、主要材料与试剂
环磷酰胺注射液购自江苏恒瑞医药有限公司(批号:07051521),PPAR-γ抑制剂GW9662和链脲佐菌素购自美国Sigma公司,24 h尿蛋白(24 h UP)、血糖(BG)、甘油三酯(TRIG)、胆固醇(CHOL)、血肌酐(SCr)以及尿素氮(BUN)检测试剂盒购自南京建成生物技术研究所,ROS荧光探针-二氢乙啶(DHE)检测试剂盒购自北京百奥莱博生物科技公司,HE染色试剂盒和Epon812包埋树脂试剂盒购自北京索莱宝科技有限公司,Masson染色试剂盒购自北京博奥森生物技术有限公司,兔源抗体Beclin1、p62、LC3Ⅰ、LC3Ⅱ与大鼠源抗体PPAR-γ、AMPK、p-AMPK、mTOR、p-mTOR购自英国Abcam公司,抗体GAPDH和辣根过氧化物酶标记的山羊抗兔或山羊抗鼠购自北京中杉金桥生物技术公司,BCA蛋白检测试剂盒和增强型ECL发光液购自上海碧云天生物技术公司。
1.3 动物造模
将实验小鼠适应性饲养1周后,实验组小鼠给予高脂高糖饲料喂养,对照组小鼠以基础饲料喂养,连续喂养8周。8周后,所有小鼠禁食不禁水12 h,实验组小鼠以35 mg/kg的剂量腹腔注射链脲佐菌素-柠檬酸钠混合溶液,对照组小鼠同时注射等量的柠檬酸钠溶液。在注射3 d后,通过尾静脉采血检测小鼠血糖水平,以血糖大于16.7 mmol/L为糖尿病模型制备成功标准。在注射2周后收集小鼠尿液,检测24 h尿蛋白,蛋白含量大于30 mg/24 h即为阳性,若3次检测均为阳性时,则判定为DN小鼠模型构建成功。
1.4 动物分组与给药
取造模成功的45只DN小鼠,按照随机数字表法分为3组:模型组、环磷酰胺组、环磷酰胺+PPAR-γ抑制剂组,每组15只,另取对照组小鼠15只。环磷酰胺组小鼠以30 mg/kg的剂量腹腔注射环磷酰胺(溶解于生理盐水中),环磷酰胺+PPAR-γ抑制剂组小鼠以30 mg/kg的剂量腹腔注射环磷酰胺,同时按1 mg/kg的剂量腹腔注射PPAR-γ的抑制剂GW9662,对照组和模型组小鼠同时注射等量生理盐水,连续10周。10周后处死各组小鼠前测量体质量,收集24 h尿液,并采集静脉血,腹腔注射戊巴比妥钠(30 mg/kg)麻醉并通过颈椎脱臼法处死各组小鼠,切取小鼠双侧肾脏,清洗干净后称质量,将一部分肾组织置于液氮中冷冻后保存于-80 ℃冰箱,剩余部分固定于4%多聚甲醛溶液中。
1.5 全自动生化仪检测各项生化相关指标
末次给药结束后,收集采集的各组小鼠24 h尿液和静脉血,将采集的血液置于室温下2 h,通过4 ℃低温离心机以4 000 r/min离心15 min,获取上清液,进行各项血指标测定。应用全自动生化仪检测各组小鼠24 h尿蛋白(24 h-urinary proteins,24 h UP)、血糖(blood glucose,BG)、甘油三酯(triglyce-ride,TRIG)、胆固醇(cholesterol,CHOL)、血肌酐(serum creatinine,SCr)和尿素氮(blood urea nitrogen,BUN)的水平,所有检测步骤严格按照试剂盒说明书执行。
1.6 HE染色观察肾组织病理形态学
取在4%多聚甲醛固定好的肾组织样品,进行常规石蜡包埋处理,切成5 μm的组织切片,进行HE染色。将肾组织石蜡切片经过二甲苯脱蜡、梯度乙醇脱水后,加入苏木精染色5 min,在流水下冲洗干净,加入伊红染色3 min,再次通过流水冲洗干净,程序化脱水、透明,自然晾干,中性树胶封片,通过光学显微镜观察各组小鼠肾组织病理形态变化并拍摄图像。
1.7 Masson染色检测肾组织纤维化程度
取制备好的肾组织石蜡切片,进行脱蜡脱水处理,加入weigert铁苏木素染色10 min,再用1%盐酸乙醇分化,流水冲洗干净后,加入Masson染液进行反蓝,蒸馏水洗涤干净,加入丽春红酸性品红染色5 min,接着用1%磷钼酸水进行分化后,加入苯胺蓝染色5 min,1%冰醋酸水溶液浸泡洗涤切片,程序化脱水、透明,中性树胶封片,通过光学显微镜观察各组小鼠肾组织染色情况并拍摄图像。
1.8 透射电子显微镜观察肾组织自噬体
取小鼠肾组织样品,切成大小为1.0 mm3的小方块,并固定在PBS缓冲液稀释的3%戊二醛中,4 ℃过夜。接着使用1%锇酸固定1 h,不同浓度丙酮(50%-90%)进行脱水,Epon812包埋。取包埋块,光镜下进行超薄切片,采用醋酸铀和枸橼酸铅进行双重染色,在Zeiss 910透射电子显微镜下观察肾组织自噬发生情况并拍摄图像。
1.9 ROS荧光探针-DHE检测肾组织ROS含量
取制备好的肾组织包埋块,在冰冻切片机上切成5 μm厚的切片,将ROS荧光探针DHE滴加于切片上,37 ℃下孵育30 min,通过荧光显微镜观察小鼠肾组织内ROS荧光强度并拍摄图像。在细胞内DHE被ROS氧化形成氧化乙啶,产生红色荧光,利用Image-ProPlus 6.0图像分析软件量化荧光强度。
1.10 Western blot检测肾组织PPAR-γ、自噬及AMPK/mTOR信号通路相关蛋白表达
取保存在-80 ℃冰箱中的肾组织,无菌条件下剪碎后加入液氮进行研磨,加入预冷的RIPA缓冲液进行裂解,提取总蛋白样品,BCA法检测蛋白浓度。取等量各组蛋白样品,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,电转移至PVDF膜,室温下在5%脱脂奶粉中封闭2 h,加入稀释的一抗抗体Beclin1(1 ∶1 000)、p62(1 ∶1 000)、LC3Ⅰ(1 ∶1 000)、LC3Ⅱ(1 ∶1 000)、PPAR-γ(1 ∶1 000)、AMPK(1 ∶1 000)、p-AMPK(1 ∶1 000)、mTOR(1 ∶1 000)、p-mTOR(1 ∶1 000),4 ℃下共孵育过夜。次日,弃去一抗工作液,TBST洗膜后,加入对应的辣根过氧化物酶标记的二抗抗体(1 ∶5 000),室温下共孵育1 h,TBST再次洗膜后,滴加增强型ECL液显色曝光,凝胶成像系统拍照,通过Image-ProPlus 6.0图像分析软件对各蛋白条带进行分析,以GAPDH作为内参蛋白。
1.11 统计学分析
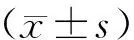
2 结果
2.1 各组小鼠体质量与肾脏质量比较
各组小鼠体质量和肾脏质量检测结果显示,与对照组比较,模型组小鼠体质量和肾脏质量均显著减少(P<0.05);环磷酰胺组小鼠的体质量和肾脏质量较模型组均显著增加(P<0.05),而与环磷酰胺组比较,环磷酰胺+PPAR-γ抑制剂组小鼠的体质量和肾脏质量均显著减少(P<0.05,见图1)。
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与环磷酰胺组比较,&P<0.05图1 各组小鼠体质量与肾脏质量比较Figure 1 Comparison of body mass and kidney mass of mice in each group
2.2 各组小鼠24 h UP和血生化指标比较
各生化指标检测结果显示,与对照组比较,模型组小鼠24 h UP水平显著升高(P<0.05),血清BG、TRIG、CHOL、SCr和BUN水平也显著升高(P<0.05);而治疗10周后,相较于模型组,环磷酰胺组小鼠24 h UP水平显著降低(P<0.05),同时,血清BG、TRIG、CHOL、SCr和BUN水平显著降低(P<0.05);而环磷酰胺+PPAR-γ抑制剂组小鼠24 h UP水平与血清BG、TRIG、CHOL、SCr及BUN水平较环磷酰胺组均显著升高(P<0.05,见表1)。

表1 各组小鼠24 h UP与血生化指标的水平比较
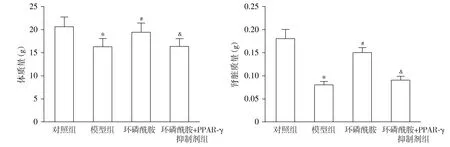
2.3 各组小鼠肾组织病理形态学观察
HE染色结果显示,对照组小鼠肾组织中肾小球、肾小管结构正常,未见明显病变现象;模型组小鼠肾组织内肾小管萎缩、坏死,出现空泡样,肾小球基底膜增厚,系膜区增多,并伴随大量的炎性细胞浸润;环磷酰胺组小鼠肾小管萎缩、坏死以及肾小球基底膜增厚等现象较模型组明显减轻,炎性细胞浸润减少;而环磷酰胺+PPAR-γ抑制剂组小鼠肾组织病变现象与模型组较一致,未见明显改善(见图2)。
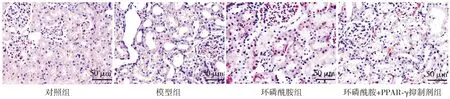
图2 HE染色观察小鼠肾组织病理形态学 (×400)Figure 2 Pathological morphology of mouse kidney tissue by HE staining (×400)
2.4 各组小鼠肾组织纤维化程度比较
Masson染色结果显示,对照组小鼠肾组织内蓝染面积少,胶原沉积少,说明肾组织纤维化程度小;与对照组比较,模型组小鼠肾组织内蓝染面积增多,胶原沉积增加,纤维束增粗,肾组织纤维化明显;相较于模型组,环磷酰胺组小鼠组织内蓝染面积减少,胶原沉积有所下降,肾组织纤维化程度减小;而与环磷酰胺组比较,环磷酰胺+PPAR-γ抑制剂组小鼠肾组织蓝染面积增多,肾组织纤维化现象较为明显(见图3)。

箭头显示肾组织内明显的蓝染区域图3 Masson染色观察小鼠肾组织纤维化程度 (×400)Figure 3 Observation of the degree of fibrosis in mouse kidney tissue by Masson staining (×400)
2.5 各组小鼠肾组织足细胞自噬情况
通过透射电子显微镜观察到,对照组小鼠肾组织足细胞可见较多的自噬体与凋亡小体,说明正常情况下肾组织足细胞自噬程度较高;模型组小鼠足细胞自噬体与凋亡小体较对照组则明显减少;而环磷酰胺组小鼠足细胞自噬体与凋亡小体较模型组明显增多,说明环磷酰胺能够促进足细胞自噬;环磷酰胺+PPAR-γ抑制剂组小鼠可见少量自噬体,与模型组比较无明显变化(见图4)。
黄色三角箭头所指为自噬体图4 透射电子显微镜观察肾组织自噬 (×10 000)Figure 4 Observation of autophagy in kidney tissue under transmission electron microscope (×10 000)
2.6 各组小鼠肾组织ROS含量比较
DHE荧光染色检测结果显示,模型组小鼠肾组织经DHE荧光染色后,其ROS荧光强度显著高于对照组(P<0.05);与模型组比较,环磷酰胺组小鼠肾组织ROS荧光强度则显著下降(P<0.05);而相较于环磷酰胺组,环磷酰胺+PPAR-γ抑制剂组小鼠肾组织ROS荧光强度显著升高(P<0.05,见图5)。
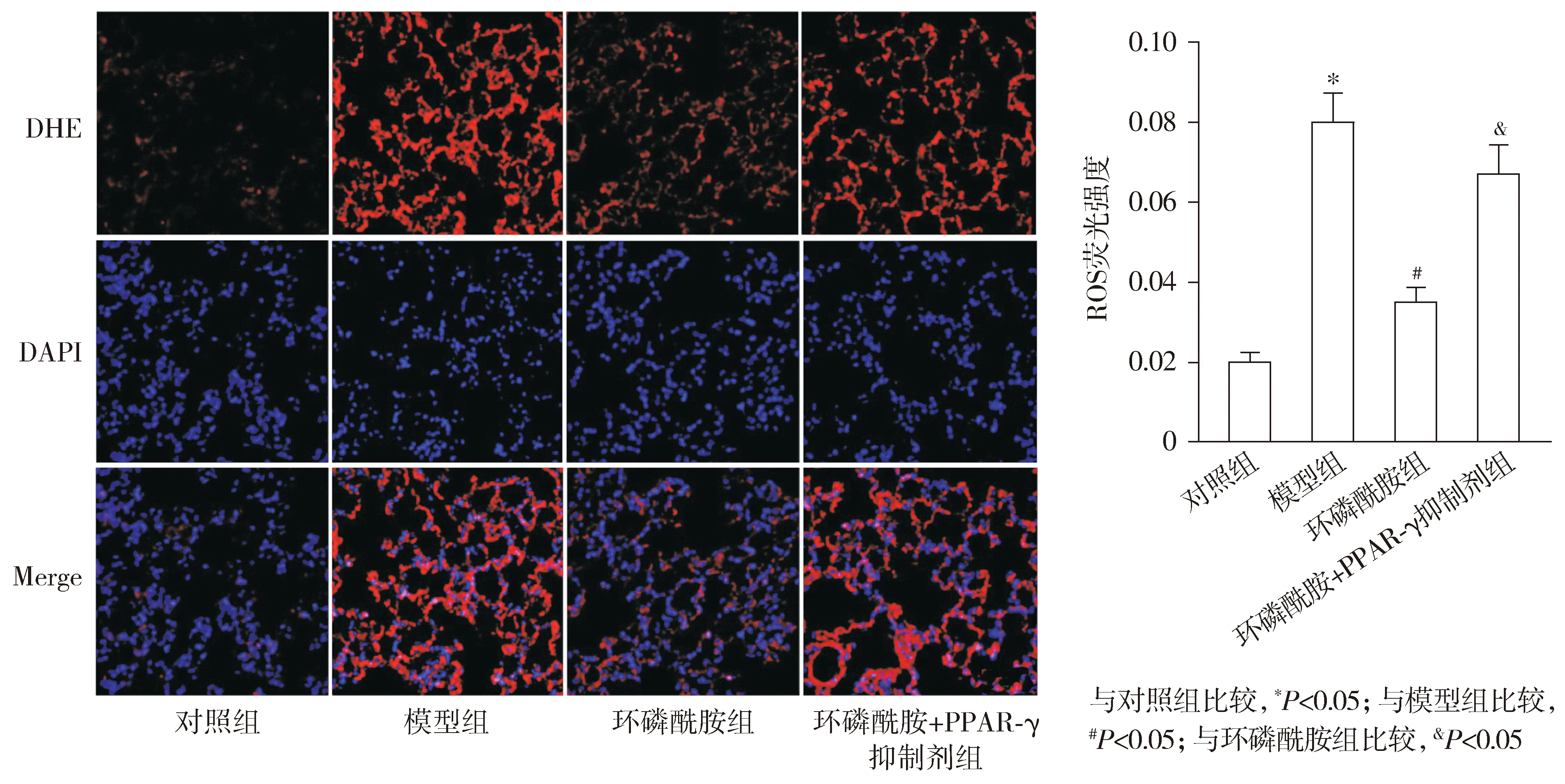
图5 DHE荧光染色检测小鼠ROS生成 (×400)Figure 5 ROS level in mice by DHE fluorescent staining (×400)
2.7 各组小鼠肾组织PPAR-γ蛋白、自噬相关蛋白与AMPK/mTOR信号通路相关蛋白表达比较
Western blot检测结果显示,与对照组比较,模型组小鼠肾组织PPAR-γ、Beclin-1蛋白表达与LC3Ⅱ/LC3Ⅰ比值均显著下调,P62蛋白表达显著上调(P<0.05);与模型组比较,环磷酰胺组小鼠肾组织PPAR-γ、Beclin-1蛋白表达与LC3Ⅱ/LC3Ⅰ比值均显著上调,P62蛋白表达显著下调(P<0.05);而相较于环磷酰胺组,环磷酰胺+PPAR-γ抑制剂组小鼠肾组织PPAR-γ、Beclin-1蛋白表达与LC3Ⅱ/LC3Ⅰ比值则显著下调,同时,P62蛋白表达显著上调(P<0.05,见图6)。
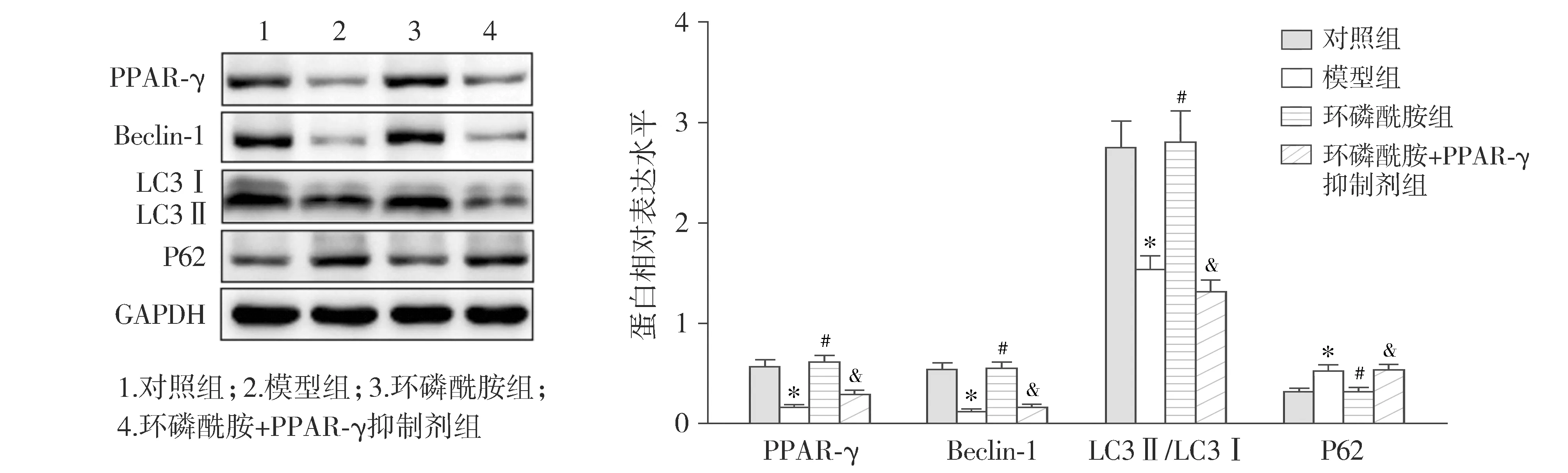
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与环磷酰胺组比较,&P<0.05图6 Western blot检测小鼠肾组织PPAR-γ蛋白与自噬相关蛋白表达Figure 6 Expression of PPAR-γ protein and autophagy-related protein in mouse kidney tissue by Western blot
通过检测AMPK/mTOR信号通路相关蛋白表达发现,模型组小鼠肾组织p-AMPK/AMPK比值较对照组显著下降,p-mTOR/mTOR比值则显著升高(P<0.05);与模型组比较,环磷酰胺组肾组织p-AMPK/AMPK比值显著升高,p-mTOR/mTOR比值则显著下降(P<0.05);相较于环磷酰胺组,环磷酰胺+PPAR-γ抑制剂组肾组织p-AMPK/AMPK比值较对照组显著下降,而p-mTOR/mTOR比值显著升高(P<0.05,见图7)。
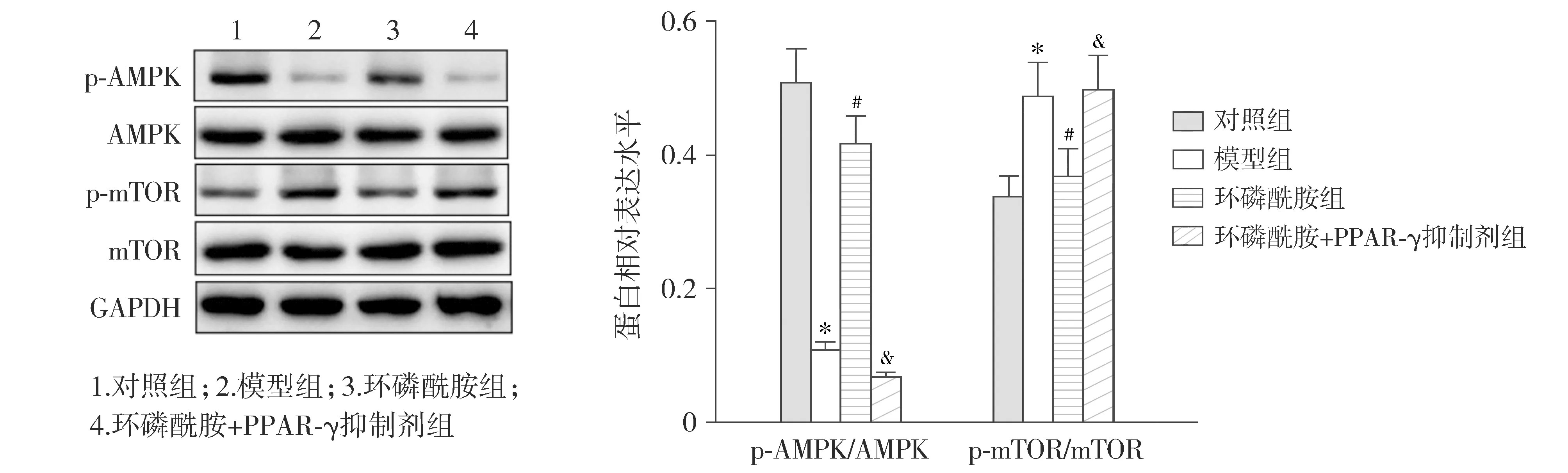
与对照组比较,*P<0.05;与模型组比较,#P<0.05;与环磷酰胺组比较,&P<0.05图7 Western blot检测小鼠肾组织AMPK/mTOR信号通路相关蛋白表达Figure 7 Expression of AMPK/mTOR signaling pathway related protein expression in mouse kidney tissue by Western blot
3 讨论
DN是1型和2型糖尿病患者肾小球和肾小管病变引起的一种频繁且复杂的长期性微血管并发症。DN的主要病理特征是肾小球滤过率降低,肾小球硬化,肾小管间质纤维化和肾小管上皮细胞损伤[2]。由于DN具有隐匿性发作的特点,因此很难在疾病早期进行检测和诊断。然而,肾脏病变是不可逆的,当出现某些症状时最终发展为肾功能衰竭的几率很大[7]。因此,探究DN的早期检测手段和靶向治疗方法对于治疗或缓解DN肾损伤具有重要意义。本研究通过模拟2型糖尿病肾病的自然病程建模,探究环磷酰胺减轻DN小鼠肾损伤的作用,进一步明确环磷酰胺在DN中相关调控机制,为研究DN提供一定的实验依据。
环磷酰胺作为一种抑制细胞增殖的烷化剂,常用于治疗不同类型的癌症、器官移植和自身免疫性疾病[8]。环磷酰胺会触发次级淋巴器官的特定肠道菌群,并通过刺激抗肿瘤细胞因子例如干扰素-γ(IFN-γ)和白细胞介素-17(IL-17)的产生来激活抗肿瘤免疫力[9],例如Wong等[10]报道指出,连续口服环磷酰胺对卵巢癌、原发性腹膜癌和输卵管癌的化疗患者均起到了一定的缓解作用,且未发现明显的副作用。环磷酰胺在增殖性肾脏病中应用广泛,且近年来在糖尿病肾病中的作用机制也逐渐被揭示,前期我们的研究[11]表明了环磷酰胺能够抑制DN大鼠肾组织中单核细胞趋化因子蛋白-1(MCP-1)与生长因子β1(TGF-β1)表达,从而缓解DN大鼠肾损伤。PPAR-γ可促进脂肪生成,并调节脂肪细胞分泌的蛋白质和脂肪细胞因子(如瘦素和脂联素)的表达,以此来控制脂质代谢和脂肪细胞分化,从而降低脂毒性。研究表明,激活PPARγ可通过抑制内质网应激和改善胰岛素敏感性来治疗糖尿病,并具有治疗DN的潜在作用[12,13]。本研究结果显示,DN小鼠通过环磷酰胺治疗后,肾损伤现象得到了明显改善,同时检测到肾组织内PPAR-γ表达提高,而经过环磷酰胺和PPAR-γ抑制剂共同作用的DN小鼠的肾组织损伤未发生改变,由此推测,环磷酰胺可能通过激活PPAR-γ发挥对DN小鼠肾组织的保护作用。
氧化应激是DN的重要病理机制,高血糖是在氧化应激中促进多余活性氧(ROS)生成的主要危险因素。ROS具有不成对电子或原子的氧衍生分子,包括超氧阴离子、过氧化氢、单线态氧和一氧化氮自由基等,参与细胞的生长、凋亡、衰老及多种生理病理过程。而过量的ROS会产生毒性作用,导致脂质过氧化和MDA形成,破坏机体的氧化平衡状态[14]。ROS刺激DN中包括纤连蛋白和Ⅳ型胶原细胞外基质蛋白的积累,这将会导致肾小球硬化和肾小管间质纤维化[15]。本研究结果显示,经过环磷酰胺治疗DN小鼠后,其肾组织内ROS水平异常升高的现象受到了明显抑制。肾浸润或内源性细胞异常会产生过量ROS,并与生物分子发生反应,从而引发肾损伤和肾功能障碍。因此,清除组织内多余的ROS是DN治疗的有效方法。
自噬是一种细胞内自我修复机制,能够消除降解变性的蛋白质和受损细胞器,维持细胞稳态。足细胞具有较高的自噬基础水平,这对于其应激适应具有至关重要的作用[16]。糖尿病患者体内营养和能量过量会抑制自噬,并使足细胞出现功能障碍和细胞凋亡,进而引起一系列生理病理变化[17]。本研究通过检测发现,DN小鼠肾组织Beclin-1蛋白表达、LC3Ⅱ/LC3Ⅰ比值均明显下降,P62蛋白表达则明显上升,说明自噬通量受损,而经过环磷酰胺治疗的DN小鼠肾组织自噬水平得以提高,表现为肾组织Beclin-1蛋白表达与LC3Ⅱ/LC3Ⅰ比值上升,P62蛋白表达下降。
AMP激活的蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路参与多种疾病的发生发展过程。多项研究表明,AMPK/mTOR信号通路与细胞自噬相关。细胞接受外界刺激时,AMP/ATP水平升高并激活AMPK,并增强了对其下游蛋白mTOR的抑制作用,而mTOR是介导自噬发生的关键蛋白,可调节相关途径进而抑制细胞自噬[18]。本研究结果表明,经过环磷酰胺治疗的DN小鼠肾组织内p-AMPK/AMPK比值升高,而p-mTOR/mTOR比值下降,说明环磷酰胺通过调控AMPK/mTOR信号通路影响自噬从而发挥作用。
综上,本实验结果表明了环磷酰胺通过激活PPAR-γ促进DN小鼠肾组织足细胞发生自噬,清除过量的ROS,改善肾损伤现象,该作用机制可能与AMPK/mTOR信号通路有关。然而,长期或过量使用环磷酰胺也会增加癌变的风险尤其在膀胱癌,因此,如何更好地将环磷酰胺运用于DN临床治疗中,还需要大规模较全面的研究证实。
