RYGB手术对2型糖尿病大鼠的肝脂质代谢途径及关键酶的影响
2021-09-22王述进刘宋芳
齐 婷,王述进,牛 瑜,刘宋芳,马 磊,杨 华,冯 佳
(西安市第九医院内分泌科,西安 710054;*通讯作者,E-mail:66248765@qq.com)
肥胖是一种全球性流行病,全球超过6.5亿人受到影响;营养过剩是导致2型糖尿病(type 2 diabetes,T2DM)的主要诱因[1]。研究表明,非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)在普通人群中的患病率为2%-44%,在T2DM患者中的患病率为42.6%-69.5%[2]。T2DM是一种代谢疾病,其特征为高血糖症和胰岛素抵抗,与血脂代谢紊乱相关[3]。胰岛素抵抗是肥胖、T2DM和NAFLD的常见发病机制,尤其与脂肪代谢紊乱有关[4]。胰岛素抵抗通过增加胰腺β细胞的胰岛素分泌来补偿;但是,由于最终补偿失败,而导致T2DM的发展[5]。T2DM中β细胞质量和功能的丧失很大程度上导致血糖控制的逐步恶化和对T2DM中胰岛素治疗的依赖性增加[6]。
同时,脂质对于作为能量来源的β细胞,以及生物膜的构建单元和信号分子是必不可少的。脂肪酸在β细胞中具有独特的功能性作用,因为它们会急剧增加葡萄糖刺激的胰岛素分泌[7]。Roux-en-Y胃旁路手术(Roux-en-Y gastric bypass,RYGB)能有效治疗肥胖T2DM患者的脂代谢紊乱,降低肝脏脂质毒性,改善肝脏胰岛素抵抗,延缓甚至逆转NAFLD[8,9]。然而,RYGB减少肝脏脂肪堆积的机制尚不清楚。
研究表明,RYGB手术4周后,肝脏自噬相关蛋白LC3Ⅱ/LC3Ⅰ水平升高,选择性自噬连接蛋白P62降低,自噬活性增强,肝内脂肪堆积减少,这提示RYGB可能通过上调自噬活性来减轻肝脏脂质毒性[10]。本研究进一步观察了在经过RYGB手术2,4,8周后,肥胖T2DM大鼠肝脏胰岛素敏感性及脂肪合成、分泌和分解代谢途径的变化,重点探讨了RYGB降低肝脏脂质毒性、改善肝脏胰岛素抵抗和抑制NAFLD的机制。
1 材料和方法
1.1 材料
链脲佐菌素(S0130,Sigma-Aldrich,美国);柠檬酸(251275,Sigma-Aldrich,美国);戊巴比妥钠(P0500000,北京迈瑞达科技有限公司);美洛昔康(1379401,西宝生物科技(上海)股份有限公司);甘油三酯(TG)含量检测试剂盒(BC0625,北京索莱宝科技有限公司);PierceTMBCA蛋白分析试剂盒(A53225,Thermo ScientificTM,美国);胎牛血清(16140071,GibcoTM,美国);DMEM(12491015,GibcoTM,美国);氯喹(C843545,上海麦克林生化科技有限公司);MHY1485(HY-B0795,MedChemExpress,美国);exendin-4(HY-13443,MedChemExpress,美国)。DGAT2(PA5-26690,Invitrogen,美国);p-HSL(4137,Cell Signaling,美国);ATGL(2138,Cell Signaling,美国);MTP(ab75316,Abcam,英国);LC3Ⅰ/Ⅱ(4108,Cell Signaling,美国);p62(3912,Cell Signaling,美国);mTOR(2972,Cell Signaling,美国);p-mTOR(2971,Cell Signaling,美国);双能X线骨密度仪(苏械注准20182061513,徐州品源电子科技有限公司)。
1.2 实验动物及分组
4周龄雄性SD大鼠40只购自西安交通大学动物实验中心(SCXK(陕)2020-001),体质量为180-200 g。所有动物实验均取得本院伦理委员会的批准(编号:No.2019-11023),且动物实验人员均经过培训并经伦理委员会的认可后进行操作。所有动物都饲养于单独的笼子,其生活环境:温度(24±2)℃,每天12 h的光/暗,标准的颗粒饲料喂养,饮用水充足,实验前适应性饲养1周。本研究共分为:正常对照组(n=10,control组)、糖尿病模型组(n=10,DM组)、糖尿病假手术组(n=10,DM+sham组)和RYGB手术组(n=10,RYGB组)。糖尿病模型组、糖尿病假手术组和RYGB组大鼠均接受高脂肪饮食(40%脂肪、18%蛋白质和42%碳水化合物),饲养6周。糖尿病模型组、糖尿病假手术组和RYGB组大鼠于6周末进行尾静脉注射小剂量链脲佐菌素(25 mg/kg),大鼠空腹血糖的浓度大于16.7 mmol/L并持续4周表示糖尿病大鼠模型造模成功(造模成功率为90%,死亡率为5%),当血糖明显升高(超过33.3 mmol/L),则暂停1次注射。这三组大鼠的血糖水平通过血糖仪进行每周1次的检测,其降糖治疗方法采用暂停补糖或注射胰岛素(中性鱼精蛋白锌胰岛素,每次2-3 U,持续3 d)。正常对照组大鼠则接受标准饮食(18%脂肪、25%蛋白质和57%碳水化合物),并采用相同剂量的0.1 mol/L柠檬酸缓冲液做对照处理。
1.3 手术动物模型构建
糖尿病假手术组和RYGB组大鼠在术前禁食24 h,然后腹腔注射1%戊巴比妥钠溶液(4.5 ml/kg)麻醉。RYGB组大鼠采用2-0丝线双重结扎远端胃,形成约20%的胃袋;横断小肠形成15 cm的胆胰肢、10 cm的消化肢和33 cm的共同通道。胃空肠和空肠吻合术采用5-0丝线间断缝合,肌层和皮肤用4-0丝线缝合。糖尿病假手术组大鼠术前和术后接受与RYGB组大鼠相似的护理,胃肠道切口采用与RYGB大鼠模型相同处理,切口在原横断点重新吻合。手术后,糖尿病假手术组和RYGB组大鼠均皮下注射约25 ml/kg的生理盐水以防止脱水,然后每隔8 h皮下注射美洛昔康1 mg/kg,持续24 h。术后0-8周定期每周测量大鼠体质量、摄食率和血糖。术后8周采取断头法处死各组大鼠,收集肝组织,保存于-80 ℃做下一步分析。
1.4 肝脏胰岛素敏感性指数测定
禁食后,麻醉大鼠,放置导管,植入右侧颈内静脉输液,左侧颈动脉采血。大鼠禁食12 h后,经颈静脉导管注入胰岛素和20%葡萄糖。每隔5 min测量一次动脉血糖,并调整葡萄糖输注速率以维持血糖浓度的稳定。[6-3H]葡萄糖(20 μCi/min推注+0.4 μCi/min输注)用于评估内源性葡萄糖的产生。以肝脏胰岛素敏感性指数(hepatic insulin sensitivity index, HISI)表示肝脏胰岛素敏感性,HISI=1/(肝脏葡萄糖产量×空腹胰岛素)。术后0-8周定期每周采集各组大鼠血液以计算肝脏胰岛素敏感性指数。
1.5 大鼠全身成分测定及肝组织脂质含量测定
采用双能X线骨密度仪对大鼠进行测量[11],所有大鼠在扫描前禁食和镇静。扫描结束后,并通过以下公式评估每个大鼠体脂含量和去脂体质量情况(脂肪质量=体质量×体脂率,去脂体质量=体质量-脂肪质量)。术后0-8周定期每周测定各组大鼠的体脂含量和去脂体质量指标,分别在术后2周、4周和8周断头法处死各组大鼠3只并分离和收集大鼠肝组织。取肝组织标本在3%甲醛中固定过夜,用去离子水冲洗3次(每次30 s)去除多余甲醛,然后将标本包埋于Tablet-Tek最佳切割复合物中,切片为7 μm,并进行油红O脂质染色,用Image J软件对肝细胞大小和油红O染色面积进行定量。使用甘油三酯(TG)含量检测试剂盒测量肝脏甘油三酯水平。在冰浴条件下,用10倍体积的无水乙醇机械匀浆,从冰冻的基础组织中提取肝组织;去除有机相和水相,样品在2 500 r/min下离心15 min,取小等分(10-30 μl)测定甘油三酯浓度。
1.6 蛋白质印迹法检测DGAT2、p-HSL、ATGL、MTP、LC3Ⅰ/Ⅱ、p62和mTOR蛋白表达水平
分别在术后2周、4周和8周分离和收集各组大鼠肝组织,并对分离的各组大鼠肝组织进行充分的液氮研磨破碎,通过RAPI裂解液对分离的大鼠肝组织进行裂解,然后通过BSA蛋白检测试剂盒对蛋白进行定量分析。使用10%蛋白分离胶进行SDS-PAGE(蛋白上样量为30 μg),待电泳结束后,转移至PVDF膜。随后,将膜与一抗DGAT2(1 ∶1 000)、p-HSL(1 ∶1 000)、ATGL(1 ∶1 000)、MTP(1 ∶1 000)、LC3I/II(1 ∶1 000)、P62(1 ∶1 000)、mTOR(1 ∶1 000)和p-mTOR(1 ∶1 000)于4 ℃过夜孵育。然后,使用TBST清洗膜3次,每次5 min;然后将膜与辣根过氧化物酶偶联的二抗IgG(1 ∶2 000)在室温下孵育1 h;使用TBST清洗膜3次,每次5 min后,通过增强化学发光检测系统并使用GE Image Quant 25 LAS4000 mini进行可视化蛋白带分析。
1.7 数据统计学分析
统计分析采用SPSS 20.0,定量数据以均数±标准差表示,两组间差异比较采用t检验分析,多组间差异比较采用单因素方差分析,两两比较差异采用LSD检验分析,P<0.05被认为差异具有统计学意义。
2 结果
2.1 RYGB明显改善大鼠身体机能各项指标
RYGB组大鼠空腹血糖水平在术后3周内持续下降,3周时接近control组,随后趋于稳定;DM+sham组大鼠无明显变化(见图1)。RYGB组大鼠体质量在术后3周内持续下降至最低点,随后趋于维持稳定状态(见图1)。RYGB组大鼠摄食率在术后1周内持续下降,随后升高逐渐趋于平稳(见图1)。与DM组和DM+sham组大鼠相比,RYGB组大鼠体脂含量在术后明显降低(P<0.05,见图1),去脂体质量差异无统计学意义(P>0.05,见图1);与control组大鼠相比,RYGB组大鼠体脂含量和去脂体质量在术后差异无统计学意义(P>0.05)。

与DM组相比,*P<0.05;与DM+sham组相比,#P<0.05图1 RYGB手术对大鼠身体机能指标的影响Figure 1 Effect of RYGB operation on the body function indexes of rats
2.2 RYGB明显增加肝脏胰岛素敏感性
油红O染色结果显示,术后2周,与DM+sham组相比,RYGB组大鼠的肝脏脂肪质量显著下降,中性脂质染色阳性百分率明显降低,脂滴大小和数量明显减少(P<0.05,见图2)。与DM组相比,DM+sham组大鼠肝脏甘油三酯含量差异无统计学意义(P>0.05);与DM+sham组相比,RYGB组大鼠肝脏甘油三酯含量显著降低(P<0.05);与DM+sham组比较,RYGB组大鼠肝脏胰岛素敏感性指数明显升高(P<0.05,见图2)。

与DM组相比,*P<0.05;与DM+sham组相比,#P<0.05图2 RYGB手术对大鼠肝脏胰岛素敏感性的影响Figure 2 Effect of RYGB operation on insulin sensitivity of rat liver
2.3 RYGB短时间促进水解酶活性并改善肝脏脂质蓄积
肝脂质代谢途径中关键酶表达水平Western blot检测结果显示,术后2周,与DM+sham组相比,RYGB组大鼠DGAT2和ATGL的表达水平均明显降低,而p-HSL和MTP的表达水平均明显升高(P<0.05,见图3A)。但在术后4周和术后8周,DGAT2、ATGL、p-HSL和MTP蛋白的表达水平在各组之间比较差异无统计学意义(P>0.05,见图3B和3C)。

与DM组相比,*P<0.05;与DM+sham组相比,#P<0.05图3 RYGB手术对肝脂代谢途径关键酶DGAT2、ATGL、p-HSL和MTP表达水平的影响Figure 3 Effect of RYGB operation on expression levels of key enzymes DGAT2, ATGL, p-HSL and MTP in the liver lipid metabolism pathway
2.4 RYGB促进肝脏自噬
Western blot实验结果显示,术后2周,与DM+sham组比较,RYGB组大鼠自噬相关蛋白LC3Ⅱ/LC3Ⅰ比值显著降低,P62蛋白表达水平显著降低(P<0.05);术后4周,与DM+sham组比较,RYGB组大鼠LC3Ⅱ/LC3Ⅰ比值显著升高,P62蛋白表达水平显著降低(P<0.05);术后8周,各组间自噬相关蛋白表达水平差异均无统计学意义(P>0.05,见图4)。
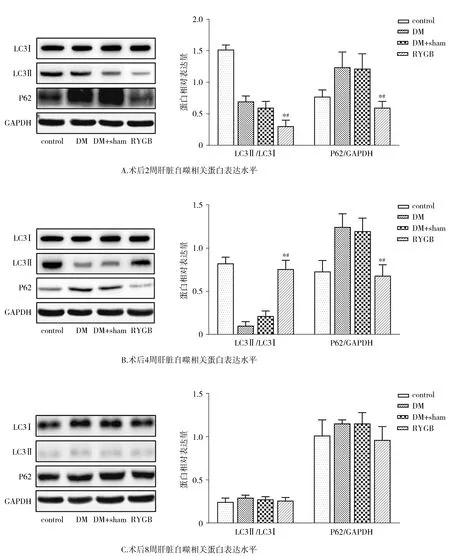
与DM组相比,*P<0.05;与DM+sham组相比,#P<0.05图4 RYGB手术对大鼠肝脏自噬相关蛋白LC3Ⅱ、LC3Ⅰ和P62表达水平的影响Figure 4 Effect of RYGB operation on expression levels of autophagy-related proteins LC3Ⅱ,LC3Ⅰand P62 in rat liver
2.5 RYGB抑制mTOR/p70S6K信号通路
Western blot检测mTOR和p70S6K的磷酸化结果显示,术后2周,与DM+sham组比较,RYGB组大鼠肝组织中磷酸化蛋白p-mTOR和p-p70S6K的表达水平均显著降低(P<0.05);术后4周,与DM+sham组比较,RYGB组大鼠肝组织中磷酸化蛋白p-mTOR和p-p70S6K的表达水平均明显降低(P<0.05);术后8周,各组大鼠肝组织中mTOR和p70S6K蛋白表达水平及其磷酸化水平差异均无统计学意义(P>0.05,见图5)。

与DM组相比,*P<0.05;与DM+sham组相比,#P<0.05图5 RYGB手术对mTOR和p70S6K蛋白磷酸化的影响Figure 5 Effect of RYGB operation on mTOR and p70S6K protein phosphorylation
3 讨论
RYGB已被报道在改善肝脏脂肪变性、炎性坏死和纤维化方面具有效果[12]。据报道,RYGB术后1年和5年,肝脏变性、炎症和纤维化明显改善,术后1年和5年肝组织学无明显差异[13]。本研究结果表明,RYGB治疗2周后,肥胖T2DM大鼠肝脏DGAT2和ATGL表达水平明显降低,而p-HSL和MTP表达水平明显增加。术后2周和4周,自噬相关蛋白LC3Ⅱ/LC3Ⅰ比值和P62蛋白表达水平均显著降低。这表明,RYGB在短时间内抑制脂肪合成并促进脂肪水解;同时,RYGB在这段时间内迅速降低肝脏TG含量并减轻肝脏胰岛素抵抗,通过激活自噬纠正肝脂代谢紊乱。
胰岛素抵抗通常被认为是NAFLD的起始因素[14],RYGB能显著改善肝脏胰岛素敏感性[15]。本研究结果表明,术后2周和4周,RYGB组大鼠肝脏胰岛素敏感指数明显高于DM+sham组。研究发现,术后肝脏脂肪变性明显改善,IR缓解程度与肝脏组织学改善密切相关[16]。本研究的油红O染色结果显示,RYGB治疗后大鼠肝细胞内脂滴体积减少,数量减少。术后2周和8周后,RYGB组大鼠肝脏甘油三酯(TG)含量分别比DM+sham组显著下降。这证明RYGB术后肝脏脂肪的短期下降在术后肝脂代谢紊乱的恢复中起关键作用。
微粒体甘油三酯转移蛋白(microsomal triglyceride transfer protein,MTP)主要分布于肝细胞和肠上皮细胞中,涉及VLDL组装和肝脏中TG分泌的关键脂质转运蛋白[16]。本研究结果表明,与DM+sham组相比,RYGB组术后2周大鼠肝脏DGAT2表达水平明显降低,而p-HSL和MTP蛋白表达水平明显增加。RYGB短期内抑制肝脏TG合成,刺激肝脏TG水解,但对肝脏TG分泌无影响。术后4周和8周时,DGAT2、P-HSL、ATGL和MTP在糖尿病模型组之间的表达差异无统计学意义。故推测RYGB手术通过抑制肝脏局部脂肪合成和上调肝脏局部脂肪动员来迅速减少脂肪在肝脏中的积聚。
自噬是细胞依赖溶酶体降解受损细胞器和大分子的过程[17]。自噬是由溶酶体等细胞器介导,涉及30多种相关蛋白;其中LC3被认为是自噬的标志物,LC3Ⅱ/LC3Ⅰ比值升高代表自噬的激活[18]。p62可将泛素化修饰的蛋白质转运到自噬小体,并且p62的聚集随着自噬被抑制而增加[19]。本研究结果表明,术后2周和4周,RYGB组大鼠LC3Ⅱ/LC3Ⅰ比值明显高于DM+sham组和DM组,而P62蛋白表达水平明显降低,这提示RYGB可能激活肝脏自噬功能;RYGB术后肝脏自噬的激活可能在短期内迅速降低肝脂,在长期减少肝脂蓄积中起重要作用。
近年来,RYGB对神经系统的影响已成为研究热点[20]。中枢神经系统,特别是下丘脑,通过神经肽和神经递质控制中枢并影响外周能量的动态平衡[21]。一些研究证实,在RYGB术后,可明显观察到组织器官及系统的变化[22]。肝脏脂肪代谢不仅受体液调节,还受神经系统的调节。研究发现,RYGB通过激活肝脂水解途径和抑制肝脂合成途径,从而迅速降低肝脂毒性并改善胰岛素敏感性[23]。据报道,杨梅和其他植物物种中存在的天然类黄酮异槲皮苷(ISO)对肿瘤细胞的增殖具有显著的抑制作用,ISO通过激活AMPK/mTOR/p70S6K途径抑制细胞活力和集落生长,激活凋亡途径,并触发自噬失调。RYGB对肝组织神经递质的影响以及术后神经系统对肝脂代谢的影响的研究报道较少。本研究结果表明,术后2周和4周,与DM+sham组比较,RYGB组大鼠肝组织中磷酸化蛋白p-mTOR和p-p70S6K的表达水平均显著降低。这些结果表明,RYGB激活了自噬,促进了脂质代谢,这可能与抑制mTOR/p70S6K信号通路有关。
