无血清悬浮培养MDCK-siat7e细胞的传代稳定性
2021-09-18张生琰吴元元孙燕刘鹏孙振鹏王革李薇
张生琰,吴元元,孙燕,刘鹏,孙振鹏,王革,李薇
兰州生物制品研究所有限责任公司中试研究室
甘肃省疫苗工程技术研究中心,甘肃兰州730046
犬肾上皮(Madin-Darby canine kidney,MDCK)细胞MDCK-siat7e是将人siat7e基因转染MDCK细胞后,经悬浮驯化所获得的适应悬浮培养的哺乳动物细胞系。MDCK-siat7e细胞克服了贴壁细胞规模化培养困难、操作复杂、难以放大的缺点,能够用于疫苗的研发及生产[1]。兰州生物制品研究所有限责任公司应用无血清无蛋白培养基cellhappy BD001(简称BD001)培养MDCK-siat7e细胞,在优化培养工艺的基础上能够获得理想的细胞密度,有望用于流感疫苗的研发及生产[2]。MDCK-siat7e细胞在传代培养的过程中有目的基因丢失的风险,这势必会造成细胞种群异质性的发生,使得细胞种群与起始细胞种群间存在差异,影响流感病毒在细胞上的易感性,另外还有成瘤性和致瘤性发生的风险,影响流感疫苗的研发[3]。因此,MDCK-siat7e细胞如用于大规模流感疫苗生产,需建立稳定的MDCKsiat7e细胞系,确定MDCK-siat7e细胞培养代次,才能为MDCK-siat7e细胞从摇瓶放大培养至规模化生产提供依据,但目前相关MDCK-siat7e细胞传代稳定性方面的研究较少。
本研究从细胞形态、生长曲线、生长代谢、siat7e基因表达量、成瘤性和致瘤性等方面进行了MDCKsiat7e细胞的传代稳定性研究,以期为MDCK-siat7e稳定细胞系的建立及MDCK-siat7e细胞在规模化放大中代次的确立提供实验依据。
1 材料与方法
1.1 细胞MDCK-siat7e细胞由美国国立卫生研究院(National Institutes of Health,NIH)惠赠,由兰州生物制品研究所第六研究室经摇瓶驯化无血清悬浮培养后,建立细胞库。
1.2 主要试剂及仪器 无血清无蛋白培养基cellhappy BD001(简称BD001)购自甘肃健顺生物科技有限公司;One Step SYBR PrimeScript RT-PCR kit购自日本TaKaRa公司;RNeasy Mini kit购自美国Qiagen公司;7500 Real time PCR system购自美国ABI公司;Bioprofile 400生化分析仪购自美国Nova Biomedical公司;CASY细胞计数分析仪购自德国INNOVATIS公司。
1.3 MDCK-siat7e细胞的传代培养 复苏工作细胞库细胞,检测细胞活率>95%时,按(0.8~1)×106个/mL接种至三角摇瓶,即为0代细胞,置37℃,5% CO2,20 r/min条件下培养。每日取样检测细胞密度及活率,每隔3~4 d传代1次,连续传代获得7、17、28及45代细胞。
1.4 不同代次MDCK-siat7e细胞的生长状况观察及生长曲线绘制 将0、7、17、28及45代MDCK-siat7e细胞在BD001培养基中按接种密度(0.7~1)×106个/mL进行培养,培养条件为:37℃,5% CO2浓度。连续培养9 d,培养期间不再添加培养基。每日取样计数并检测细胞活率。培养4 d时取样,于倒置显微镜下观察细胞生长状况,包括细胞形态、大小均匀性、是否聚团等。以培养时间为横坐标,活细胞数为纵坐标,绘制生长曲线。
1.5 不同代次MDCK-siat7e细胞各生长指标及生化指标的比较 计算并比较0、7、17、28及45代MDCKsiat7e细胞的比生长速率(μ)、葡萄糖比消耗率[Qi(Gluc)24h]、乳酸比生成率[Qi(Lac)24h]及氨比生成率[Qi(NH4+)24h]。
1.6 45代MDCK-siat7e细胞的成瘤性及致瘤性检测 委托中国食品药品检定研究院进行45代MDCKsiat7e细胞的成瘤性和致瘤性检测。依据《中国药典》三部(2015版)中《生物制品生产检定用动物细胞基质制备及检定规程》中相关规定,采用裸鼠体内接种法检测MDCK-siat7e细胞的成瘤性;采用细胞裂解物裸鼠体内接种法和细胞DNA裸鼠体内接种法检测MDCK-siat7e细胞的致瘤性。
1.7 不同代次MDCK-siat7e细胞中siat7e基因表达量的比较 采用qRT-PCR法,具体参考文献[4]进行。取细胞密度为1×106个/mL、细胞活率>95%的0、7、17、28及45代MDCK-siat7e细胞,用RNeasy Mini kit提取细胞总RNA,检测提取RNA的纯度及浓度,-80℃冻存备用。上游引物序列:5′-ATGAAGACCCTGCGCC-3′,下游引物序列:5′-TTAGAACACAGGTTTATTCTCAGG-3′,扩增片段大小为1 010 bp。引物设计及合成由生工生物工程(上海)股份有限公司完成。以不同代次的MDCK-siat7e细胞同一浓度的RNA为模板,采用One Step SYBR PrimeScript RTPCR kit检测siat7e基因表达量。PCR反应条件为:94℃预变性3 min;94℃变性15 s,55℃退火30 s,72℃延伸10 s,共35个循环;72℃再延伸10 min。以DEPC水为空白,GAPDH基因作为内参基因,采用△△Ct法按下式计算各代次细胞中siat7e基因表达量的相对倍数,即目的基因的量(2-△△Ct)。
△△Ct=(实验组目的基因Ct-实验组内参基因Ct)-(对照组目的基因Ct-对照组内参基因Ct)
1.8 细胞计数及细胞活率检测 应用CASY细胞计数分析仪进行细胞计数。按下式计算细胞比生长速率(μ),即细胞生长速率与培养基中细胞密度之比[5]。
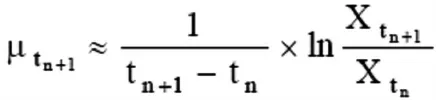
式中t为培养时间(d),tn和tn+1分别表示试验开始和结束时间(d);μtn+1为细胞在tn+1时刻的比生长速率(d-1);Xtn和Xtn+1分别为tn和tn+1时刻的活细胞密度(个/mL)。
1.9 葡萄糖、乳酸、氨含量检测 应用生化分析仪进行检测。计算营养物(葡萄糖)的比消耗率[Qi(Gluc)24h]和副产物乳酸[Qi(Lac)24h]和氨的比生成率[Qi(NH4+)24h][6]。
营养物(葡萄糖)的比消耗率,表示单位细胞在单位时间内消耗的营养物的量,按下式计算。

式中P表示营养物;CP表示营养物浓度(mmol/L),Cp,tn和Cp,tn+1分别为tn和tn+1时刻营养物浓度(mmol/L);Qp,tn+1表示在tn+1时刻营养物的比消耗速率[mmol/(L·h)]。
副产物(乳酸、氨)的比生成速率,表示单位细胞在单位时间内生成的代谢副产物的量,按下式计算。
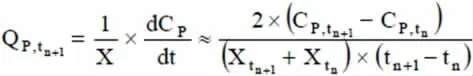
式中P表示副产物;CP表示副产物浓度(mmol/L),Cp,tn+1和Cp,tn分别为tn和tn+1时刻副产物浓度(mmol/L);Qp,tn+1表示在tn+1时刻副产物的比生成速率[mmol/(L·h)]。
1.10 统计学分析 采用SPSS 19.0软件包进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用F检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同代次MDCK-siat7e细胞的形态观察 显微镜下观察显示,5个不同代次的MDCK-siat7e细胞均呈圆形,细胞边缘清晰,细胞均匀分散于培养液中,无聚团现象,呈悬浮生长状态,生长状态良好。见图1。

图1 不同代次MDCK-siat7e细胞的形态观察(×40)Fig.1 Morphologies of MDCK-siat7e cells of various passages(×40)
2.2 不同代次MDCK-siat7e细胞生长曲线的比较0、7、17、28及45代MDCK-siat7e细胞按相同密度接种后,经1~2 h的停滞期后进入快速生长期,细胞在培养基中悬浮增殖,以指数方式生长,细胞浓度达6.5×106个/mL,呈极高的活力,存活率至少为95%,细胞培养后期仍呈单个悬浮生长状况,生长至后期细胞活率逐渐下降。见图2和图3。
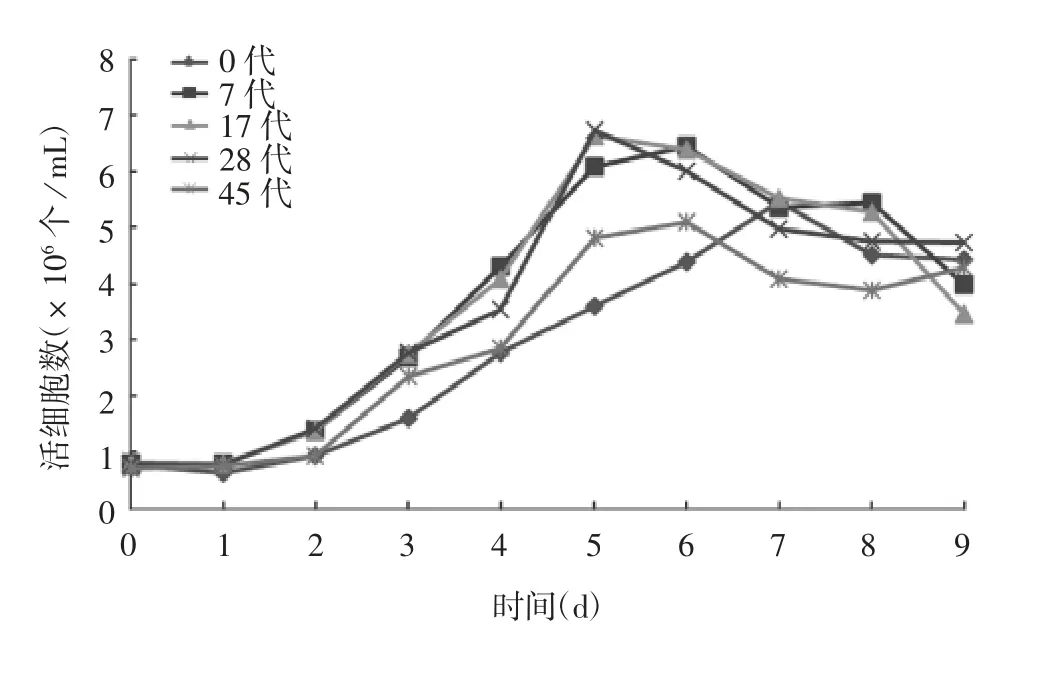
图2 不同代次MDCK-siat7e细胞的增殖曲线Fig.2 Growth curve of MDCK-siat7e cells of various passages
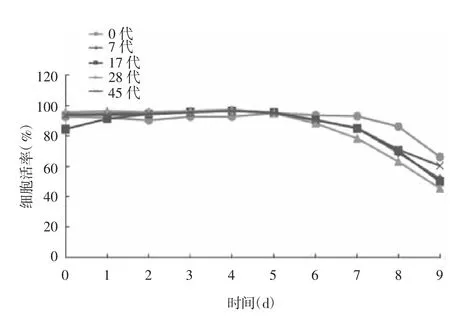
图3 不同代次MDCK-siat7e细胞的活率Fig.3 Survival rates of MDCK-siat7e cells of various passages
2.3 不同代次MDCK-siat7e细胞各生长指标及生化指标的比较 不同代次MDCK-siat7e细胞的μ、Qi(Gluc)24h、Qi(Lac)24h及Qi(NH4+)24h差异均无统计学意义(P>0.05),见表1。
表1 不同代次MDCK-siat7e细胞各生长指标和生化指标(±s,n=9)Tab.1 Growth and biochemical indexes of MDCK-siat7e cells of various passages(±s,n=9)

表1 不同代次MDCK-siat7e细胞各生长指标和生化指标(±s,n=9)Tab.1 Growth and biochemical indexes of MDCK-siat7e cells of various passages(±s,n=9)
?
2.4 45代MDCK-siat7e细胞的成瘤性和致瘤性裸鼠体内接种法成瘤性检测结果显示,10只裸鼠中有1只裸鼠的肺部可见0.2 cm×0.2 cm结节,心、肝、脾、肾、淋巴结等其余主要脏器未见结节,其余9只裸鼠心、肝、脾、肺、肾、淋巴结等主要脏器未见结节;10只裸鼠中仅1只裸鼠肺组织可见转移瘤,瘤组织结构及细胞形态清晰,细胞异型性明显,局部区域可见瘤栓形成,与阴性对照相比,该只裸鼠心、肝、脾、肾、淋巴结病理改变无明显差异;其余9只裸鼠与阴性对照相比,心、肝、脾、肺、肾、淋巴结病理改变无明显差异。
细胞裂解物裸鼠体内接种法和细胞DNA裸鼠体内接种法致瘤性检测结果显示,裸鼠心、肝、脾、肺、肾、淋巴结等主要脏器未见结节,且与阴性对照相比,心、肝、脾、肺、肾、淋巴结组织病理改变无明显差异。
2.5 不同代次MDCK-siat7e细胞中siat7e基因表达量 不同代次MDCK-siat7e细胞siat7e基因表达量差异均无统计学意义(P>0.05),见表2。
表2 不同代次MDCK-siat7e细胞siat7e基因表达量的比较(±s,n=3)Tab.2 Expression levels of siat7e gene in MDCK-siat7e cells of various passages(±s,n=3)

表2 不同代次MDCK-siat7e细胞siat7e基因表达量的比较(±s,n=3)Tab.2 Expression levels of siat7e gene in MDCK-siat7e cells of various passages(±s,n=3)
?
3 讨论
MDCK细胞是常见的哺乳动物细胞系,广泛用于人用和兽用疫苗的研发及生产,具有培养简单、增殖速度快、易感病毒、病毒产量高的特点,其在流感疫苗的研发中扩增的流感病毒与原始流感病毒株高度相似,且免疫效果相近[7]。siat7e基因编码α-2,6唾液酸转移酶,调控细胞的贴壁性,其表达水平越高,细胞黏附性越低[8]。人siat7e基因转染MDCK细胞,经过悬浮驯化后获得MDCK-siat7e细胞系,应用生物反应器大规模悬浮培养有望成为疫苗生产的细胞基质[9]。兰州生物制品研究所有限责任公司应用无血清无蛋白培养基培养MDCK-siat7e细胞,该培养基无动物源性成分,培养基成分明确,消除了动物源性成分在细胞培养中产生的不确定性,也明显减轻了下游纯化工艺的负担,有助于最终产品质量的提高[10]。
在前期研究中,兰州生物制品研究所有限责任公司已能够应用无血清无蛋白培养基培养MDCKsiat7e细胞用于流感疫苗的研发,且获得了较高的细胞密度,而MDCK-siat7e细胞在无血清无蛋白培养基中传代稳定性方面的研究尚缺乏研究数据。《中国药典》三部(2015版)中《生物制品生产检定用动物细胞基质制备及检定规程》中明确规定,要对人用生物制品生产/检定用的动物细胞基质进行稳定性检查[11]。MDCK-siat7e细胞株的稳定性在工业化生产中对产品质量的稳定性具有重要作用[12]。因此,本文开展了MDCK-siat7e细胞的传代稳定性研究。
本研究结果显示,0、7、17、28及45代MDCKsiat7e细胞在培养4 d时均呈圆形,细胞边缘清晰,均匀分散于培养液中,无聚团现象,呈悬浮生长状态,生长状态良好。5个不同代次细胞均按照相同密度接种,经过1~2 h停滞期后均进入快速生长期,整个培养过程中细胞生长曲线和活率、μ均有较好的吻合,无明显变化;培养过程中细胞代谢指标Qi(Gluc)24h、Qi(Lac)24h及Qi(NH4+)24h也无明显差异。不同代次MDCK-siat7e细胞的siat7e基因表达量也无明显差异。MDCK-siat7e细胞连续传代至45代后无致瘤性,但有成瘤性的风险。
综上所述,MDCK-siat7e细胞的传代稳定性较好,在规模化放大培养中即使细胞代次有大的变化,但只要在45代范围内,细胞传代稳定性均良好。本研究为流感疫苗的开发、规模放大、制定细胞传代限定代次等提供了参考,但需要关注高代次细胞成瘤性的风险。
