南丹参三萜类化学成分的研究
2021-09-12蒋小华刘章彬霍华珍李典鹏于洋
蒋小华 刘章彬 霍华珍 李典鹏 于洋
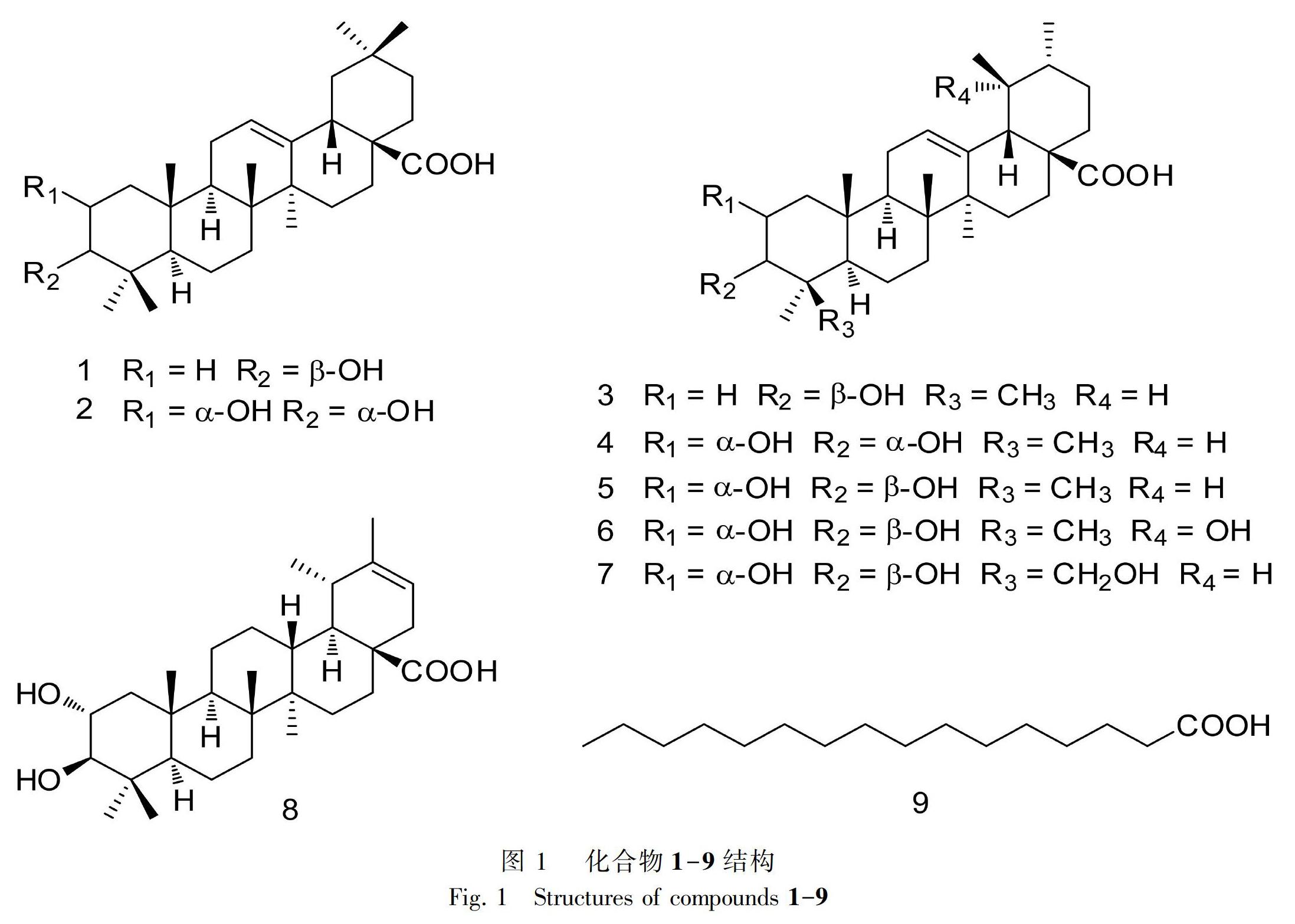
摘 要: 为研究南丹参根中三萜类化学成分,该文采用95%乙醇浸泡提取,依次应用D101大孔吸附树脂、MCI、硅胶柱色谱、ODS及反相高效液相色谱方法进行分离纯化,根据理化性质及波谱数据鉴定其化合物的结构。结果表明:从南丹参根提取物中分离得到9个化合物,分别鉴定为齐墩果酸(1)、2α, 3α-二羟基-12-烯-28-齐墩果酸(2)、烏苏酸(3)、2α, 3α-二羟基-12-烯-28-乌苏酸(4)、2α,3β-二羟基-12-烯-28-乌苏酸(5)、2α,3β,19α-三羟基-12-烯-28-乌苏酸(6)、2α,3β,24-三羟基-12-烯-28-乌苏酸(7)、psiguanin A(8)、正十六烷酸(9)。化合物1-9为首次从该植物中分离得到。
关键词: 南丹参, 化学成分, 提取分离, 结构鉴定, 三萜
中图分类号: Q946.91 文献标识码: A 文章编号: 1000-3142(2021)07-1097-07
Abstract: In order to study chemical components of triterpenoids from Salvia bowleyana roots, nine compounds from 95% ethanol extract of the roots of Salvia bowleyana were isolated and purified by means of various column chromatographic techniques, including macroporous resin D101, MCI, normal-phase silica column, ODS, and reversed-phase HPLC. The nine compounds were identified as oleanolic acid (1), 2α,3α-dihydroxyolean-12-en-28-oic acid (2), ursolic acid (3), 2α,3α-dihydroxyurs-12-en-28-oic acid (4), 2α,3β-dihydroxyurs-12-en-28-oic acid (5), 2α,3β,19α-trihydroxyurs-12-en-28-oic acid (6), 2α,3β,24-trihydroxyurs-12-en-28-oic acid (7), psiguanin A (8), and n-hexadecane acid (9). Compounds 1-9 were isolated from this plant for the first time.
Key words: Salvia bowleyana, chemical constituents, extraction and isolation, structure identification, triterpenoids
南丹参(Salvia bowleyana)为唇形科(Lamiaceae)鼠尾草属(Salvia L.)多年生草本植物,又名紫丹参、赤参、七里麻等,主要分布于广东、广西、湖南、江西、浙江、福建等省(区),其根作通经药使用,具有祛瘀、生新、活血、调经的功效,在一些地区作为丹参的替代品使用(吴征镒和李锡文,1977;林来官,1989)。有文献报道南丹参水溶性成分主要含有丹酚酸A、B、C、迷迭香酸甲酯等化合物,其中丹酚酸B的生物活性研究最广泛且深入;脂溶性成分主要有丹参酮类二萜及甾醇类化合物(李静等,1994;沈建芳等,2006),其中丹参酮类具有明显的生物活性。丹参主要含有丹参酮类二萜和酚酸类化学成分,南丹参中酚酸类和丹参酮类两大类成分与丹参相同的仅有10余种(李静等,1994;沈建芳等,2006)。李晶等(2016)对丹参与南丹参药材进行了薄层色谱研究,发现南丹参药材独有的蓝色荧光斑点;王元媛等(2019)发现丹参与南丹参的红外光谱有较大差异。南丹参和丹参有部分相同的药用活性成分,同时化学成分也有一定差异。国内外学者们对丹参化学成分的研究已很深入(Wang et al., 2007),而对南丹参的研究较少,需要对其化学成分进一步深入研究。
近年来,研究人员从鼠尾草属植物红根草、丹参和土丹参等植物中分离得到三萜类化学成分(霍华珍等,2019;夏光惠等,2019;黄莉婷等,2019),该类成分具有抗炎、保肝、降血糖、抗肿瘤等多种生物活性。因此,这个属植物中的三萜类化学成分逐渐引起了人们的兴趣和重视。南丹参中丹参酮类和酚酸类活性成分已有报道,而南丹参中的三萜类成分研究很少。为了更深入了解南丹参化学成分,该文对南丹参根95%乙醇浸泡提取物的乙酸乙酯萃取部分中的三萜类化学成分进行了研究。
1 材料与方法
1.1 材料和仪器
1.1.1 材料 南丹参药材购买于广西桂林市药材市场(2017年3月),经广西植物研究所李光照研究员鉴定为唇形科鼠尾草属南丹参(Salvia bowleyana)的干燥根。标本(编号20170322-1)保存在广西植物功能物质研究与利用重点实验室。
1.1.2 仪器与试剂 仪器:Avance 500 MHz超导核磁共振波谱仪(瑞士Bruker公司),LC-MS-IT-TOF液相色谱质谱联用仪(日本岛津公司),1200高效液相色谱仪(美国Agilent公司),半制备液相色谱仪(北京赛谱锐思公司),HPLC半制备柱YMC-Pack ODS-A(250 mm× 10 mm, S-5 μm)(日本YMC公司)。试剂:反相十八烷基硅烷键合硅胶ODS(日本YMC公司),大孔吸附树脂D101(天津市海光化工有限公司),MCI gel CHP20P(日本三菱化学控股株式会社),薄层色谱硅胶GF254及柱层析硅胶(青岛海洋化工有限公司),高效液相半制备分离所用乙腈和甲醇为色谱纯,其他分离所用试剂为分析纯,水为娃哈哈纯净水。
1.2 研究方法
1.2.1提取与萃取 取干燥南丹参根19.2 kg进行粉碎,室温下用95%乙醇浸泡提取3次,每次6 d,每天早晚搅拌2次。合并滤液,在50 ℃水浴中减压浓缩得到浸膏685.5 g。浸膏分散于温水中用乙酸乙酯萃取3次,合并萃取液,减压浓缩后得到乙酸乙酯部位浸膏249.4 g。
1.2.2 分离与纯化 乙酸乙酯浸膏经大孔吸附树脂柱(D101)色谱分离,依次用乙醇溶液(30%、50%、80%、95%)进行梯度洗脱,各洗脱液分别减压浓缩后得到A~D组分,其中A(17.8 g)、B(18.6 g)、C(163.8 g)、D(25.3 g)。C部分经MCI柱色谱分离,以甲醇-水(0~100%,10%为一个梯度)梯度洗脱,各洗脱液分别浓缩后共得到11个部分C1~C11。C9(74.1 g)经正相硅胶柱色谱分离,以石油醚-丙酮(100%~0)梯度洗脱,TLC 检测合并组分,浓缩后共得到20个部分C9-1~C9-20。C9-8(2.7 g)经硅胶柱色谱分离纯化得到化合物9 (230 mg)。C9-13(4.7 g)经反相半制备HPLC分离纯化得到化合物1 (30 mg)、3 (28 mg)。C9-15(7.9 g)经ODS柱色谱和反相半制备HPLC分离纯化得到化合物2 (18 mg)、4 (26 mg)、8 (16 mg)。C9-18(12.5 g)经ODS柱色谱和反相半制备HPLC分离纯化得到化合物5 (8 mg)、6 (50 mg)、7 (10 mg)。
2 结果与分析
从南丹参根95%乙醇提取物乙酸乙酸部位中分离并得到9个化合物,化合物9为脂肪酸类化合物,1-8均为三萜类成分,化合物1-9为首次从该植物中分离得到(图1)。结构鉴定结果如下。
化合物1 白色无定型粉末。1H-NMR (CDCl3, 500 MHz) δ: 5.25 (1H, m, H-12), 3.20 (1H, dd, J=11.2, 4.2 Hz, H-3), 2.80 (1H, dd, J=13.5, 3.5 Hz, H-18), 1.11 (3H, s), 0.96 (3H, s), 0.90 (3H, s), 0.89 (3H, s), 0.88 (3H, s), 0.75 (3H, s), 0.73 (3H, s)。13C-NMR (CDCl3, 125 MHz) δ: 38.7 (C-1), 27.4 (C-2), 79.3 (C-3), 39.0 (C-4), 55.5 (C-5), 18.5(C-6), 32.9 (C-7), 39.5 (C-8), 47.9 (C-9), 37.3 (C-10), 23.6 (C-11), 122.8 (C-12), 143.9 (C-13), 41.9 (C-14), 27.9 (C-15), 23.2(C-16), 46.8(C-17), 41.2(C-18), 46.2(C-19), 30.9(C-20), 34.1(C-21), 32.7(C-22), 28.3(C-23), 15.8(C-24), 15.6(C-25), 17.4(C-26), 26.2(C-27), 183.6(C-28), 33.3(C-29), 23.8(C-30)。以上数据与文献(Carvalho & Seita, 1993)基本一致,故鉴定为齐墩果酸(oleanolic acid)。
化合物2 白色无定型粉末。HR-ESI-MSm/z:495.338 3 [M + Na]+(计算相对分子质量C30H48O4Na, 495.3445)。1H-NMR (CDCl3, 500 MHz) δ: 5.26 (1H, t, J=3.3 Hz, H-12), 3.98 (1H, ddd, J=11.7, 4.0, 3.0 Hz, H-2), 3.40 (1H, d, J=3.0 Hz, H-3), 2.80 (1H, dd, J=13.8, 3.8 Hz, H-18), 1.12 (3H, s), 1.00 (3H, s), 0.93 (3H, s), 0.91 (3H, s), 0.88 (3H, s), 0.83 (3H, s), 0.72 (3H, s)。13C-NMR (CDCl3, 125MHz) δ: 41.9(C-1), 66.7(C-2), 79.2(C-3), 38.7(C-4), 48.4(C-5), 18.3(C-6), 32.7(C-7), 39.7(C-8), 47.6(C-9), 38.5(C-10), 23.6(C-11), 122.7(C-12), 143.9(C-13), 41.9(C-14), 27.9(C-15), 23.2(C-16), 46.7(C-17), 41.2(C-18), 46.1(C-19), 30.9(C-20), 34.0(C-21), 32.7(C-22), 28.7(C-23), 22.0(C-24), 16.6(C-25), 17.4(C-26), 26.3(C-27), 183.7(C-28), 33.3(C-29), 23.8(C-30)。以上數据与文献(李火云等,2014)基本一致,故鉴定为2α, 3α-二羟基-12-烯-28-齐墩果酸(2α,3α-dihydroxyolean-12-en-28-oic acid)。
化合物3 白色无定型粉末。1H-NMR (C5D5N, 500 MHz) δ: 5.50 (1H, m, H-12), 3.47 (1H, dd, J=9.6, 6.1 Hz, H-3), 2.65 (1H, d, J=11.3 Hz, H-18), 1.25 (3H, s), 1.24 (3H, s), 1.06 (3H, s), 1.03 (3H, s), 1.02 (3H, d, J=6.3 Hz), 0.97 (3H, d, J=6.0 Hz), 0.90 (3H, s)。13C-NMR (C5D5N, 125 MHz) δ: 39.5(C-1), 28.5(C-2), 78.5(C-3), 39.7(C-4), 56.2(C-5), 19.2(C-6), 34.0(C-7), 40.4(C-8), 48.4(C-9), 37.7(C-10), 24.0(C-11), 126.0(C-12), 139.7(C-13), 42.9(C-14), 29.1(C-15), 25.3(C-16), 48.4(C-17), 54.0(C-18), 39.9(C-19), 39.8(C-20), 31.5(C-21), 37.8(C-22), 29.2(C-23), 16.9(C-24), 16.0(C-25), 17.9(C-26), 24.3(C-27), 180.4(C-28), 17.9(C-29), 21.8(C-30)。以上数据与文献(Woo et al., 2014)基本一致,故鉴定为乌苏酸(ursolic acid)。
化合物4 白色无定型粉末。HR-ESI-MSm/z:495.339 1 [M + Na]+(计算相对分子质量C30H48O4Na, 495.3445)。 1H-NMR (C5D5N, 500 MHz) δ: 5.45 (1H, t, J=3.3 Hz, H-12), 4.30 (1H, m, H-2), 3.77 (1H, d, J=2.2 Hz, H-3), 2.60 (1H, d, J=11.2 Hz, H-18), 1.27 (3H, s), 1.10 (3H, s), 1.04 (3H, s), 0.95 (3H, d, J=6.6 Hz), 0.94 (3H, s), 0.92 (3H, d, J=6.3 Hz), 0.88 (3H, s)。13C-NMR (C5D5N, 125 MHz) δ: 43.2(C-1), 66.4(C-2), 79.6(C-3), 39.1(C-4), 49.0(C-5), 18.7(C-6), 33.8(C-7), 40.5(C-8), 48.2(C-9), 38.9(C-10), 23.9(C-11), 125.9(C-12), 139.5(C-13), 42.8(C-14), 28.9(C-15), 25.2(C-16), 48.3(C-17), 53.8(C-18), 39.7(C-19), 39.7(C-20), 31.3(C-21), 37.7(C-22), 29.7(C-23), 22.6(C-24), 17.0(C-25), 17.8(C-26), 24.1(C-27), 180.1(C-28), 17.8(C-29), 21.7(C-30)。以上数据与文献(周俊等,2015)基本一致,故鉴定为2α, 3α-二羟基-12-烯-28-乌苏酸(2α,3α-dihydroxyurs-12-en-28-oic acid)。
化合物5 白色无定型粉末。HR-ESI-MSm/z: 495.3455 [M + Na]+(计算相对分子质量C30H48O4Na, 495.3445)。1H-NMR (C5D5N, 500 MHz) δ: 5.45 (1H, t, J=3.2 Hz, H-12), 4.09 (1H, ddd, J=11.0, 9.4, 4.3 Hz, H-2), 3.40 (1H, d, J=9.4 Hz, H-3), 2.62 (1H, d, J =11.4 Hz, H-18), 1.27 (3H, s), 1.21 (3H, s), 1.07 (3H, s), 1.04 (3H, s), 0.99 (3H, d, J=6.7 Hz), 0.98 (3H, s), 0.95 (3H, d, J=6.2 Hz)。13C-NMR (C5D5N, 125 MHz) δ: 48.3(C-1), 68.9(C-2), 84.1(C-3), 40.2(C-4), 56.2(C-5), 19.2(C-6), 33.9(C-7), 40.4(C-8), 48.4(C-9), 38.8(C-10), 24.1(C-11), 125.8(C-12), 139.7(C-13), 42.9(C-14), 29.0(C-15), 25.3(C-16), 48.3(C-17), 53.9(C-18), 39.8(C-19), 39.8(C-20), 31.5(C-21), 37.8(C-22), 29.7(C-23), 18.0(C-24), 17.3(C-25), 17.9(C-26), 24.2(C-27), 180.2(C-28), 17.9(C-29), 21.8(C-30)。以上数据与文献(Taniguchi et al., 2002)基本一致,故鉴定为2α,3β-二羟基-12-烯-28-乌苏酸(2α,3β-dihydroxyurs-12-en-28-oic acid)。
化合物6 白色无定型粉末。1H-NMR (C5D5N, 500 MHz) δ: 5.59 (1H, m, H-12), 4.12 (1H, ddd, J=11.0, 9.4, 4.3 Hz, H-2), 3.40 (1H, d, J=9.4 Hz, H-3), 3.07 (1H, s, H-18), 1.73 (3H, s), 1.44 (3H, s), 1.29 (3H, s), 1.14 (3H, d, J=7.0 Hz), 1.13 (3H, s), 1.10 (3H, s), 1.02 (3H, s)。13C-NMR (C5D5N, 125 MHz) δ: 48.3(C-1), 69.0(C-2), 84.3(C-3), 40.3(C-4), 56.4(C-5), 19.4(C-6), 33.9(C-7), 40.8(C-8), 48.2(C-9), 38.9(C-10), 24.5(C-11), 128.6(C-12), 140.6(C-13), 42.5(C-14), 29.7(C-15), 26.8(C-16), 48.7(C-17), 55.0(C-18), 73.1(C-19), 42.8(C-20), 27.3(C-21), 38.9(C-22), 29.7(C-23), 18.0(C-24), 17.3(C-25), 17.7(C-26), 25.1(C-27), 181.0(C-28), 27.5(C-29), 17.2(C-30)。以上数据与文献(刘岱琳等,2010)基本一致,故鉴定为2α, 3β, 19α-三羟基-12-烯-28-乌苏酸(2α,3β,19α-trihydroxyurs-12-en-28-oic acid)。
化合物7 白色无定型粉末。1H-NMR (C5D5N, 500 MHz) δ: 5.44 (1H, t, J=3.5 Hz, H-12), 4.43 (1H, d, J=10.9 Hz, H-24b), 4.28 (1H, ddd, J=10.9, 9.5, 4.2 Hz, H-2), 3.69 (1H, d, J=10.9 Hz, H-24a), 3.57 (1H, d, J=9.5 Hz, H-3), 2.62 (1H, d, J=11.4 Hz, H-18), 1.57 (3H, s), 1.19 (3H, s), 0.99 (3H, s), 0.97 (3H, d, J=6.5 Hz), 0.94 (3H, s), 0.93 (3H, d, J=6.0 Hz)。13C-NMR (C5D5N, 125 MHz) δ: 48.2(C-1), 69.0(C-2), 86.0(C-3), 44.3(C-4), 56.8(C-5), 19.5(C-6), 34.2(C-7), 40.3(C-8), 48.5(C-9), 38.5(C-10), 24.3(C-11), 125.7(C-12), 139.6(C-13), 42.8(C-14), 29.0(C-15), 25.3(C-16), 48.2(C-17), 53.9(C-18), 39.9(C-19), 39.8(C-20), 31.5(C-21), 37.9(C-22), 24.5(C-23), 66.0(C-24), 17.9(C-25), 17.6(C-26), 24.2(C-27), 180.1(C-28), 17.7(C-29), 21.8(C-30)。以上數据与文献(洪一郎等,2014)基本一致,故鉴定为2α,3β,24-三羟基-12-烯-28-乌苏酸(2α,3β,24-trihydroxyurs-12-en-28-oic acid)。
化合物8 白色无定型粉末。1H-NMR (CDCl3, 500 MHz) δ: 5.25 ( 1H, d, J=7.0 Hz, H-21), 3.68 (1H, ddd, J=11.0, 9.5, 4.5 Hz, H-2), 2.98 (1H, d, J=9.5 Hz, H-3), 1.61 (3H, s), 0.99 (3H, s), 0.99 (3H, d, J=6.3 Hz), 0.95 (3H, s), 0.92 (3H, s), 0.89 (3H, s), 0.78 (3H, s)。13C-NMR (CDCl3, 125 MHz) δ: 47.0(C-1), 69.5(C-2), 84.2(C-3), 39.4(C-4), 55.8(C-5), 18.5(C-6), 34.4(C-7), 41.2(C-8), 50.8(C-9), 38.8(C-10), 21.9(C-11), 27.5(C-12), 39.3(C-13), 42.2(C-14), 29.3(C-15), 33.0(C-16), 49.1(C-17), 49.0(C-18), 37.5(C-19), 143.5(C-20), 117.1(C-21), 38.0(C-22), 28.7(C-23), 16.7(C-24), 17.8(C-25), 16.3(C-26), 15.0(C-27), 178.4(C-28), 23.6(C-29), 22.0(C-30)。以上数据与文献(张旭等,2016)基本一致,故鉴定为psiguanin A。
化合物9 白色粉末。HR-ESI-MS m/z:255.232 0 [M - H]-(计算相对分子质量C16H31O2, 255.2330)。1H-NMR (CDCl3, 500 MHz) δ: 2.32 (2H, t, J=7.5 Hz, H-2), 1.61 (2H, m, H-3), 1.28 (24H, m, H-4~15), 0.86 (3H, t, J=7.0 Hz, H-16)。13C-NMR (CDCl3, 125 MHz) δ: 180.4(C-1), 34.3(C-2), 32.2(C-3), 29.9(C-4), 29.9(C-5), 29.9(C-6), 29.9(C-7), 29.9(C-8), 29.8(C-9), 29.7(C-10), 29.6(C-11), 29.5(C-12), 29.3(C-13), 24.9(C-14), 22.9(C-15), 14.3(C-16)。以上数据与文献(刘桂艳等,2005)基本一致,故鉴定为正十六烷酸(n-hexadecane acid)。
3 讨论与结论
南丹参与丹参为同属植物,活性成分上有相同部分,在药用上具有很好的开发利用前景。目前,对南丹参的药理活性研究主要集中在丹酚酸类的抗氧化活性方面(李晶等,2017),而对南丹参中三萜类化合物的研究较少。刘青等(2007)认为鼠尾草属的植物由于植物种类和生长地区的不同,有的含有大量的二萜类化合物而不含有三萜类化合物,而有的则只含有大量的三萜类化合物而不含有二萜类化合物。本研究发现,南丹参根95%乙醇浸泡提取乙酸乙酯萃取物中除了含有丹参酮类等二萜成分外,还含有大量的三萜类化合物。通过D101大孔吸附树脂、MCI、硅胶、ODS等多种柱层析以及反相半制备液相反复分离,首次从该植物中得到8个五环三萜类化合物,且结构类型主要为齐墩果烷型(1-2)和乌苏烷型(3-8)。五环三萜类化合物在自然界分布广泛,药理活性主要表现在抗肿瘤、抗糖尿病、抗炎、保护肝脏和抗心律失常等方面(李宏杨等,2009;陈晔等,2017;刘蒲和王国权,2018;方山丹等,2019)。Mu et al.(2015)研究表明,齐墩果酸(1)和熊果酸(3)在抗肿瘤方面效果显著,齐墩果酸通过抑制Akt/mTOR/S6K和ERK1/2 信号通路来抑制人膀胱癌T24细胞增殖,对肝癌细胞HepG2 有细胞毒作用,能抑制HepG2 细胞的生长(Bao et al., 2015)。熊果酸能诱导人甲状腺乳头状癌细胞TPC-1 凋亡(华杰等,2018),通过抑制接种肝癌细胞SMMC-7721的斑马鱼节间血管生长来发挥抗肿瘤作用(陈锡强等,2015)。黄莉婷等(2019)也曾在丹参中分离得到化合物2、4、5和8,在高剂量的情况下,其对炎症因子释放具有较好的抑制作用。五环三萜类化合物的发现丰富了南丹参化学成分,为进一步深入研究药用植物南丹参提供科学依据。
参考文献:
BAO X, GAO M, XU H, et al., 2015. A novel oleanolic acid- loaded PLGA-TPGS nanoparticle for liver cancer treatment [J]. Drug Dev Ind Pharm, 41(7): 1193-1203.
CARVALHO LM, SEITA J, 1993. A new oleanolic acid derivative from Securinega tinctoria [J]. Planta Med, 59(4):369-372.
CHEN XQ, CHENG LF, XU XG, et al., 2015. Inhibition of ursolic acid on angiogenesis and xenografts in zebrsfish (danio rerio) [J]. Chin Pharmacol Bull, 31(7): 1004-1008. [陳锡强, 程丽芳, 徐新刚, 等, 2015. 熊果酸对斑马鱼血管生成及斑马鱼移植癌的抑制作用 [J]. 中国药理学通报, 31(7): 1004-1008.]
CHEN Y, DING CC, GUO ZJ, et al., 2017. New progress on the pharmacological activities of several pentacyclic triterpenoids [J]. J Logist Univ PAP(Med Sci), 26(12): 1083-1087. [陈晔, 丁晨晨, 郭志军, 等, 2017. 五环三萜类化合物药理活性研究进展 [J]. 武警后勤学院学报(医学版), 26(12): 1083-1087.]
FANG SD, XIANG RQ, FAN YD, et al., 2019. Advances on antitumor activity of pentacyclic triterpenoids [J]. Yunnan J Trad Chin Med Mat Med, 40(4): 83-87. [方山丹, 向润清, 范译丹, 等, 2019. 五环三萜类化合物抗肿瘤活性的研究进展 [J]. 云南中医中药杂志, 40(4): 83-87.]
HONG YL, MA L, WANG YF, et al., 2014. Anthraquinones and triterpenoids from roots of Knoxia roxburghii [J]. Chin J Chin Mat Med, 39(21): 4230-4233. [洪一郎, 马丽, 王垣芳, 等, 2014. 红大戟中的蒽醌和三萜类化学成分 [J]. 中国中药杂志, 39(21): 4230-4233.]
HUA J, RUAN LY, MA DQ, et al., 2018. Thyroid papillary carcinoma cells TPC-1 apoptosis induced by ursolic acid [J]. J Kunming Med Univ, 39(1): 10-15. [华杰, 阮凌玉, 马定乾, 等, 2018. 熊果酸诱导甲状腺乳头状癌细胞TPC-1凋亡的实验 [J]. 昆明医科大学学报, 39(1): 10-15.]
HUANG LT, DING F, XU QM, et al., 2019. The isolation of triterpenoid acids from Radix Salviae miltiorrhizae and their anti-inflammatory activities evaluation [J]. Word Sci Technol/Mod Trad Chin Med Mat Med, 21(1): 19-24. [黄莉婷, 丁昉, 许琼明, 等, 2019. 丹参中三萜酸的分离及其抗炎活性的研究 [J]. 世界科学技术-中医药现代化, 21(1): 19-24.]
HUO HZ, CHEN SN, PAULI GF, et al., 2019. Triterpenoids from Salvia prionitis [J]. Guihaia, 39(4): 516-522. [霍华珍, 陈绍农, PAULI GF, 等, 2019. 红根草三萜类化学成分的研究 [J]. 广西植物, 39(4): 516-522.]
LI HY, JIAO K, ZHANG P, et al., 2014. Chemical constituents from Isodon excisoides [J]. Chin Trad Herb Drugs, 45(2): 154-160. [李火云, 焦珂, 张鹏, 等, 2014. 拟缺香茶菜化学成分研究 [J]. 中草藥, 45(2): 154-160.]
LI HY, LIU GM, LIU F, et al., 2009. Research of ursolic acid and similar pentacyclic triterpenoid [J]. J Hunan Univ Technol, 23(5): 18-21. [李宏杨, 刘国民, 刘飞, 等, 2009. 熊果酸及五环三萜同类物的研究进展 [J]. 湖南工业大学学报, 23(5): 18-21.]
LI J, LI LN, SONG WZ, 1994. Study on the chemical constituents of Salvia bowleyana Dunn [J]. Chin Trad Herb Drugs, 25(7): 347-349. [李静, 黎莲娘, 宋万志, 1994. 南丹参化学成分研究 [J]. 中草药, 25(7): 347-349.]
LI J, SHEN ZY, CHEN C, et al., 2017. The spectral efficiency relationship research on the antioxidant activity in phenolic compounds in Salvia bowleyana Dunn [J]. Lishizhen Med Mat Med Res, 28(12): 2895-2897. [李晶, 沈震亚, 陈超, 等, 2017. 南丹参中酚酸类成分抗氧化活性谱效关系研究 [J]. 时珍国医国药, 28(12): 2895-2897.]
LI J, WANG XQ, CHEN C, et al., 2016. The TLC research of Salvia bowleyana Dunn [J]. Pract Clin J Integr Trad Chin West Med, 16(7): 78-80. [李晶, 王小青, 陈超, 等, 2016. 南丹参药材薄层色谱研究 [J]. 实用中西医结合临床, 16(7): 78-80.]
LIN LG, 1989. Flora Fujianica [M]. Fuzhou: Fujian Science & Technology Publishing House, 4: 560. [林来官, 1989. 福建植物志 [M]. 福州: 福建科学技术出版社, 4: 560.]
LIU DL, ZHU S, MA R, et al., 2010. Triterpenoids from the roots of Rose odorata var. gigantean [J]. Chin J Nat Med, 8(1): 12-15. [刘岱琳, 朱珊, 马荣, 等, 2010. 固公果根中的三萜类成分 [J]. 中国天然药物, 8(1): 12-15.]
LIU GY, MA SC, ZHENG J, et al., 2005. Chemical constituents of Helicia nilagirica seeds (Ⅰ) [J]. Chin Trad Herb Drugs, 36(6): 814-817. [刘桂艳, 马双成, 郑健, 等, 2005. 深绿山龙眼种子化学成分研究(Ⅰ) [J]. 中草药,36(6): 814-817.]
LIU P, WANG GQ, 2018. Advances on pharmacological action of pentacyclic triterpenoids [J]. Strait Pharm J, 30 (10):1-6. [刘蒲, 王国权, 2018. 五环三萜类化合物的药理作用研究进展 [J]. 海峡药学, 30(10): 1-6.]
LIU Q, LIU ZL, TIAN X, 2007. The triterpenes in Salvia umbratica [J]. Acta Bot Boreal-Occident Sin, 27(6): 1141-1146. [刘青, 刘珍伶, 田瑄, 2007. 荫生鼠尾草植物中的三萜类化学成分研究 [J]. 西北植物学报, 27(6): 1141-1146.]
MU DW, GUO HQ, ZHOU GB, et al., 2015. Oleanolic acid suppresses the proliferation of human bladder cancer by Akt/mTOR/S6K and ERK1/2 signaling [J]. Int J Clin Exp Pathol, 8(11): 13864-13870.
SHEN JF, WANG Q, WANG H, 2006. Study on the chemical constituents of Salvia bowleyana Dunn [J]. Chin Wild Plant Resour, 25(2): 55-58. [沈建芳, 王强, 汪红, 2006. 南丹参化学成分研究 [J]. 中国野生植物资源, 25(2):55-58.]
TANIGUCHI S, IMAYOSHI Y, KOBAYASHI E, et al., 2002. Production of bioactive triterpenes by Eriobotrya japonica Calli [J]. Phytochemistry, 59(3): 315-323.
WANG XH,MORRIS-NATSCHKE SL, LEE KH, 2007. New developments in the chemistry and biology of the bioactive constituents of Tanshen [J]. Med Res Rev, 27(1): 133-148.
WANG YY, LI HH, LIU M, et al., 2019. Identification of Salvia miltiorrhiza Bge from different origin, different parts and Salvia bowleyana Dunn by fourier transform infrared spectroscopy [J]. Chem World, 60(3): 142-148. [王元媛, 李歡欢, 刘梅, 等, 2019. 不同产地、不同部位的丹参与南丹参的红外光谱研究 [J]. 化学世界, 60(3): 142-148.]
WOO KW, HAN JY, CHOI SU, et al., 2014. Triterpenes from Perilla frutescens var. acuta and their cytotoxic activity [J]. Nat Prod Sci, 20(2): 71-75.
WU ZY, LI XW, 1977. Flora Reipublicae Popularis Sinicae [M]. Beijing: Science Press, 66: 148. [吴征镒, 李锡文, 1977. 中国植物志 [M]. 北京: 科学出版社, 66: 148.]
XIA GH, BI DW, LI HZ, et al., 2019. Triterpenes and phenolic acids from roots of Salvia kiaometiensis [J]. Chin Trad Herb Drugs, 50(5): 1043-1048. [夏光惠, 毕德文, 李宏哲, 等, 2019. 土丹参根中的三萜类和酚酸类成分 [J]. 中草药, 50(5): 1043-1048.]
ZHANG X, JIANG D, WANG J, et al., 2016. Chemical constituents from the roots of Rubus parvifolius [J]. Chin Pharm J, 51(23): 1999-2004. [张旭, 蒋丹, 王娟, 等, 2016. 茅莓根化学成分研究 [J]. 中国药学杂志, 51(23): 1999-2004.]
ZHOU J, HUANG CG, YU YJ, et al., 2015. Chemical constituents from Perovskia atriplicifolia [J]. Chin J Chin Mat Med, 40(6): 1108-1113. [周俊, 黄超冠, 余一江, 等, 2015. 滨藜叶分药花化学成分研究 [J]. 中国中药杂志, 40(6): 1108-1113.]
(责任编辑 李 莉)
