双齿围沙蚕化学成分及其浸膏抗肿瘤活性的研究
2015-11-18宋淑梅马睿霄金枫清佟长青
宋淑梅++马睿霄++金枫清++佟长青++翟兴月++李伟

摘 要: 采用硅胶柱色谱及薄层制备色谱等手段从双齿围沙蚕(Perinereis aibuhitensis)中分离纯化出2种化合物。对所获得的化合物通过理化常数测定、波谱数据分析同文献对照的方法进行了结构鉴定。同时,采用CCK-8方法对双齿围沙蚕浸膏及乙酸乙酯萃取部分分别进行抑制肿瘤细胞活性测试。结果表明,从双齿围沙蚕中分离得到2种化合物分别为:胆甾-4烯3α,6β醇(1)和 (E)-17-(4,7-dimethyloct-5-en-2-yl)-10,13-dimethyl-2,3,4,7,8,9,10,11,12,13,14,15,16,17-tetradecahydro -1H-cyclopenta[a]phenanthren-3-ol(2),且化合物1是首次从沙蚕中分离得到。抑制肿瘤细胞活性测试表明,70%乙醇浸提获得的双齿围沙蚕浸膏及乙酸乙酯萃取部分对人胃癌细胞AGS、人肝癌细胞HepG2以及人卵巢癌细胞SKOV3均具有抑制细胞增殖作用,且具有剂量和时间依赖性,可作为潜在的抗肿瘤药物进行进一步研究。
关键词: 双齿围沙蚕;化学成分;分离纯化;结构鉴定;抑制肿瘤细胞活性
双齿围沙蚕(Perinereis aibuhitensis),又名沙虫、海虫、海蜈蚣等,分类学上属于环节动物门(Annelida)、多毛纲(Polychaeta)、沙蚕科(Nereidae)、围沙蚕属(Perinereis) [1]。双齿围沙蚕广泛分布于我国渤海、黄海、东海、南海沿海滩涂[2]。双齿围沙蚕具有很高的营养价值,含有丰富的粗脂肪、粗蛋白、不饱和脂肪酸,人体必需的八种氨基酸以及多种矿物质和维生素,享有海中“冬虫夏草”的美称[3-4]。而且沙蚕养殖成本低,经济价值高,被广泛用于鱼、虾、蟹人工育苗和养殖。
沙蚕作为海洋无脊椎动物,因其特殊的生活环境,代谢产物具有结构新颖独特、生物活性较强的特点。干信等采用氯仿萃取醚脱脂、草酸盐沉淀、反复加热分离即传统的液体-液体的提取法,以及超临界CO2技术从沙蚕中制备了一种杂环碱(沙蚕毒素)[5]。邓志会等采用硫酸铵分级盐析、DEAE-Sepharose FF阴离子交换色谱、CM-Sepharose FF阳离子交换色谱和Sephacryl S-100 HR 凝胶过滤色谱,从沙蚕体内分离纯化出一种分子质量为28~32 kDa的具有纤溶活性的新型金属蛋白酶[6]。邓志会等用pH7.4的生理盐水作为对照,研究体外沙蚕金属蛋白酶(NVMP)对家兔新鲜血液的抗凝血和对血栓溶解作用[7]。张伟云等从双齿围沙蚕体内分离出了一种分子量为33 ku和14.4 ku的纤溶酶[8]。白若伦等研究了沙蚕蛋白酶在降低血液黏度方面的药理作用[9]。张云龙等分离纯化了的沙蚕蛋白酶(溶栓素),其等电点约为3.0,相对分子质量在30×105左右[10]。沙蚕蛋白酶可以溶解纤维蛋白,有可能用于预防和治疗心、脑梗死,脑动脉和肺动脉血栓形成等疾病作为降纤和溶栓类药物[11-13]。李云磊等人对采集于福建海岸的沙蚕(Nereis virens)用有机溶剂进行提取,得到提取物A2经硅胶柱洗脱,获得的洗脱组分C2具有显著的体外抑制HeLa细胞的活性[13]。陈颢等发现一种从双齿围沙蚕和多齿围沙蚕体内提取出的一种溶血栓纤溶酶,该沙蚕激酶可用于生产治疗脑血栓、心肌梗塞等引起的血栓性疾病的口服药[14]。潘卫东等从双齿围沙蚕中发现一种新的碱性蛋白,该碱性蛋白具有显著抗菌活性及抗癌作用[15]。汪靖超等人从双齿围沙蚕中分离纯化出一种蛋白酶,该蛋白酶具有酪蛋白酶活性,有望开发为一种新型的助消化类药物[16]。李荣贵等通过运用基因工程的方法表达出了重组沙蚕溶栓性活性蛋白酶(PPA),PPA在体外有纤溶酶原激活活性[17]。但总体来说,对沙蚕化学成分的研究报道还不多。本研究中,对双齿围沙蚕化学成分进行分离纯化并对它的浸膏抗肿瘤活性进行了研究,旨在为双齿围沙蚕的开发利用提供基础数据,为海洋药物的研发提供生物来源。
1 材料和方法
1.1 材料
双齿围沙蚕(Perinereis aibuhitensis)于2013年在辽宁省大连市长兴市场购买;硅胶G与GF254购自青岛海洋化工有限公司;人胃癌细胞AGS、人肝癌细胞HepG2、人卵巢癌细胞SKOV3来自中国科学院上海细胞库;CCK-8检测试剂盒(Dojindo,CK04)来自株式会社同仁化学研究所;96孔板(NEST,货号 701001)为上海锐赛生物技术有限公司提供;其它试剂均为国产分析纯。
1.2 方法
1.2.1 双齿围沙蚕浸膏的制备 1 354 g新鲜双齿围沙蚕,匀浆粉碎后置于圆底烧瓶中,加入4倍体积70%乙醇热浸提2 h,滤出提取液,残渣中继续加4倍体积70%乙醇提取,重复3次。合并提取液,离心取上清液进行减压浓缩,将浓缩液冻干后得总浸膏。
将上述得到的总浸膏依次用等体积的石油醚、乙酸乙酯、正丁醇进行萃取,每种溶剂萃取3次。将萃取液减压浓缩,自然风干,得到石油醚层浸膏(7.06 g),乙酸乙酯层浸膏(3.77 g),正丁醇层浸膏(11.44 g)。
1.2.2 双齿围沙蚕化学成分的分离纯化 石油醚层浸膏5.5 g,溶解于适量的石油醚中,然后将其滴加到8.2 g硅胶(300~400目)中,充分搅拌使样品与硅胶充分吸附,然后静置将石油醚挥干备用。
称取硅胶(300~400目)44 g,湿法装柱后用石油醚进行洗脱平衡,然后将上述挥发完全的拌样硅胶均匀加入,用石油醚-丙酮体系(100∶0~0∶100)进行梯度洗脱,每个比例洗脱5个柱体积,收集并浓缩洗脱液。然后通过薄层层析法进行跟踪分析,合并类似组分,得到a、b、c、d、e、f、g、h 8个组分。对组分b进行制备薄层色谱层析,重结晶得到化合物1。
乙酸乙酯层浸膏3 g溶解于适量乙酸乙酯中,然后将其滴加到4.5 g硅胶(300~400目)中,充分搅拌使样品与硅胶充分吸附,然后静置将石油醚挥干备用。
称取硅胶(300~400目)30 g,湿法装柱后用二氯甲烷进行洗脱平衡,然后将上述挥发完全的拌样硅胶均匀加入,用二氯甲烷-甲醇体系(100∶0~0∶100)进行梯度洗脱,每个比例洗脱5个柱体积,收集并浓缩洗脱液。然后通过薄层层析法进行跟踪分析,合并类似组分,得到A、B、C 3个组分。对组分A进行制备薄层色谱层析,得到A1、A2、A3 3个亚组分,亚组分A2重结晶得到化合物2。
1.2.3 结构鉴定 核磁共振光谱(NMR)在Bruker Avance DRX 500核磁共振仪(500/125 MHz)上进行,以四甲基硅烷(TMS)作内标。
1.2.4 体外抗肿瘤活性测定 称取双齿围沙蚕总浸膏 16 mg ,加8 mL超纯水溶解配制成浓度为2 mg/mL的母液备用。称取双齿围沙蚕总浸膏24 mg,用4 mL乙酸乙酯溶解配制成浓度为6 mg/mL的母液备用。
将细胞悬液(SKOV3/AGS/HepG2:5×103个细胞/孔)接种于96孔培养板中,加入上述样品溶液,使最终浓度分别为2、20、200 μg/mL。于37 ℃ 5% CO2培养箱中分别培养2、6、12及36 h后,每孔加入10 μL CCK-8,混匀后,在培养箱中继续孵育2 h,测定其在450 nm处的吸光值。
1.2.5 数据处理 实验数据以X ±S表示,采用SPSS13.0统计软件作单因素方差分析。
2 结果与分析
2.1 结构鉴定
用70%乙醇对双齿围沙蚕进行热浸提后,得到双齿围沙蚕浸膏。然后对得到的浸膏依次用石油醚、乙酸乙酯及正丁醇进行萃取,得到3部分萃取物。利用薄层层析、硅胶柱层析、沉淀薄层色谱(pTLC)及重结晶等多种手段,分别对石油醚萃取部分、乙酸乙酯萃取部分及正丁醇萃取部分进行进一步分离纯化。从石油醚萃取部分分离得到1种化合物为化合物1,从乙酸乙酯萃取部分分离得到1种化合物为化合物2。从正丁醇层获得的化合物有待于进一步鉴定。
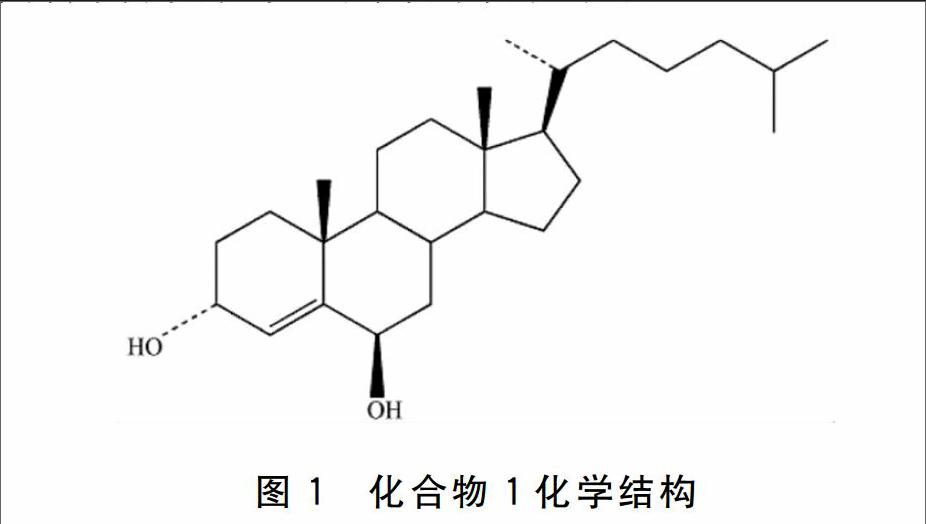
化合物1:白色针状晶体,mp 246~250 ℃,Liebermann-Burchard 反应呈阳性,表明化合物1可能为甾体类化合物,分子式为C27H46O2。 1H NMR δ:5.5(1H,bs),0.73(3H,s),1.23(3H,s),0.92(d,J=6Hz),0.85(H,d,J=6.6Hz),087(3H,d,J=6.6Hz);13C NMR δ:38.53、2772、66.5、127.63、147.6、73.12、27.26、35.01、53.84、36.9、21.36、29.56、42.4、55.55、22.94、39.16、55.75、11.9、21.13、35.36、17.42、36.24、23.24、38.68、27.1、21.13、21.36。以上波普数据与相关文献[18]对照,确定化合物1为胆甾-4烯3α,6β醇(Cholest-4-ene-3α,6β-diol),此化合物为首次从沙蚕中分离得到(图1)。
图1 化合物1化学结构
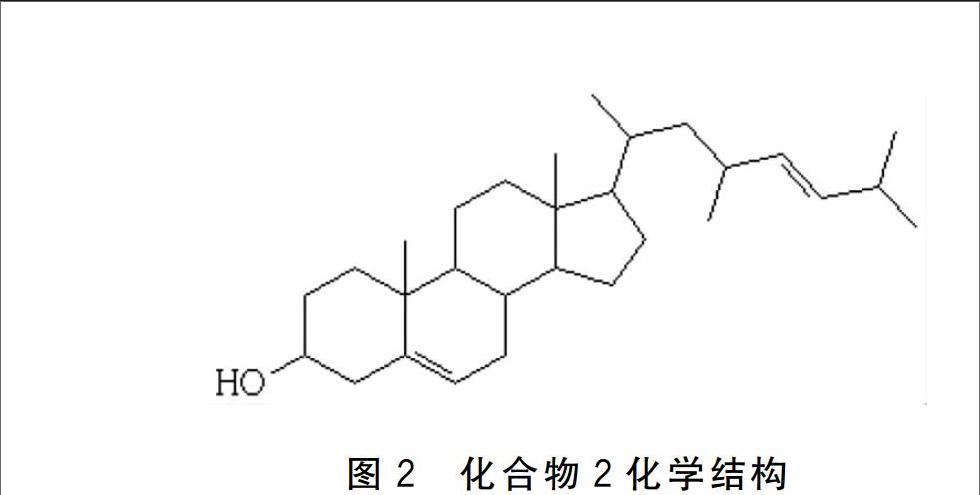
化合物2:无色针状结晶,mp 137-138 ℃,Liebermann-Burchard 反应呈阳性,表明化合物2可能为甾体类化合物,分子式为C29H48O。1H NMR δ:0.69(3H,s),0.89 (3H,1.09) ,2.32 (25H,m),2.02(1H,s) 3.53(1H,m), 5.18(2H,m),5.36(1H,m) .13C NMR δ:37.57、3178、71.79、42.38、140.86、121.69、31.72、3328、52.27、36.58、21.17、28.30、42.38、56.94、24.37、38.89、56.84、11.94、19.46、35.85、18.81、36.29、31.99、136.10、131.92、33.28、22.63、2286、21.17.以上波普数据与相关文献[19]对照,最终确定化合物2为:(E)-17-(4,7-dimethyloct-5-en-2-yl)-10,13-dimethyl-2,3,4,7,8,9,10,11,12,13,14,15,16,17-tetradecahydro-1H-cyclopenta[a]phenanthren-3-ol(图2)。
图2 化合物2化学结构
2.2 抗肿瘤活性实验结果
沙蚕总浸膏对AGS细胞(图3 A)、HepG2细胞(图3 B)以及SKOV3(图3 C)3株肿瘤细胞的生长活力抑制活性测定结果。由图可以看出:沙蚕总浸膏浓度为200 μg/mL时,其对AGS细胞的抑制活性在其与细胞作用2 h后就显示出抑制作用,并且随着作用时间的增加,对细胞的抑制作用也随之加强。沙蚕总浸膏与HepG2细胞作用时,样品浓度为200 μg/mL时,作用时间为6 h时表现出一定的抑制作用,作用36 h后抑制作用十分显著,抑制率为34.04%。沙蚕总浸膏与SKOV3相作用时,样品浓度为200 μg/mL时,从作用2 h开始就表现出了较为显著的抑制活性,且随着作用时间的增加,抑制能力加强,在作用时间为12和36 h时的抑制率分别为43.3%和789%。沙蚕总浸膏在浓度分别为2 μg/mL和20 μg/mL时针对3株肿瘤细胞的抑制活性均不显著。
A-AGS,B-HepG2,C-SKOV3
图3 沙蚕总浸膏对三种癌细胞的抑制活性
图4为乙酸乙酯层浸膏对3株肿瘤细胞的抑制活性。从图中可以看出乙酸乙酯萃取部分与AGS细胞作用时,乙酸乙酯萃取部分在浓度为200 μg/mL时作用时间在2 h就开始表现出明显的抑制活性,并随着作用时间的增加而活性增加,最后在200 μg/mL浓度作用36 h后抑制率达到40.24%(图4 A)。乙酸乙酯萃取部分与HepG2细胞作用时,从低浓度的2 μg/mL到200 μg/mL均表现出了抑制活性,而且抑制活性从作用时间2 h就开始表现出来,直到作用时间达到36 h,抑制活性随时间增加而增强,且在200 μg/mL的抑制活性最强(图4 B)。乙酸乙酯萃取部分与SKOV3细胞作用时,低浓度的样品没有表现出明显抑制活性,在200 μg/mL时表现出显著的抑制活性,在作用36 h后抑制率达到47.2%(图4 C)。
A-AGS,B-HepG2,C-SKOV3
图4 乙酸乙酯萃取部分对三种癌细胞的抑制活性
3 讨论
用70%乙醇对双齿围沙蚕进行热浸提后,得到双齿围沙蚕浸膏。然后对得到的浸膏依次用石油醚、乙酸乙酯及正丁醇进行萃取并进一步分离纯化,获得2个化合物。化合物1为胆甾-4烯3α,6β醇,此化合物为首次从双齿围沙蚕中分离得到。化合物1最初发现于红藻Acantophora spicifera中[18]。化合物2为(E)-17-(4,7-dimethyloct-5-en-2-yl)-10,13-dimethyl-2,3,4,7,8,9,10,11,12,13,14,15,16,17-tetradecahydro-1H-cyclopenta[a]phenanthren-3-ol,化合物2首先发现于柳珊瑚中[19]。
抑制肿瘤细胞活性测试表明,70%乙醇浸提获得的双齿围沙蚕浸膏及乙酸乙酯萃取部分对人胃癌细胞AGS、人肝癌细胞HepG2以及人卵巢癌细胞SKOV3均具有一定的抑制细胞增殖作用,且具有剂量和时间依赖性,这提示进一步对双齿围沙蚕浸膏进行研究,可能获得潜在的具有肿瘤细胞的化学成分。
在双齿围沙蚕中不断发现新的化学成分,丰富了双齿围沙蚕化学成分的数据,为利用双齿围沙蚕做为海洋药物的来源提供了更多的可能性。
参考文献:
[1]
蒋霞敏,柳敏海.沙蚕科的研究进展[J].海洋科学,2008,32(4): 82-86
[2]吴宝玲,孙瑞平,杨德渐.中国近海沙蚕科研究[M].北京:海洋出版社,1981:13-19,171-172
[3] 杨士平,刘慧玲,邱德全.天然和养殖沙蚕营养成分分析[J].饲料工业,2013,34( 10 ):53-55
[4] 朱国萍,陈子腾,叶宁.湛江养殖双齿围沙蚕营养成分的测定[J].当代水产,2014(8):76-77
[5] 干信.用超临界CO2萃取法从沙蚕中提取高纯度沙蚕毒素的研究[J].科学技术,1997(5):35-36
[6] 邓志会,孙贺,林岩,等.一种新型具有纤溶活性的沙蚕金属蛋白酶的分离及性质研究[J].中国生物化学与分子生物学报,2011;27(8):768-74
[7] 邓志会,孙东升,李波,等.沙蚕金属蛋白酶体外抗凝血与溶栓作用[J].中国老年学杂志,2012,11(32):4709-4710
[8] 张伟云,陈颢,汪水娟,等.沙蚕纤溶酶的一种纯化方法[J].中草药,2001,32(8):673-674
[9] 白若伦,李奇,刘佳,等.沙蚕蛋白酶对血小板聚集及血液流变学的影响[J].中国新药杂志,2009,18(10):930-933
[10] 张云龙,崔佳乐,付海英,等.溶栓素的分离纯化及特性测定[J].中国生化药物杂志,2005,26(1): 18-21
[11] 李奇,迟秀梅,石立红,等.N-V蛋白酶体内外纤维蛋白溶解活性的实验研究[J].中国药理学通报,2006,22(8): 976-979
[12] 李奇,洪敏,付海英,等.溶栓素抗凝血和抗血栓形成作用的实验研究[J].吉林大学学报(医学版),2004,30(3): 401-403
[13] 李云磊,张荣生,李峰,等.沙蚕活性物质的分离提取及对HeLa细胞的毒性分析[J].福州大学学报(自然科学版),2014,42(1):149-153
[14] 陈颗,张伟云,谭仁祥,等.沙蚕激酶及其提取方法和用途.中国发明专利:98111280.3[P].1999
[15] 潘卫东,戈峰.一种从双齿围沙蚕中提取的蛋白质及其制备方法和用途.中国发明专利:03102033.X[P]
[16] 汪靖超,赵峰,李荣贵,等.双齿围沙蚕蛋白酶的纯化及其性质[J].世界华人消化杂志,2007,15(8):500-506
[17] 李荣贵,赵峰,杨宏,等.重组沙蚕溶栓活性蛋白酶的纯化及其性质研究[J].中国海洋药物,2007,26(2):1-6
[18] Wahidulla S,d'Souza L,Govenker M.Lipid constituents of the red alga Acantophora spicifera.Phytochemistry,1998,48:1203-1206
[19] 苏镜娱,龙康侯,简志刚.中国柳珊瑚化学成分的研究(v)[J].中山大学学报,1984(1):97-101
Constituents in Perinereis aibuhitensis and inhibitory activity of all extracts from P.aibuhitensis against tumour cells
SONG Shu mei1,MA Rui xiao1,JIN Feng qing1,TONG Chang qing1,ZHAI Xing yue2,LI Wei1
(1.College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China; 2.Nutrition Department,The Second Hospital of Dalian Medical University,Dalian 116023,China)
Abstract :Two compounds were isolated from Perinereis aibuhitensis by column chromatography on silica gel and thin layer chromatography.Their structures were identified by spectroscopic analysis and physical-chemistry properties.The inhibition on tumour cells of all extracts from P.aibuhitensis were evaluated by CCK-8 assay.The results showed that two compounds were obtained and identified as cholest-4-ene-3α,6β-diol and (E)-17-(4,7-dimethyloct-5-en-2yl)-10,13-dimethyl-2,3,4,7,8,9,10,11,12,13,14,15,16,17-tetradecahydro-1H-cyclopenta [a] phenanthren-3-ol.All extracts from P.aibuhitensis using 75% EtOH and ethyl acetate layer exhibited the potent inhibitory activities against HepG2,AGS and SKOV3 cells.The extracts could be considered as potential anticancer candidate for further study.
Key words :Perinereis aibuhitensis;constituent;structural identification;tumour cell
(收稿日期:2015-07-29)
