绿茶和红茶多酚类化合物的抗病毒活性在新型冠状病毒肺炎预防和治疗中的应用
2021-09-10印度孟买化学技术研究所药物科学与技术系
印度孟买化学技术研究所药物科学与技术系





新冠肺炎疫情的流行发生已对世界政治、经济和人类健康产生严重影响。近期一篇由印度专家Susmit Mhatre等撰写的介绍绿茶中儿茶素和红茶中茶黄素对新型冠状病毒肺炎(COVID-19)的抗病毒活性的论文《Antiviral activity of green tea and black tea polyphenols in prophylaxis and treatment of COVID-19:
A review》在Phytomedicine上发表,这是世界上最详细报道茶叶中活性成分对COVID-19病毒活性研究的综述。为了提供给我国更多茶业界人士参考,特摘译如后。 ——陈宗懋
摘要:新型冠状病毒SARS-CoV-2或nCoV的迅速传播,已引起世界各国的高度重视并采取严格的预防和隔离措施。这个新的单链RNA冠状病毒通过唾液和鼻腔分泌物传播。鉴于新型冠状病毒感染病例数日益增多,美国食品药品监督管理局(FDA)已授权紧急使用瑞德西韦(Remdesivir)治疗,但至今仍然没有任何一种药物获批准用于治疗COVID-19。另一种替代的方法是用一些已知具有抗病毒特性的天然物质分子进行治疗。有报道证实,绿茶中的表没食子儿茶素没食子酸酯(EGCG)和红茶中的茶黄素对各种病毒,特别是对单链RNA病毒具有抗病毒活性。最近的研究揭示了在SARS-CoV-2病毒上存在可能的结合位点,并研究了它们与茶叶多酚类化合物之间的相互作用。这篇综述中也关注到EGCG和茶黄素,特别是茶黄素-3,3'-双没食子酸酯(TF3)和病毒上的受体有非常明显的相互作用。有些对接实验研究重点关注了这些多酚类化合物在抗COVID-19病毒方面的活性。文章对现有报道和支持使用茶多酚化合物作为预防和治疗COVID-19可能的候选药物的证据进行了综述。
关键词:COVID-19;SARS-CoV-2;茶多酚;EGCG;茶黄素
Antiviral Activity of Green Tea and Black Tea
Polyphenols in Prophylaxis and
Treatment of COVID-19: A Review
SUSMIT Mhatre, TISHYA Srivastava, SHIVRAJ Naik, VANDANA Patravale*
Department of Pharmaceutical Sciences and Technology, Institute of Chemical Technology, Mumbai, India
Abstract: The rapid spread of novel coronavirus called SARS-CoV-2 or nCoV has caused countries all over the worldto impose lockdowns and undertake stringent preventive measures. This new positive-sense single-stranded RNAstrain of coronavirus spreads through droplets of saliva and nasal discharge. Us FDA has authorized the emergencyuse of Remdesivir looking at the increasing number of cases of COVID-19, however there is still no drug approvedto treat COVID-19. An alternative way of treatment could bethe use of naturally derived molecules with knownantiviral properties. We reviewed the antiviral activities of two polyphenols derived from tea, epigallocatechin-3-gallate (EGCG) from green tea and thea ?avins from black tea. Both green tea and black tea polyphenols have been reportedto exhibit antiviral activities against various viruses, especially positive-sense single-stranded RNA viruses. Recentstudies have revealed the possible binding sites present on SARS-CoV-2 and studied their interactions with teapolyphenols. EGCG and theaflavins, especially theaflavin-3,3'-digallate (TF3) have shown a significant interaction with the receptors under consideration in this review. Some docking studies further emphasize on the activity of these polyphenols against COVID-19. This review summarizes the available reports and evidences which support theuse of tea polyphenols as potential candidates in prophylaxis and treatment of COVID-19.
Keywords: COVID-19, SARS-CoV-2, tea polyphenols, EGCG, theaflavin
COVID-19是一种病毒性疾病,它影响呼吸系统上皮细胞,引起黏膜炎症,导致肺泡损伤并最终导致肺炎。它的病原体是SARS-CoV-2病毒,是一种正义单链RNA冠状病毒,俗称新型冠状病毒。此前,有报道冠状病毒可引起非典型肺炎(SARS)和中东呼吸系统综合征(MERS)[1]。正在进行的一些临床试验药物中,羟氯喹(Hydroxychloroquine)、法维拉韦(Favipiravir)、瑞德西韦(Remdesivir)和洛匹那韦(Lopinavir)/利托那韦(Ritonavir)已引起较多的关注[2]。其他几种抗病毒药物和新的化学分子也正用于抗冠状病毒治疗的研究。还有一些以前证实有抗病毒效果的食用营养分子作为候选方剂用于评价治疗COVID-19。
本文综述了绿茶和红茶中一些多酚类化合物的活性,特别是EGCG。EGCG和茶黄素曾用于对一些病毒的活性研究,发现它们的治疗效果可能优于一些化学合成药物。
一、SARS-CoV-2病毒的结构
SARS-CoV-2病毒与SARS-CoV、MERS-CoV两种病毒的基因组相似度达79%和50%[3]。也有研究显示SARS-CoV-2病毒和SARS-CoV病毒核苷酸相似度达89.1%,同源性达80%[4-5]。
病毒有4种主要的结构蛋白:棘突蛋白(S)、被膜蛋白(E)、膜蛋白(M)和核壳体蛋白(N),以及其他非结构性蛋白(Nsps)[6]。SARS-CoV-2病毒感染宿主细胞主要是其借助S蛋白结合宿主细胞的血管紧张肽转换酶(ACE2)受体得以实现[7]。
二、SARS-CoV-2病毒的活性结合
位点和其他靶标
在SARS-CoV-2病毒上有许多结合位点可以作为药物的作用靶标,新冠肺炎研究中的主要靶标有如下几个。
1. 糜蛋白样蛋白酶(3CLpro,PDB ID:6LU7)
3CLpro是SARS-CoV病毒的主要酶类,主要在病毒的成熟阶段发挥蛋白水解的功能。因此,3CLpro是药物抗冠状病毒最主要的靶标。预测小分子物质和肽抑制剂可以抑制3CLpro酶的活性。
2. RNA依赖的RNA多聚酶(RdRp,RDB ID:6NUR)
RdRp(Nsp12)是关键酶,它在病毒的复制和转录中具有重要的作用。借助其他辅助因子Nsp7和Nsp8,Nsp12和RNA之间的相互作用得到加强,由此也增强了RdRp的活性。因此Nsp12-RdRp是治疗COVID-19病毒的重要药物靶标。
3. 血凝集素酯酶(HE,PDB ID:3CL5)
HE是存在于β-冠状病毒中的一种结构蛋白,并被认为是β-冠状病毒的标记物之一。HE起着受体破坏酶和作为凝集素依附在O-乙酰化-唾液酸上的双重作用。因此,HE-唾液酸复合体(PDB ID: 3CL5)是COVID-19病毒的又一个药物靶标。
4. 木瓜蛋白酶样蛋白酶(PLpro,PDB ID:40WO)
PLpro可裂解多聚蛋白的N终端形成Nsps、Nsp1、Nsp2和Nsp3。PLpro在躲避宿主细胞的先天免疫方面起着关键作用。由于PLpro酶在病毒复制中的重要功能,所以它也成为另一个重要的药物靶標。
5. 2'-O-甲基转移酶(2'-O-MTase,PDB ID:3R24)
2'-O-甲基转移酶(Nsp16)与Nsp10相结合得到了活化。鉴于Nsp10-Nsp16复合体(PDB:3R24)在病毒复制中的不可或缺性,估计它也是未来一种药物治疗的靶标。
6. 解旋酶(PDB ID:6JYT)
解旋酶(NSP 13) 在N端上有1个金属结合域和1个解旋酶结构域,具有对双链的寡核苷酸在5'-3'位置上解旋的功能。因此NSP 13是抗冠状病毒的又一个重要靶标。
7. 棘突RBD(PDB ID:6LKT)
RBD 是位于S1亚单位的S蛋白的主要结合域,它与宿主细胞ACE2受体形成复合体。ACE2的18个残基和RBD上的14个氨基酸相接合,其中最重要的是ACE2中的K341和RBD中的R453黏合。任何对这种复合体抑制都能成为一种有前景的靶标药物。
8. 结构蛋白(S-PBD ID:3SCI,E-PDB ID:5X29,N-PDB ID:1SSK,2CJR)
除了RBD,在S2亚单位中的S蛋白上还有另一个药物靶标。病毒融合后的状态可发现HR1/HR2域,它呈典型的6个螺旋形复合体(PDB ID:1WYY)。这个复合物可以作为预防靶标。
9. ACE2受体(PDB ID:6ACK)
ACE2受体是病毒S蛋白的主要结合位点,二者接合便于病毒进入宿主细胞。SARS-CoV-2病毒S蛋白对ACE2受体的亲和力高于SARS-CoV病毒。因此ACE2受体和ACE2-RBD(PDB ID:6VW1)的复合物是预防新型冠状病毒的两个重要位点。
10. 葡萄糖调控蛋白(GRP78,PDB ID:3LDL)
GRP78俗称结合免疫球蛋白(BIP)或热休克蛋白,是内质网腔(ER)中的一种伴侣蛋白。它的功能是阻止蛋白质折叠转移到内质网中,使该蛋白可以积累到阈值以上。SARS-CoV-2病毒的S蛋白和GRP78能相互作用,这种S蛋白相对应的GRP78的结合位点是针对新型冠状病毒的一个良好的药物靶标。
三、EGCG的抗病毒特性
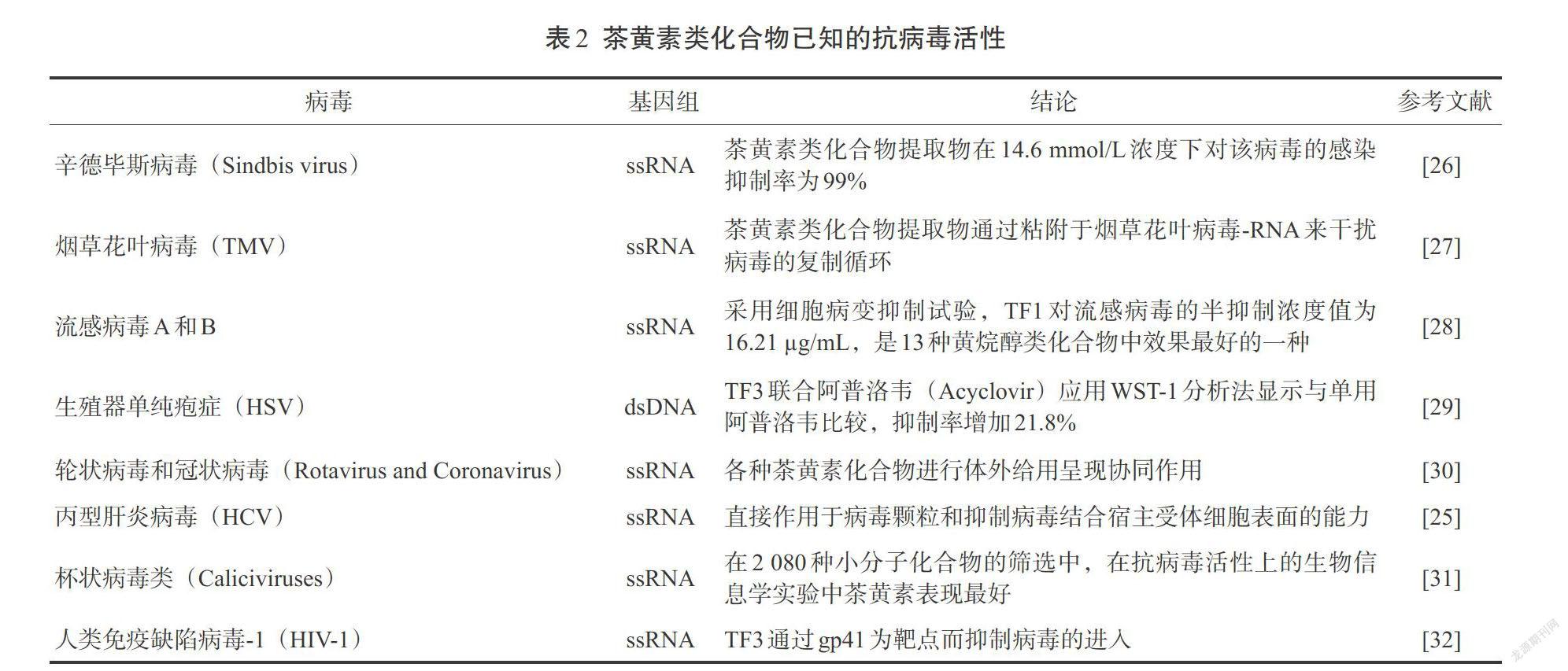
已有多项研究发现了茶多酚尤其是EGCG的抗病毒活性。表1是EGCG抗病毒活性的一些研究文献。EGCG被发现可抑制猪繁殖和呼吸综合征病毒(PRRSV)感染,无论在病毒侵染前或侵染后都是有效的,125 µmol/L浓度足够完全抑制病毒的感染[8]。对于丙型肝炎病毒(HCV),EGCG通过黏附靶细胞能阻止HCV感染并传播到其他细胞[9]。有研究表明EGCG可透过胎盘屏障并到达胎儿的脑部、眼睛和心脏部位,因此在孕妇和胎儿中EGCG可能都会发挥作用。EGCG不仅可抑制细胞内基孔肯雅病(Chikungunya)的病毒复制,还可以在对病毒感染前期和后期抑制细胞外感染[10]。
预期EGCG除了已知的可通过抑制红细胞凝聚来影响病毒的黏附外,还可以抑制流感病毒循环的中间环节。EGCG还对人类免疫缺陷病毒1型(HIV-1)有效,并在不同阶段抑制病毒的复制。它主要是通过干扰逆转录酶来阻断gp120和CD4之间的相互作用。有一份报告显示EGCG可抑制p24抗原在分离的CD4受体细胞上产生[11]。另一项研究显示即使饮用不同浓度的绿茶,EGCG对抑制gp120-CD4的黏附也是有效的[12]。
四、茶黄素的抗病毒特性
茶黄素及其衍生物的抗病毒特性已经在为数不多的病毒性疾病中开展研究报道(表2)。在一项对HSV-1的研究中,分别检测所有的茶黄素化合物,发现TF1、TF2和TF3在病毒的溶解过程中显示出很强抑制作用,其中TF3的抑制作用最强。当用50 μmol/L浓度的TF3处理1 h时,对病毒分子感染抑制作用高达99%以上 [21]。在另一研究中发现TF2在体内可抑制COX-2、TNF-A、1CAM-1和NFkB mRNA表达水平,显示其有抗炎效果。在一項对流感病毒的研究中也证明了茶黄素类化合物通过对神经氨酸酶的抑制作用而显示抗病毒活性。TF3的活性超过其他衍生物,效果与奥司他韦的功效相似[22]。TF3还可阻止病毒进入到马丁达比狗肾(MDCK)细胞,从而抑制病毒的血凝素[23]。在所有茶多酚类化合物中,TF2b是活性最强的,它在1μmol/L浓度下可抑制HIV,选择性系数远大于200。茶黄素上的没食酯酰基的数量与其活性具有直接相关性。据估计,这些分子和gp41六螺旋相互作用以阻止病毒进入宿主细胞。在较高的浓度下,茶黄素可抑制HIV逆转录酶[24]。茶黄素在2 080种小分子中对诺沃克类病毒具有最强的生物信息学的抗病毒活性。研究发现茶黄素结构上的羟基在活性上比没食子酰基更为重要。研究报道茶黄素可以通过抑制丙型肝炎病毒颗粒黏附细胞受体表面来发挥活性。在抗丙型肝炎病毒方面,TF3的突出特点是抗病毒活性优于TF1和TF2[25]。
五、在抗新冠病毒肺炎中的应用
1. 对3CLpro的抑制作用
在一项对植物化学抑制SARS-CoV 3CLpro的研究中,EGCG分子对接得分值为-11.7时,显示出其在所有筛选化合物中具备最佳活性。体外检测显示EGCG在200 μmol/L浓度下对3CLpro的抑制率达85%,半抑制浓度为(73±2)μmol/L[32]。最近,在SARS-CoV 3CLpro的研究中发现用更高生物利用率的EGCG类似物还可以进一步改善其病毒抑制活性。在另一项分子对接研究中发现,植物化学物中EGCG本质上是诸多化合物中对3CLpro最有潜力的抑制物之一[33]。在这些研究的基础上,可以期待EGCG可能成为COVID-19治疗中一种有潜力的3CLpro的抑制物,这可能与EGCG和其他儿茶素的性质不稳定特性有关。在一项关于SARS-CoV的研究中发现,TF1、TF2a、TF2b和TF3比其他包括EGCG在内的IC50小于10 μmol/L浓度的儿茶素,对3CLpro的抑制作用更具有潜在的应用价值。在茶黄素中,TF2b和TF3由于具有没食子酸酯因而显示较好的3CLpro的抑制活性[34]。与Lopinavir、Darunavir和Atazanavir等药物相比,TF2b与3CLpro受体结合形成较多的氢键,因此显示维持相互作用抑制病毒的活性。其他类似研究也表明TF3(-10.574)比其他抗病毒药物如Lopinavir(-9.918)、Darunavir(-8.843)、Amprenavir(-8.655),以及橙皮素、Biorobin和迷迭香酸等植物化合物具有更高的对接得分值[35]。有文献报道了用TF预防SARS-CoV-2感染的分子对接实验,TF2在3CLpro受体上的对接分值为-9.8,TF3的对接分值为-10[36]。
2. 对RDRP的抑制作用
Lung等[37]的研究发现,除中国传统中药中已知的83个分子外,TF具有最强的黏结能力,为-38.12 kJ/mol。
3. 对棘突RBD抑制作用
研究发现,茶黄素与SARS-CoV-2中的RBD具有高的结合力,同时具有很高的对接分值。故与SARS-CoV-2中的RBD具有高效的相互作用,其黏结能力约为-35.69 kJ/mol[38]。
4. 对结构蛋白的抑制作用
Khan等[39]的一项对接研究实验发现,有18种植物成分与新型冠状病毒的7种不同蛋白作用而发挥抗病毒活性,这项对接实验结果与2种对COVID-19可能最有效的药物Remdesivir和氯喹(Chloroquine)进行了比较。SARS-CoV-2病毒上具有治疗作用的分子位点如图1所示。EGCG显示出了非常高黏结亲和能力和低抑制常数,尤其是对6vw1,这是SARS-CoV-2的一个重要靶标。表3和表4为EGCG和Remdesivir、Chloroquine的黏结能力和抑制常数可比性的评价结果,这项研究的亮点在于显示了EGCG与病毒蛋白具有较好的黏结能力,与对照药物(Remdesivir和Chloroquine)相比,具有值得期待的更好的抗病毒活性[40]。
验证茶黄素对SARS-CoV-2病毒的抗病毒活性研究中,Zhang等[41]用169种经典调味作用的植物化学物进行对比研究,结果发现茶黄素和M蛋白酶有相当高的亲和力,同时具有抗氧化活性。
5. 对ACE2受体黏结能力的抑制作用
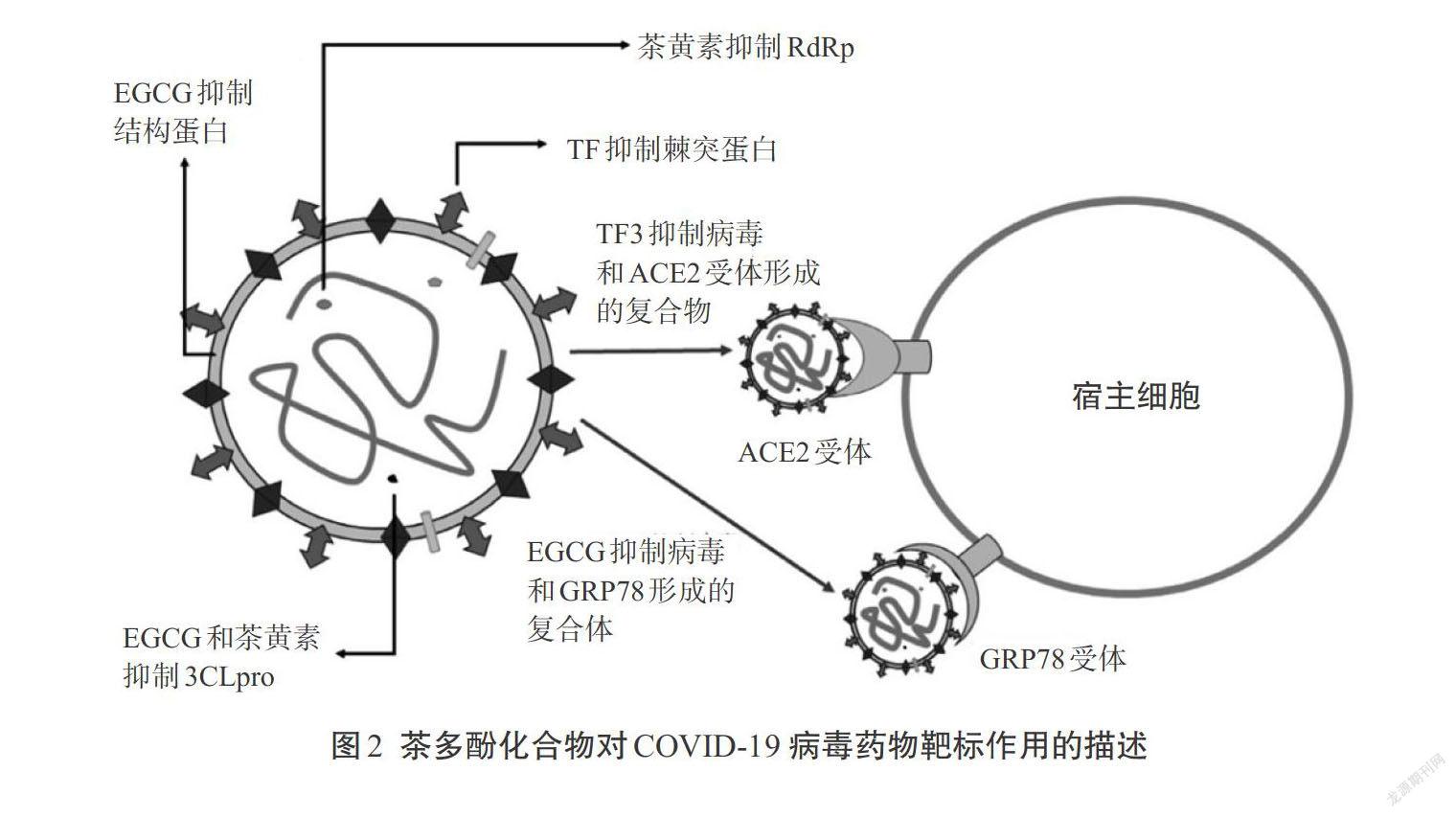
因为ACE2受体是病毒S蛋白的RBD结合位点,因此直接和ACE2相互作用可以预防病毒对细胞的侵染。TF3可直接结合到ACE2受体上,因此可用以预防病毒侵染[41]。Malti和Banerjee证明了TF3可阻止棘突RBD结合到ACE2受体上。
6. 对葡萄糖调控蛋白78(GRP78)的抑制作用
Bhattacharjee等[42]发现EGCG通过形成许多氢键和非键与这个药物靶标相互作用,可以预期EGCG是一个有潜力的COVID-9 S蛋白GRP78结合位点的抑制剂。图2展示茶多酚在不同活性位点上的可能作用机制。表5总结了茶多酚类化合物针对新型冠状病毒的一些研究结果。
六、挑战与未来前景
COVID-19传播速度惊人,缺乏批准的治疗方法正给医疗系统带来沉重的负担。一些抗病毒药物正在临床试验中,却因在较高剂量时可能出现副作用不能在临床中得到应用。已有报道EGCG和茶黄素对各种病毒感染具有抗病毒活性,深度分析这两种物质的抗病毒活性揭示了它们存在着广谱的抗病毒分子,并且没有明确的相互作用位点,在病毒复制的不同阶段发挥作用。许多研究提示EGCG和茶黄素具有预防性抗病毒活性。3CLpro是一种在SARS-CoV病毒和SARS-CoV-2病毒上发现的至关重要的酶类。考虑到这两种病毒基因组的相似性,由他们合成3CLpro酶的性质也相似。由于在病毒细胞复制中的重要作用,3CLpro也可能是一种药物作用的靶标。研究發现EGCG 和茶黄素在很低的浓度下可抑制3CLpro,并与靶标有良好的黏结作用。茶黄素与SARS-CoV-2病毒的RBD有很好的黏结作用,通过疏水键及氢键与病毒S蛋白上的某些位点发生相互作用。此外,茶黄素已知具有RdRp抑制作用和ACE2的黏结活性。因此,EGCG和茶黄素都是具备潜力的抗病毒剂,可以探索应用于COVID-19的治疗和预防中。GRP78是在内质网(ER)中发现的一种蛋白,它在阻止合成蛋白的展开中发挥作用。EGCG已知可与COVID-19 S蛋白GRP78连接位点相互作用,这是一个可能的药物靶标,通过氢键和非键的相互作用发挥抗病毒活性。已有研究证明茶多酚具有广谱抗病毒活性,茶多酚或多或少显示出对COVID-19潜在的抑制活性。只有进一步研究才可以详细地分析它们之间的相互作用。
EGCG口服利用率低,在到达靶点前极易被氧化。因此,一些研究建议用其结构衍生物来提高利用率。EGCG酯衍生物具有较高的抗氧化活性,还有研究显示用钠米颗粒封装EGCG以获得更好的功效。此外,EGCG和其他抗病毒药物联用可以改善其生物利用率。在一项涉及HCV的研究项目中,EGCG和一些单克隆抗体联用可以改善EGCG在体内的递送。通过对水溶性的EGCG,如棕榈酸酯EGCG和硬脂酸酯EGCG等的亲脂衍生物的抗微生物性能的研究发现,EGCG棕榈酸酯抗HSV侵染的效果比EGCG高8.7倍[45]。用丁酰基、辛酰基、月桂醇、棕榈酸酯和二十烷基修饰来合成EGCG单酯衍生物,验证其烷基长度对抗流感活性的影响,此研究观察到长酰基可以显著增加EGCG的抗流感活性。在所有的EGCG酯型衍生物中,以EGCG棕榈酸酯最为有效,效果比EGCG单酯高24倍[46]。硬脂酸酯 EGCG可抑制HSV侵染。在对EGCG的不同位点上进行甲基化、乙酰化、酯化或糖基化等的替换,可以改善EGCG的药效药代动力学[12]。EGCG及其衍生物在抑制多种病毒感染中有很好的应用前景,因此借助分子对接研究方法,今后在抗新冠肺炎病毒上值得对这些分子进行应用研究。
综合而言,对EGCG和茶黄素这两种多酚类化合物需要进一步详细评估去证实其抗新冠肺炎病毒的应用效果。在多种茶黄素中,特别是TF2b和TF3,与RBD有良好的结合能力,可以用作良好的预防剂。鉴于EGCG 及其稳定的亲酯性衍生物具有与SARS-CoV-2的不同活性位点的对接特性,未来可能成为极具潜力的预防和治疗药物。
茶是当今世界上消费最广泛的饮品,FDA已经将这些多酚类化合物列为比较安全可用状态(GRAS),这将进一步鼓励使用高剂量来合成中毒剂量的抗病毒药物。但现在谈论EGCG和茶黄素作为药物替代品还为时尚早。由于这些多酚类化合物具有非特异活性,还不能确定其对新型冠状病毒受体的靶标活性,它们也可能和体内的其他蛋白黏附并产生副作用。因此,这些分子可能暂时不会用于新型冠状病毒的治疗,而是作为膳食辅助剂或功能食品。在对这些多酚的特异性、活性、生物利用率和安全性进行广泛研究后,可以考虑将其用于治疗包括COVID-19在内的病毒感染。
参考文献
[1] XIE M X, CHEN Q. Insight into 2019 novel coronavirus — an updated interim review and lessons from SARS-CoV and MERS- CoV[J]. International Journal of Infectious Diseases, 2020, 94: 119-124.
[2] ELAZIZ T M A, STOCKAND J D. Recent progress and challenges in drug development against COVID-19 coronavirus (SARS-CoV-2) - an update on the status[J/OL]. Infection, Genetics and Evolution, 2020, 83: 104327(2020-05-19). https://doi.org/10.1016 /j.meegid.2020. 104327.
[3] LU R J, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. The Lancet, 2020, 395: 565-574.
[4] WU C R, LIU Y, YANG Y Y, et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computationa l methods[J]. Acta Pharmaceutica Sinica B, 2020, 10(5):766-788.
[5] ZHOU P, YANG X L, WANG X G, et al. Discovery of a novel cor- onavirus associated with the recent pneumonia outbreak in humans and its potential bat origin[J/OL]. bioRxiv, 2020, 914952 (2020-01-22). https://doi.org/10.1101/2020.01.22.914952.
[6] BOSCH B J, VAN DER ZEE R, DE HAAN C, et al. The coronavirus spike protein is a class I virus fusion protein: structural and functional characterization of the fusion core complex[J].Journal of Virology, 2003, 77(16): 8801-8811.
[7] ZHOU P, YANG X L, WANG X G, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579: 270-273.
[8] GE M, XIAO Y, CHEN H, et al, Multiple antiviral approaches of (-)-epigallocatechin-3-gallate (EGCG) against porcine reproductive and respiratory syndrome virus infection in vitro[J]. Antiviral Res, 2018, 158.
[9] CALLAND N, ALBECKA A, BELOUZARD S, et al. (-)-Epigallocatechin-3-gallate is a new inhibitor of hepatitis C virus entry[J]. Hepatology, 2012, 55(3): 720-729.
[10] LU J W, HSIEH P S, LIN C C, et al. Synergistic effects of combination treatment using EGCG and suramin against the chikungunya virus[J]. Biochemical and Biophysical Research Communications,2017, 491(3): 595-602.
[11] NANCE C L, SIWAK E B, SHEARER W T. Preclinical development of the green tea catechin, epigallocatechin gallate, as an HIV-1 the- rapy[J]. Journal of Allergy and Clinical Immunology, 2009, 123(2): 459-465.
[12] XU J, XU Z, ZHENG W. A review of the antiviral role of green tea catechins[J]. Molecules, 2017, 22(8): 1337.
[13] SANDRA CIESEK, THOMAS VON HAHN, CHE C COLPITTS, et al. The green tea polyphenol, epigallocatechin-3-gallate, inhibits hepatitis C virus entry[J]. Hepatology, 2011, 54(6): 1947-1955.
[14] LIU S W, LU H, ZHAO Q, et al. Theaflavin derivatives in black tea and catechin derivatives in green tea inhibit HIV-1 entry by targeting gp41[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2005, 1723(1/2/3): 270-281.
[15] CHOUIN-CARNEIRO T, VEGA-RUA A, VAZEILLE M, et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the americas to Zika virus [J/OL]. PLOS Neglected Tropical Dieases, 2016, 10(3): e0004543. https://doi.org/10.1371/journal.pntd.0004543.
[16] RAEKIANSYAH M, BUERANO C C, LUZ M D, et al. Inhibitory effect of the green tea molecule EGCG against dengue virus infection[J]. Archives of Virology, 2018, 163: 1649-1655.
[17] SONG J M, LEE K H, SEONG B L. Antiviral effect of catechins in green tea on influenza virus[J]. Antiviral Research, 2005, 68(2): 66-74.
[18] HO M X, HUDSON B P, DAS K, et al. Structures of RNA polymerase-antibiotic complexes[J]. Current Opinion in Structural Biology, 2009, 19(6): 715-723.
[19] ST PATRICK REID, AMY C SHURTLEFF, JULIE A COSTA- NTINO,et al. HSPA5 is an essential host factor for Ebola virus infection[J]. Antiviral Research, 2014, 109: 171-174.
[20] DONG JOO SEO, SU BEEN JEON, HYEJIN OH, et al. Comparison of the antiviral activity of flavonoids against murine norovirus and feline calicivirus[J]. Food Control, 2016, 60: 25-30.
[21] DE OLIVEIRA A, PRINCE D, LO C Y, et al. Antiviral activity of theaflavin avindigallate against herpes simplex virus type 1[J]. Antiviral Research, 2015, 118: 56-67.
[22] ZU M, YANG F, ZHOU W L, et al. In vitro anti-influenza virus and anti-inflammatory activities of theaflavin derivatives [J]. Antiviral Research, 2012, 94(3): 217-224.
[23] NAKAYAMA M, SUZUKI K, TODA M, et al. Inhibition of the infectivity of influenza virus by tea polyphenols[J]. Antiviral Rese- arch, 1993, 21(4): 289-299.
[24] JIE Y, LI L, TAN S, et al. A natural theaflavins preparation inhibits HIV-1 infection by targeting the entry step: potential applications for preventing HIV-1 infection[J]. Fitoterapia, 2011, 83: 348-355.
[25] CHOWDHURY P, SAHUC M E, ROUILLÉ Y, et al. Thea?avins, polyphenols of black tea, inhibit entry of hepatitis C virus[J/OL]. Biorxiv, 2018 (2018-05-17). https://doi.org/10.1101/325126.
[26] VILLAGOMEZ J. In vitro antiviral activity of black tea polyphenols on sindbis virus in vero cells[D]. Dissertations and Culminating Projects. 2017.
[27] OKADA F, TAKEO T, OKADA S, et al. Antiviral e?ect of theaflavins on tobacco mosaic virus[J]. Agricultural and Biological Chemistry, 1977, 41(5): 791-794.
[28] YANG Z F, BAI L P, HUANG W, et al. Comparison of in vitro anti- viral activity of tea polyphenols against influenza A and B viruses and structure-activity relationship analysis[J]. Fitoterapia, 2014, 93:47-53.
[29] BERKEFELD CJ. In vitro synergistic antiviral activity of black tea theaflavins and acyclovir on herpes simplex virus types 1 and 2 in A549 cells[R]. Dissertations and Culminating Projects, 2015.
[30] CLARK K J, GRANT P G, SARR A B, et al. An in vitro study of theaflavins extracted from black tea to neutralize bovine rotavirus and bovine coronavirus infections[J]. Veterinary Microbiol, 1998, 63(2/3/4): 147-157.
[31] OHBA M, OKA T, ANDO T, et al. Antiviral effect of theaflavins ag- ainst caliciviruses[J]. The Journal of Antibiotics, 2017, 70: 443-447.
[32] THI THANH HANH N, WOO H J, KANG H K, et al. Flavonoid-mediated inhibition of SARS coronavirus 3C-like protease expressed in Pichia pastoris[J]. Biotechnol Lett, 2012, 34:831-838.
[33] KHAERUNNISA S, KURNIAWAN H, AWALUDDIN R, et al. Potential inhibitor of COVID-19 main protease (Mpro) grom several medicinal plant compounds by molecular docking study[EB/OL]. (2020-03-13). https://www.preprints.org/manuscript/202003.0226/v1.
[34] CHEN C N, LIN C P C, HUANG K K, et al. Inhibition of SARS- CoV 3C-like protease activity by theaflavin-3,3’-digallate (TF3)[J]. Evidence Based Complementary & Alternative Medicine, 2005, 2(2):209-215.
[35] PEELE K A, POTLA DURTHI C, SRIHANSA T, et al, Molecular docking and dynamic simulations for antiviral compounds against SARS-CoV-2: a computational study[J/OL]. Informatics in Medicine Unlocked, 2020, 19: 100345. https://doi.org/10.1016/j.imu.2020.100345.
[36] BHATIA S, GIRI S, LAL A F, et al. Battle against coronavirus: rep- urposing old friends (food borne polyphenols) for new enemy (COVID-19) [EB/OL]. (2020-04-13). http://dx.doi.org/10.26434/ chemrxiv.12108546.
[37] LUNG J, LIN Y S, YANG Y H, et al, The potential chemical structure of anti-SARS-CoV-2 RNA-dependent RNA polymerase[J]. Journal of Medical Virology, 2020, 92(6): 693-697.
[38] LUNG J, Lin Y S, YANG Y H, et al. The potential SARS-CoV-2 entry inhibitor[EB/OL]. (2020-03-26). http://dx.doi.org/10.1101/ 2020. 03.26.009803.
[39] KHAN R J, KUMAR JHA R, AMERA G M, et al. Targeting novel coronavirus 2019: a systematic drug repurposing approach to den- tify promising inhibitors against 3C-like proteinase and 2'O-Ribose methyltransferase[EB/OL]. (2020-02-25). http://dx.doi.org/10.26434/ chemrxiv.11888730.v1.
[40] KHAN M F,KHAN M A, KHAN Z A, et al. Identification of dietary molecules as therapeutic agents to combat COVID-19 using molecular docking studies[EB/OL]. (2020-03-27). https:// www. researchsquare.com/article/rs-19560/v1.
[41] ZHANG J J, SHEN X, YAN Y M, et al. Discovery of anti-SARS- CoV-2 agents from commercially available ?avor via docking scr- eening[EB/OL]. (2020-03-02). https://osf.o/vjch2/.
[42] BHATTACHARJEE R, DEVI A, MISHRA S. Molecular docking and molecular dynamics studies reveal structural basis of inhibition and selectivity of inhibitors EGCG and OSU-03012 toward glucose regulated protein-78 (GRP78) overexpressed in glioblastoma[J]. Journal of Molecular Modeling, 2015, 21(10): 272.
[43] BHARDWAJ V K, SINGH R, SHARMA J, et al. Identification of bioactive molecules from tea plant as SARS-CoV-2 main protease inhibitors[J/OL]. Journal of Biomolecular Structure and Dy- namics, 2020 (2020-02-10). http://doi.org/10. 1080107391102. 2020 1766572.
[44] MAITI S, BANERJEE A. Epigallocatechin gallate and theaflavin gallate interaction in SARS-CoV-2 spike-protein central channel with reference to the hydroxychloroquine interaction: Bioinformatics and molecular docking study[J/OL]. Drug Development Research (2020-08-07). https://doi.org/10.1002/ddr.21730.
[45] HSU S. Compounds derived from epigallocatechin-3-gallate (EGCG) as a novel approach to the prevention of viral infections[J]. Inflammation & Allergy-Drug Targets, 2015, 14(1): 13-18.
[46] MORI S, MIYAKE S, KOBE T, et al. Enhanced anti-influenza A virus activity of (-)-epigallocatechin-3-O-gallate fatty acid monoester derivatives: effect of alkyl chain length[J]. Biovrganic & Medicinal Chemistry Lettesr, 2008,18: 4249-4252.
(陈宗懋 译)
