瘦素预处理抑制细胞凋亡减轻大鼠心肌缺血/再灌注损伤的研究
2021-09-02赵位昆鲁攀吕祥威
赵位昆, 鲁攀, 吕祥威
(1.桂林医学院 附属医院 综合科(医疗保健病区), 广西 桂林 541001;2.桂林医学院 附属医院 心血管内科, 广西 桂林 541001)
急性心肌梗死(acute myocardial infarction, AMI)是当前全球致死率和致残率主要的因素之一,对人类健康造成严重威胁[1].早期的溶栓或经皮冠状动脉介入术等再灌注是治疗AMI的主要手段[2],但阻塞的血管在恢复血液灌注后能够导致心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury, MIRI)的发生与发展,包括出现短暂的机械功能障碍、心肌顿抑和再灌注心律失常等病理改变[3-4].因此,更深层次地研究MIRI的作用途径,对防治MIRI的发生发展至关重要.凋亡是细胞的一种主动的、程序性死亡方式[5].心肌细胞凋亡参与多种心血管疾病的病理生理过程,如动脉粥样硬化、心脏重构、心肌纤维化、AMI和MIRI等[6-7].磷脂酰肌醇3-激酶(phosphoinositide 3-kinases, PI3K)/蛋白激酶B(protein kinase B, Akt)信号通路在调控细胞增殖、凋亡和分化等重要病理生理活动中发挥重要作用[8].其中,Akt是PI3K/Akt信号通路的中心环节,通过调控下游的多种效应分子在MIRI中发挥作用[9].瘦素(leptin, LEP)通过LEP受体在调控机体能量稳态、新陈代谢以及多种内分泌功能等方面发挥重要作用[10-11].研究发现LEP是调节心脏新陈代谢和功能的关键激素之一[12].另有研究证实LEP能够对心脏产生直接的保护作用进而减轻MIRI[13-14].而LEP通过何种途径对MIRI起到保护作用的相关报道较少,本文旨在探讨LEP预处理抑制心肌细胞凋亡改善MIRI的可能的作用机制.
1 材料与方法
1.1 主要试剂
LEP购自Abcam公司 (Cambridge, UK);PI3K、p-Akt、Bcl-2、Bax、Cleaved Caspase-3、β-tubulin和LY294002购自Cell Signaling Technology公司(MA, USA);2, 3, 5-triphenyltetrazolium chloride (TTC)、BCA蛋白定量试剂盒和二抗购自Beyotime公司 (Changsha, China);肌钙蛋白T(cardiac troponin T, cTnT) ELISA试剂盒购自Cusabio Biotech Co.公司 (MD, USA).
1.2 实验动物
成年雄性Sprague-Dawley大鼠24只,体质量200~230 g.实验动物在标准实验条件(温度20 ℃~25 ℃,湿度50%~60% 和12 h光照和黑暗交替循环.)下进行饲养,并给予洁净水与饲料.
1.3 实验设计和动物模型
按随机分组法将24只大鼠分为4组:正常组(Sham)、缺血/再灌注组(I/R)、瘦素+缺血/再灌注组(LEP+I/R)和LY(LY294002,LY)+LEP+I/R组.Sham组大鼠行开胸手术,但不结扎左冠状动脉前降支(LAD).I/R组大鼠手术结扎LAD造成缺血30 min,随后松开结扎线模拟再灌注2 h.LEP+I/R组大鼠在结扎LAD前30 min经尾静脉注射LEP(50 μg/kg)后构建MIRI模型.LY+LEP+I/R组大鼠结扎LAD前30 min经尾静脉分别注射LY294002(0.3 mg/kg)和LEP(50 μg/kg),随后再灌注2 h.
以戊巴比妥钠(40 mg/kg)对大鼠腹腔注射麻醉,随后接实验用动物呼吸机,参数设置为:呼吸频率80~90 次/min、呼吸比为2∶1、潮气量8~10 mL/kg.清除大鼠胸部毛发,经胸骨左缘第4肋间行开胸术充分暴露心脏,打开心包,找到LAD并使用6-0缝合线结扎30 min,然后松开结扎线模拟再灌注2 h.采用心电图仪记录心电图变化(标准Ⅱ导联),ST段抬高≥0.1 mV同时伴随结扎的血管远端供血区域心肌呈灰白色或者肿胀表明MIRI模型构建成功.
1.4 心肌梗死面积分析
2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)法检测心肌梗死面积.操作如下:模拟再灌注2 h后迅速取出大鼠心脏,用预先准备好的磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗去血液,随后放入-20 ℃冰箱保存30 min.将充分冷冻后的心脏标本切成3 mm厚并浸泡在TTC染色溶液中,随后放置在37 ℃温箱避光孵育30 min.梗死面积判定:白色或者灰白色代表梗死区域,红色代表非梗死区域.实验结果采用Image-Pro Plus 6.0软件进行分析.
1.5 心肌组织病理学检测
将PBS溶液处理后的大鼠心脏浸泡在体积分数为4%多聚甲醛中6 h.待心肌组织硬化成形后用石蜡进行包埋并切成3 mm厚的切片,常规HE染色.将随机选取的样品,光学显微镜下观察心肌组织病理变化(×400).心肌损伤评分标准:0分为心肌结构无损伤; 1分为轻度心肌组织间质水肿,间隙增宽和区域坏死; 2分为广泛的心肌细胞肿胀和组织间质水肿,以及中度的区域坏死; 3分为严重的小血管破坏和心肌坏死,大量的炎性细胞浸润,收缩带形成; 4分为严重的弥漫性心肌坏死和出血,伴有大量小血管破坏和收缩带形成.
1.6 心肌酶检测
使用剪刀将PBS溶液处理后的心脏剪碎,然后使用超声装置将心肌组织制成匀浆,在8 500 r/min、4 ℃条件下离心15 min.使用移液器提取上清液,参照ELISA试剂盒操作说明,检测cTnT表达水平.
1.7 心肌组织凋亡检测
将PBS溶液处理后的心脏在体积分数为4%多聚甲醛中浸泡6 h,待心肌组织硬化成形后用石蜡进行包埋并切成3 mm厚的切片.TUNEL法检测心肌细胞凋亡程度,其中棕色代表心肌凋亡细胞核,蓝色表示正常心肌细胞核.TUNEL阳性细胞核与每个视野内细胞核总数的比率为凋亡指数,每个标本中的观察视野选择放大倍数为400.使用Image-Pro Plus 6.0 软件对检测结果进行分析.
1.8 心肌组织蛋白质印迹分析
将每个心脏标本取100 mg组织放入质量分数为0.9%生理盐水中清洗,随后放入研磨管中,使用医用剪剪碎,加入含有苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)的RIPA裂解液(RIPA Lysis Buffer),在冰上静置30 min使心肌组织充分裂解,并使用移液器转移到2 mL离心管中.在12 750 r/min、4 ℃条件下离心15 min.使用BCA法(bicinchoninic acid, BCA)蛋白测定试剂盒检测心肌组织蛋白.然后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),将凝胶中的目标蛋白转移到聚偏二氟乙烯(PVDF)膜上.室温下PVDF使用PI3K、p-Akt、Bcl-2、Bax、Cleaved Caspase-3和β-tubulin抗体孵育8 h,随后使用二抗孵育4 h.使用chemiluminescence system系统(Amersham Pharmacia)进行蛋白表达检测与分析.
1.9 统计学分析
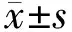
2 结果
2.1 大鼠MIRI模型的构建
如图1所示,结扎大鼠LAD导致心肌缺血30 min,期间心电图ST段显著升高.随后再灌注2 h可见ST段下降,与此同时出现再灌注心律失常(室性期前收缩),表明MIRI模型建立成功.
2.2 瘦素预处理能缩小大鼠心肌梗死面积
如图2所示,与Sham组比较,I/R组大鼠心肌梗死面积显著升高,LEP预处理能够缩小大鼠心肌梗死面积,LY294002能够逆转这种保护作用.
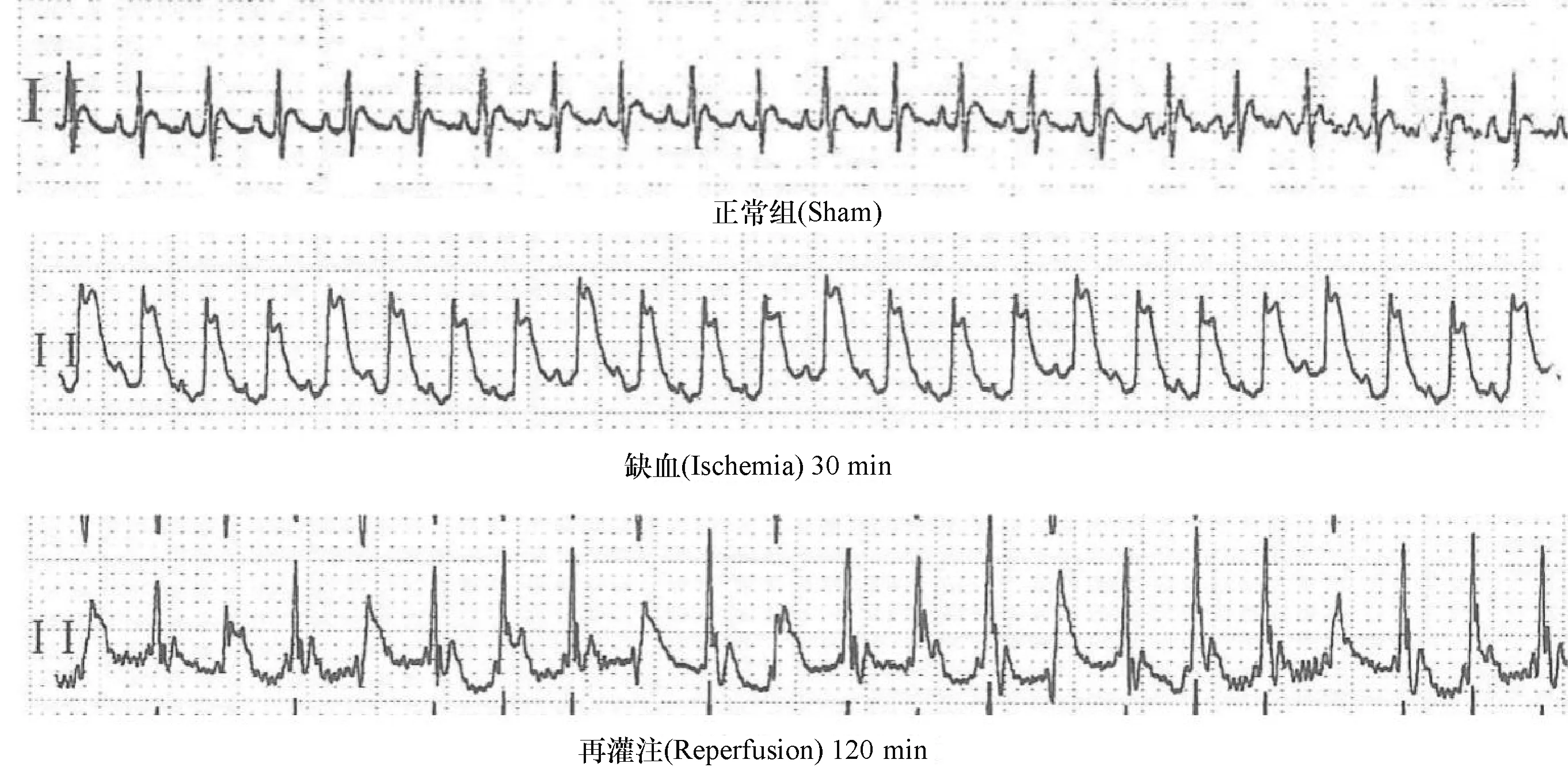
图1 大鼠心肌缺血与再灌注期间的心电图变化
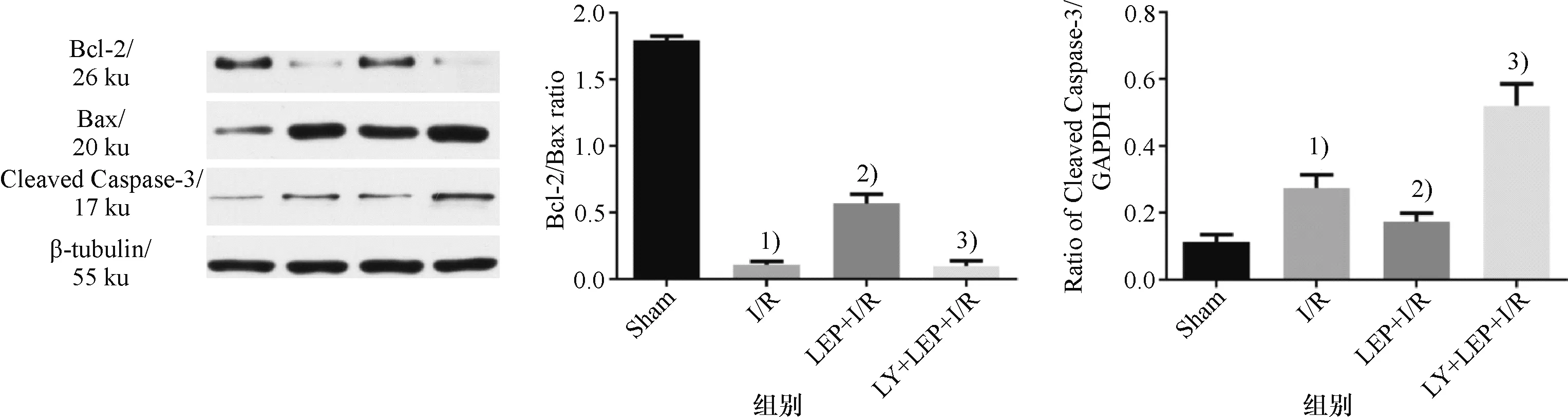
1)与Sham组比较,P<0.05;2) 与I/R组比较,P<0.05;3) 与LEP+I/R组比较,P<0.05.1) Compared with Sham group, P<0.05; 2) Compared with I/R group, P<0.05; 3) Compared with LEP+I/R group, P<0.05.
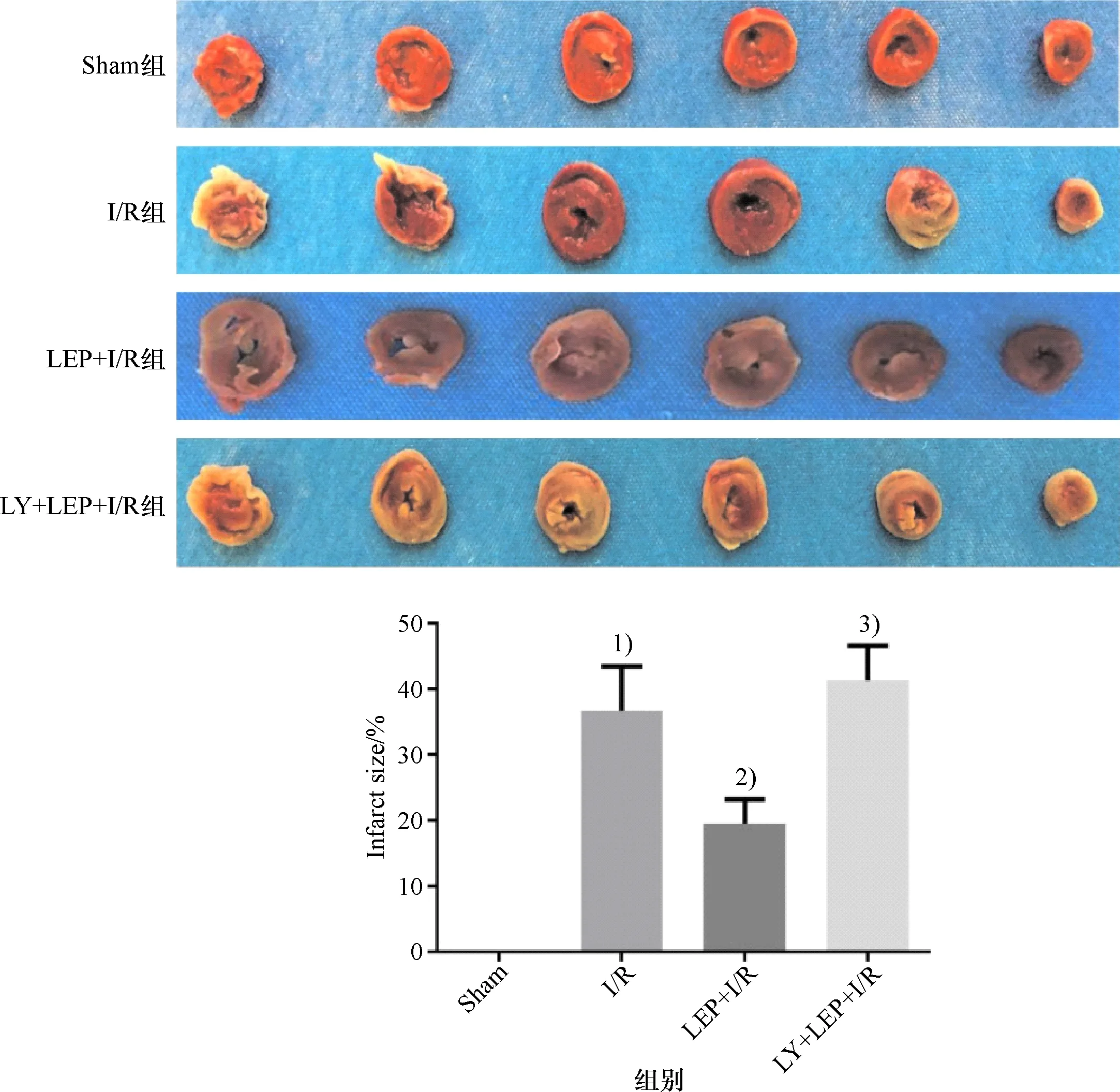
2.3 瘦素预处理减轻大鼠心肌组织病理损伤
如图3所示,与Sham组比较,I/R组大鼠心肌组织水肿、组织间隙增宽,同时伴有炎性细胞因子浸润.LEP预处理组能够减轻上述病理变化.LY294002可抵消LEP的保护作用.
1) 与Sham组比较,P<0.05; 2) 与I/R组比较,P<0.05; 3) 与LEP + I/R组比较,P<0.05.1) Compared with Sham group, P<0.05; 2) Compared with I/R group, P<0.05; 3) Compared with LEP+I/R group, P<0.05.
2.4 瘦素预处理抑制大鼠心肌细胞凋亡
(1)瘦素预处理对大鼠心肌细胞凋亡的影响:与Sham组比较,观察到I/R组大鼠心肌细胞凋亡程度显著升高.这种心肌细胞凋亡程度在LEP预处理组下降.与LEP+I/R组比较,LY+LEP+I/R组凋亡程度有所升高.
(2)瘦素预处理对大鼠心肌组织凋亡蛋白表达的影响:图5显示,与Sham组比较,I/R组凋亡蛋白Bcl-2和Bax比值表达显著降低.LEP预处理组可提高Bcl-2和Bax比值表达,LY294002能抵消此作用,这种表达趋势与TENUL检测结果相符合.
2.5 瘦素预处理激活PI3K/Akt信号通路
图6显示,与Sham组比较,I/R组PI3K和Akt磷酸化形式(p-Akt)蛋白表达降低.与I/R组比较,LEP+I/R组PI3K和p-Akt蛋白表达显著升高,提示LEP对PI3K/Akt信号通路具有显著影响.LY294002能阻断LEP的这种生物学作用.

1) 与Sham组比较,P<0.05; 2) 与I/R组比较,P<0.05; 3) 与LEP + I/R组比较,P<0.05.1) Compared with Sham group, P<0.05; 2) Compared with I/R group, P<0.05; 3) Compared with LEP + I/R group, P<0.05.
1) 与Sham组比较,P<0.05; 2) 与I/R组比较,P<0.05; 3) 与LEP + I/R组比较,P<0.05.1) Compared with Sham group, P<0.05; 2) Compared with I/R group, P<0.05; 3) Compared with LEP + I/R group, P<0.05.

1) 与Sham组比较,P<0.05; 2) 与I/R组比较,P<0.05; 3) 与LEP + I/R组比较,P<0.05.1) Compared with Sham group, P<0.05; 2) Compared with I/R group, P<0.05; 3) Compared with LEP + I/R group, P<0.05.
3 讨论
目前MIRI是心血管系统疾病的研究热点之一,进一步探讨其可能的潜在机制以及有效的防治策略具有一定的现实意义.MIRI的发病机制十分复杂,主要涉及钙超载、线粒体损伤、炎症反应、氧化应激和心肌细胞凋亡[15-16].心肌细胞凋亡是MIRI的主要病理特征,细胞凋亡的多少决定MIRI的程度,心肌缺血启动心肌细胞凋亡,再灌注使心肌细胞凋亡程度进一步加重,进而引起恶性心律失常、心力衰竭甚至心源性猝死.研究发现大约50%的MIRI都与心肌细胞凋亡有关,心肌细胞凋亡是MIRI发生的核心因素[17].因此抑制心肌细胞凋亡对减轻MIRI损伤意义重大[18-19].在生理和病理条件下,许多基因与细胞凋亡的调控有关,其中Bcl-2、Bax和Caspase-3是反映心肌细胞凋亡的经典指标.Bcl-2过度表达能够减少氧自由基的产生和脂质过氧化物的形成,干扰线粒体膜的通透性抑制Caspase的激活,从而发挥抗细胞凋亡的功能[20-22].Bax为促凋亡因子,其促凋亡作用与Caspase的释放有关[23].研究表明过表达Bcl-2可明显改善心功能,减少梗死面积和抑制心肌细胞凋亡[24],敲除Bax同样能够减少梗死面积并改善心功能[25].另外,Caspase-3不仅是凋亡程序的执行者,而且还能剪切心肌细胞的α-肌动蛋白和cTnT,进而引起心肌梗死面积的增加和心脏功能的障碍[26-27].PI3K/Akt信号通路是调控心肌细胞生存与死亡的信号通路之一,其通过抑制细胞凋亡来促进细胞存活,并参与多种器官的缺血/再灌注损伤,PI3K/Akt信号通路的激活能够减轻MIRI[28-30].研究发现对PI3K/Akt信号通路进行转录调控,能够调节抗凋亡蛋白Bcl-2的表达,进而减轻心肌细胞凋亡[31].另有研究证实PI3K/Akt信号通路同样通过抑制心肌细胞凋亡减轻MIRI的发生[32].
近年来研究表明,LEP作为脂肪细胞分泌的多肽类激素,对PI3K/Akt通路的激活具有显著的生物学作用,参与机体生理机能的调控[33].研究发现,PI3K信号通路在LEP调控的能量代谢中扮演重要作用[34].前期研究发现LEP预处理能够抑制炎症反应从而减轻小鼠MIRI[35],但具体作用机制尚不明确.本实验以构建大鼠MIRI为模型,通过LEP预处理抑制心肌细胞凋亡来研究其对心肌的保护作用,进一步探讨其保护作用是否与调控PI3K/Akt信号通路有关.
本实验观察到心肌细胞凋亡参与MIRI,模型组出现再灌注心律失常、心肌梗死面积的增加和心肌损伤,大鼠心肌细胞凋亡程度显著升高,这与ZHAI等[36]研究结果相一致.本实验经LEP预处理后,心肌梗死面积缩小,心肌组织病理损伤减轻,cTnT水平降低,Bcl-2/Bax比值表达升高,Cleaved Caspase-3的表达降低,心肌细胞凋亡程度减轻.此外还观察到LEP预处理能够显着增加PI3K、p-Akt蛋白表达水平,激活PI3K/Akt信号通路.本研究为进一步验证其发生的可能机制,在LEP预处理的基础上加入PI3K抑制剂LY294002,结果发现心肌梗死面积的增加,心肌损伤再次出现,心肌细胞凋亡再次升高,Bcl-2表达的水平明显的降低,Bax、Cleaved Caspase-3的表达明显升高,可见Bcl-2与Bax的比值明显降低,并且阻断PI3K下游靶点Akt的磷酸化.然而,LEP预处理如何调节Bcl-2或Bax的表达进而发挥抗凋亡的作用,这仍是值得深入探讨.从上述实验结果中推测:LEP预处理可以通过抑制心肌细胞凋亡来保护心肌细胞免受MIRI;LEP预处理的抗凋亡作用与Bcl-2/Bax比值的上调有关;LEP预处理对MIRI的抗凋亡作用可能是通过PI3K/Akt介导的途径来实现的.
综上所述,LEP预处理减轻MIRI以及发挥心肌保护作用,其机制可能与激活PI3K/Akt信号通路抑制心肌细胞凋亡有关.本研究结果为探索MIRI的分子机制提供了实验依据,为预防MIRI的发生与发展提供了新的策略.
作者贡献声明:
赵位昆:设计实验,采集数据,撰写论文;鲁攀:统计分析数据;吕祥威:提出研究思路和框架,修改论文.
利益冲突声明:
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突.
