初诊转移性鼻咽癌的治疗模式探讨
2021-09-02张思娜陈兢芝徐丹徐钢李先明陈善义
张思娜, 陈兢芝, 徐丹, 徐钢, 李先明, 陈善义*
(1. 暨南大学 第二临床医学院/深圳市人民医院 肿瘤放疗科, 广东 深圳 518020; 2. 香港大学 深圳医院 肿瘤放疗科, 广东 深圳 518000)
鼻咽癌(nasopharyngeal carcinoma, NPC)是起源于鼻咽上皮尤其最常好发于咽隐窝的一种头颈部恶性肿瘤,常见于我国南方地区[1],其发病机制与EB病毒(Epstein-Barr virus)感染有关.根据国际癌症研究机构报道,2020年全球统计新增鼻咽癌病例约13.3万例,死亡病例数达8.0万例[2].远处转移是鼻咽癌治疗失败的主要原因,也是鼻咽癌治疗的主要挑战.据报道约有4%的鼻咽癌患者初诊时已发生远处转移[3-4].初治转移性NPC较疗后继发转移NPC的预后更差、生存时间更短[5-7].《头颈部鳞癌综合治疗:中国专家共识2013版》中根据当时专家共识及随后各年度改进的指南或共识推荐初诊转移NPC患者以接受铂类为基础的化疗联合或不联合西妥昔单抗靶向治疗为主[8].但目前仍尚无针对初诊转移NPC的治疗指南.配合免疫治疗的临床研究正在积极地开展,尽管取得了较好的近期疗效,但能否提高远期疗效仍未明确[9-11].本研究对一组初诊转移NPC进行回顾性分析,以探讨适用于初诊转移NPC生存获益的治疗模式.
1 资料与方法
1.1 研究对象
选取2004年9月至2015年9月期间在深圳市人民医院肿瘤放疗科住院初诊符合美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第6版ⅣC 期的鼻咽癌患者,同时满足纳入及排除标准的患者共计56例.
1.2 纳入及排除标准
1.2.1 纳入标准
(1)鼻咽原发灶病理均为鼻咽非角化未分化鳞癌;(2)根据AJCC第6版(2002年出版)[12]初诊诊断为ⅣC期鼻咽癌;(3)转移病灶通过两种或以上影像学检查相互印证确诊(包括MRI、PET-CT、CT、ECT等)或经病理确诊证实转移;(4)至少接受一种抗肿瘤治疗.
1.2.2 排除标准
(1)未接受任何抗肿瘤治疗的患者;
(2)资料缺失的患者.
1.3 研究方法
1.3.1 分组方法
将纳入的56例患者根据治疗方案不同分为系统化疗组(A组)、系统化疗+同步放化疗组(B组)、系统化疗+同步放化疗+局部治疗组(C组).
A组:只接受全身系统化疗治疗,而未接受同步放化疗或转移灶局部治疗.该组化疗方案均为以铂类为基础的三联或二联化疗,共纳入15名患者.
B组:在全身系统化疗的基础上,接受鼻咽原发灶同步放化疗,共纳入17名患者.
C组:在全身系统化疗的基础上,接受鼻咽原发灶同步放化疗及转移灶局部治疗,共纳入24名患者.
1.3.2 治疗前评估
所有患者均有进行抗肿瘤治疗前血常规、肝肾功能等检测及一般情况评估,对转移灶部位及个数的检查包括全身PET-CT扫描(43.8%)、全身骨ECT扫描(35.4%),鼻咽+颈MRI,颈胸腰椎MRI、上腹部MRI及胸部CT、EB病毒DNA检测等.治疗结束后定期复查及相应对症支持治疗.
1.3.3 治疗方案
(1)系统化疗 所有系统化疗方案均为以铂类为基础的三联或二联化疗,化疗方案为:多西他赛(75 mg/m2i.v d1)联合顺铂(75 mg/m2i.v d1)联合或不联合替吉奥(60 mg bid d1~14),21 d为1个周期,计6周期.
(2)同步放化疗 鼻咽原发灶放疗技术早期为低熔点铅块二维放疗.2006年后则为调强放射治疗及容积旋转调强治疗.放疗靶区范围包括鼻咽原发灶、颈淋巴结转移灶、鼻咽周围结构及颈部预防区.给予肿瘤区(gross target volume, GTV)总剂量(dose of total, DT):68~70Gy/32~33次,5次/周;临床靶区-1(clinical target volume-1, CTV1)DT:60Gy/32~33次,5次/周;临床靶区-2(clinical target volume-2, CTV2)DT:54Gy/32~33次,5次/周.同步化疗方案主要为顺铂100 mg/m2d1 q3w或洛铂30 mg/m2d1 q3w.
(3)局部治疗 转移灶局部治疗的方法主要为局部放疗、射频消融、手术治疗等.其中18例骨转移灶行局部放疗DT:30 Gy~70 Gy/10~35f;2例肝脏转移灶在系统化疗间期行介入射频消融术;3例腋窝/上纵隔转移灶行局部放疗DT:45~70 Gy/25~35f,1例骨转移灶在系统化疗间期行椎体固定减压成形术.
1.4 统计学方法
研究的终点为生存时间,生存时间段为自诊断之日起至死亡发生或失联.所有数据均应用SPSS 13.0统计软件进行,Kaplan-Meier方法计算生存率,Pooled over strata方法进行3组合并比较,Pairwise over strata方法进行各组间比较,P<0.05为差异具有统计学意义.卡方检验进行性别、卡氏评分(karnofsky performance status, KPS)、T分期、N分期、转移灶个数的基线特征分布比较.One-Way ANOVA进行三组间平均年龄的比较.
2 结果
2.1 总体治疗效果统计
纳入分析的56例初诊转移性鼻咽癌患者,中位生存时间为21个月(范围2~187个月),2、3、5年生存率分别为44.6%、25.0%及10.7%,总生存曲线详见图1.所有患者以完成治疗后通过影像学资料进行疗效评估,完全缓解率(complete response, CR)、部分缓解率(partial response, PR)、疾病稳定率(stable disease, SD)、疾病进展率(progressive disease, PD)分别为19.1%、61.7%、6.4%、12.8%,客观反应率达80.8%.

图1 全组56例初诊转移性鼻咽癌患者的总生存曲线
2.2 3组患者基线数据比较
对3组患者的平均年龄、性别、KPS评分、T分期、N分期、转移灶个数等特征在基线时的分布较均衡,差异无统计学意义(表1).
2.3 3组生存率的比较
A、B、C组的中位生存时间分别为12个月、21个月、28个月,3组合并比较差异有统计学意义(P<0.001).A组的2年生存率为6.7%,3年及5年生存率未获得.B组的2年生存率(41.2%)高于A组(6.7%),组间差异有统计学意义(P=0.020).C组的2年生存率(66.7%)高于A组(6.7%),组间差异有统计学意义(P<0.001).C组的2、3、5年生存率(66.7%、45.8%、20.8%)均高于B组(41.2%、17.6%、5.9%),组间差异有统计学意义(P=0.025).3组生存曲线详见图2.
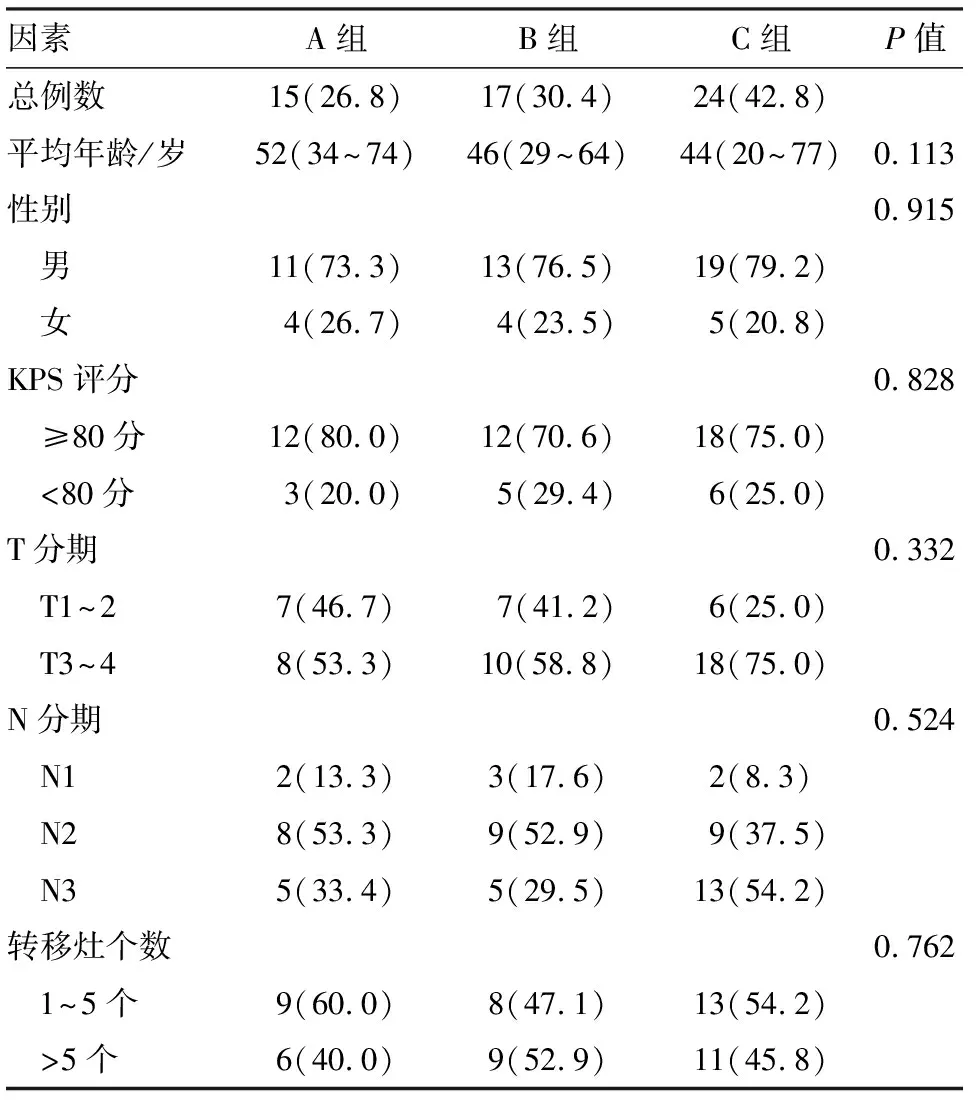
表1 3组患者在基线时的特征数据比较

3组生存时间之间比较,P<0.001.Compared the survival time among three groups,P<0.001.
3 讨论
本研究中初诊转移性鼻咽癌全部患者的中位生存时间为21个月,2、3、5年生存率分别为44.6%、25.0%及10.7%. 3组的平均年龄、性别、KPS评分、T分期、N分期、转移灶个数等基线数据的比较差异无统计学意义,基线特征分布较均衡.本研究针对初诊转移性鼻咽癌,单纯系统化疗组患者的2年生存率仅为6.7%,而在系统化疗的基础上加同步放化疗,2年生存率可提高34.5%,达41.2%,3年、5年生存率分别达17.6及5.9%.在系统化疗及同步放化疗的基础上,加转移灶局部治疗,对比未添加局部治疗者,其3年、5年生存率分别提高38.2%及14.9%,分别达45.8%及20.8%.本研究发现即使对于初诊已经发生转移的鼻咽癌患者,原发灶同步放化疗及转移灶局部治疗的应用仍能延长患者的生存时间,使患者生存获益.
转移性鼻咽癌一般预后较差,本研究主要目的为探讨不同的治疗方式对初诊转移性鼻咽癌患者预后的影响,寻求对患者有益的治疗模式,使初诊转移性鼻咽癌群体获得最大的生存获益.对于远处转移的鼻咽癌患者,传统的治疗主要以姑息性化疗为主[13],主要目标为改善生存质量,预后较差.近几年的研究提示对初诊寡转移性鼻咽癌,4~6周期的化疗、原发灶放化疗、局部转移灶治疗是预后积极因素[14-15].转移性疾病进行以多种抗肿瘤手段联合的综合治疗是大势所趋,尽管抗肿瘤治疗的目标是治愈癌症,但是由于肿瘤的异质性,为所有初诊远处转移的患者提供“达到根治”的治疗方法目前是不太可能的.是否所有隐藏在体内的肿瘤细胞都需全部消灭尚有待观察[16].本团队希望将远处转移患者经过积极治疗后转化为与瘤共存患者,期望体内的肿瘤负荷低到不足以影响生活质量,实现患者长期生存.因此多种抗肿瘤手段联合应用于初诊转移性鼻咽癌而有效延长生存时间的综合治疗模式的探讨势在必行.
一项针对非转移性局部晚期鼻咽癌的Meta分析中对19个试验及4806名非转移性鼻咽癌患者进行分析[17],提示放疗加化疗可提高鼻咽癌患者的总生存期,而这种获益仅限于接受同期放化疗的患者.放疗加化疗组的危险比为放疗不加化疗组的0.79,5年生存率提高6.3%.该研究还指出,化疗时机对治疗获益的作用显著,支持同期化疗伴辅助化疗或不伴辅助化疗,但不支持单独使用化疗或辅助化疗.非转移性局部晚期鼻咽癌患者进行同步放化疗已成为共识.2019版NCCN指南中建议转移性鼻咽癌患者进行同步放化疗或先行以铂类为基础的联合化疗后再行同期放化疗.在本研究针对初诊转移性鼻咽癌患者中,A组(单纯系统化疗)与B组(系统化疗+同步放化疗)的组间比较生存时间有统计学意义,在系统化疗的基础上,加同步放化疗比单纯系统化疗提高34%的2年生存率.
在缺乏有效的系统治疗的情况下,对于转移性疾病,无论是在消除所有转移灶方面,还是在肿瘤通过微转移快速传播的特征方面,局部治疗往往被认为是无效的.然而,在接受有效的系统治疗的部分患者中表现出无新转移灶生成,并在数月甚至数年内无疾病进展生存.其原因可能是因为系统治疗抑制了微转移灶的进展,甚至是根除了微转移灶,从而阻止了尚未发现的其他潜在转移灶的生成.因此,在获得有效的系统治疗后获得更长生成时间的前提下,使得局部治疗根除肉眼可见或影像学可见的转移灶成为可能[16].局部治疗的方式主要包括手术、射频消融及立体定向放射技术.一组有关射频消融联合化疗治疗鼻咽癌肝内寡转移灶的倾向评分匹配分析的研究报道[18],化疗联合射频消融组患者的5年生存率为29.5%,单纯化疗组的5年生存率为10.1%,联合治疗组的生存率明显高于单纯化疗组.该研究通过倾向评分匹配后,从不同治疗组中选取基线特征匹配良好的肝寡转移性鼻咽癌患者37对,其中化疗—消融联合治疗方案中的OS和PFS的调整危险比为0.53(95%CI为0.30~0.93)和0.60(95%CI为0.36~0.97),提示射频消融联合化疗方案为肝转移鼻咽癌患者提供改善生存的机会.在本研究中,在系统化疗基础上同步放化疗联合局部治疗的5年生存率为20.8%,同步化疗不联合局部治疗的5年生存率5.9%,同步放化疗联合局部治疗显著提高生存率.本研究患者总体5年生存率偏低,主要与患者初诊时转移病灶个数、转移器官个数较多相关.
如前所述,初诊转移性鼻咽癌患者单纯系统化疗显然不能使生存获益,本研究期望将多种有效的治疗方法综合应用形成一种治疗模式,通过不同的作用机制多方面抑制肿瘤进展.有效、足周期的化疗不仅可控制原发灶的进展,且可抑制微转移灶进展,甚至是根除远处微转移病灶,降低远处复发[16];对原发灶足剂量放疗加同期化疗,减少局部复发;在有效的系统治疗的前提下,对转移灶行局部治疗从而消灭肉眼或影像学可见的转移病灶.通过以上提及的多种治疗方式的结合,期望对转移性鼻咽癌患者能在原发灶、远处转移灶及微转移等方面得到有效控制甚根除部分病灶,即使治疗后仍有部分病灶或微转移灶无法完全消除,期望尽量减少其对生活质量的影响,形成“与瘤共存”的状态,尽可能延长生存时间.
近年来国内外针对鼻咽癌的靶向治疗和免疫治疗盛行,2017年,具有里程碑意义的KEYNOTE-028试验[9]首次报道,帕博利珠单抗(pembrolizumab)单药治疗在PD-L1阳性的复发或转移性鼻咽癌患者中显示出良好的抗肿瘤活性.免疫治疗联合放、化疗及局部治疗可否进一步使转移性鼻咽癌患者获益?免疫治疗在综合治疗中又因如何应用?这需要更多的研究数据支持.本研究的不足之处在于这是一个小样本的回顾性分析,由于样本量少,发生I类错误及II类错误的概率增加,本研究纳入的研究对象中转移的部位、局部治疗的具体手段不一,亦可能影响研究结果,且回顾性分析循证医学等级较低.因此,在未来需进行大样本的多中心、前瞻性研究以进一步验证研究结果的准确性.
综上所述,本研究结果显示,在系统化疗及同步放化疗的基础上,行转移灶局部治疗延长了初诊转移性鼻咽癌患者的生存时间,但尚需临床进一步观察研究.
作者贡献声明
张思娜:设计实验,统计分析数据,撰写论文;陈兢芝:收集数据;徐丹:收集数据;徐钢:修改论文;李先明:提出研究思路;陈善义:提出研究思路,修改论文.
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突.
