穿心莲内酯通过Notch信号通路抑制前列腺癌 骨转移细胞体外生物学行为的研究
2021-09-02钟少文王斌黄帅林卓远刘畅陈斌伟
钟少文, 王斌*, 黄帅, 林卓远, 刘畅, 陈斌伟
(广州医科大学 附属第二医院 1.骨科, 2.泌尿外科, 广东 广州 510260)
前列腺癌(prostatic cancer,PCa)是全球男性最常见的恶性肿瘤之一[1],也是导致癌症相关死亡的第5大原因[2],其特点是骨转移发生率高[3]. 骨转移患者的治疗是当前面临的一大挑战,越来越多的研究趋向于从传统中草药中寻找治疗骨转移的新疗法[4-5]. 穿心莲内酯(andrographolide,ANDRO)是天然植物草本穿心莲中提取的主要有效成分,目前已知具有抗氧化、抗炎、免疫调节、抗肿瘤、治疗心脑血管疾病等多种药理作用[6-7]. 既往研究表明ANDRO对前列腺癌[8-9]、结直肠癌[10]等多种肿瘤具有一定的抑制作用,但目前尚无关于ANDRO是否抑制前列腺癌骨转移病灶细胞体外迁移、侵袭及黏附能力及其作用机制的报道.本研究利用人源性的前列腺癌骨转移细胞株PC-3和C4-2B进行相关实验,研究 ANDRO对PC-3和C4-2B细胞体外增殖、细胞周期、迁移及侵袭等生物学行为的影响,并进一步探讨其作用机制可能通过抑制Notch信号通路及肿瘤转移相关蛋白基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达,为进一步研究及临床应用提供必要的理论依据.
1 材料与方法
1.1 材料
1.1.1 细胞株
人前列腺癌骨转移细胞株PC-3、C4-2B购自ATCC(美国典型培养物保藏中心,美国),并存放在液氮中保存.
1.1.2 主要试剂与仪器
ANDRO购自美国Sigma公司. 1640培养基、体积分数为0.25%胰蛋白酶-EDTA(1×)、胎牛血清、青霉素/链霉素购自Gibco 公司. Notch信号分子1(Notch signaling molecule 1, Notch-1)、胞内结构域(Notch intracellular domain, NICD)、hairy 相关转录因子1(hairy and enhancer of split-related with YRPW motif1, Hes-1)、基质金属蛋白酶MMP2、MMP9、ICAM-1、GAPDH(14C10)等抗体均购自CST公司(Cell Signaling Technology).
CO2恒温培养箱(型号:SERIES 8000 WJ)为美国Thermo 公司产品,酶标仪(型号:TY0608)和凝胶成像系统(型号:Geldoc XR+)为美国Bio-Rad 公司产品,流式细胞仪(型号:MuseTM)为德国Merck KGaA公司产品.
1.2 方法
1.2.1 细胞培养
常规细胞培养,将细胞接种在75 cm2培养瓶,培养于37 ℃、体积分数为 5%的CO2条件下的恒温箱中,使用的1640培养基中补充有体积分数为10%胎牛血清,以及含青霉素(100 U/mL)和链霉素(质量浓度为100 mg/mL)的双抗,取对数生长期细胞进行实验.
1.2.2 MTS检测细胞增殖
将PC-3和C4-2B细胞分别用体积分数为0.25%胰蛋白酶消化后,离心弃上清,加入培养基重悬细胞,以3×104/mL均匀接种于96孔培养板,每孔100 μL,细胞贴壁后加入浓度为0、2.5、5、10、20、40 μmol/L的ANDRO,每组设5个复孔,48 h后检测ANDRO作用于PC-3和C4-2B细胞的半抑制浓度(IC50). 然后,将细胞分为IC50药物浓度干预的ANDRO组和对照组,实验组中的药物以二甲基亚砜(dimethyl sulfoxide, DMSO)为溶剂,故对照组中亦加入同浓度的DMSO,分别培养0、1、2、3 d,通过每孔加入MTS试剂10 μL,恒温箱中孵育3 h,多功能酶标仪检测各孔的吸光度D(490 nm),以观察随着时间变化,ANDRO对细胞增殖的影响.
1.2.3 流式细胞仪检测细胞周期
将细胞分为含IC50药物浓度干预的ANDRO组和对照组,PC-3和C4-2B细胞分别按上述实验分组进行中培养48 h后,用预冷的PBS冲洗两遍,接着离心后去上清,加入-20 ℃预冷的体积分数为70%的乙醇溶液固定过夜,24 h后再次离心,弃上清,用预冷PBS冲洗两遍,去除乙醇的影响,离心,弃上清,加入500 μL RNase/PI染色重悬细胞,4 ℃避光孵育20 min,用流式细胞仪测定细胞周期分布情况.
1.2.4 Transwell检测细胞迁移
分别按上述分组将PC-3和C4-2B细胞处理48 h,然后用胰酶消化细胞,重悬,细胞数量调整为1×106/mL,于Transwell小室的上室接种200 μL细胞悬液,并向Transwell下室加入600 μL完全培养基,将Transwell板放于恒温箱中培养24 h.然后轻轻取出Transwell小室,用无菌棉签仔细擦净小室膜上细胞,膜下细胞用体积分数为0.1%的结晶紫染色,在光镜下随机计数5个高倍视野下的细胞数,计算平均值.
1.2.5 Transwell检测细胞侵袭
利用Matrigel 1∶8稀释液(质量浓度为50 mg/L),均匀铺于Transwell小室底部膜的上室面,4 ℃风干. 后续的步骤同1.2.4的细胞迁移实验.
1.2.6 纤维连接蛋白检测细胞黏附
用人纤维连接蛋白铺被于96孔板中2 h后,BSA孵育30 min封闭特异性结合位点.将上述分组处理48 h后,以胰蛋白酶消化重悬,调整细胞数至1×105/mL,将200 μL细胞悬液接种在96孔板中37℃培养箱中孵育30 min,PBS洗掉未贴壁细胞,体积分数为4%的多聚甲醛固定30 min,体积分数为0.1%的结晶紫染色,显微镜下观察拍照,并计数5个视野的细胞数,取平均值.
1.2.7 Western blot检测细胞相关蛋白表达
将PC-3和C4-2B细胞分别用胰蛋白酶消化重悬后,用完全培养基制成2×105/mL的细胞悬液,均匀接种于6孔培养板中,每孔2 mL,24 h细胞贴壁后,用不同药物浓度的ANDRO处理细胞. 培养48 h后,用预冷的PBS洗涤3次,然后用细胞刮将细胞刮下转移至15 mL离心管中,设定离心机参数4 000 r/min,离心10 min,弃上清,每管加入100 μL的蛋白酶抑制剂(VRIPA裂解液∶VPMSF=100∶1),转移至1 mL EP管中,于冰上裂解30 min,接着4 ℃离心机12 000 r/min离心10 min,吸取清液,用BCA试剂盒检测各组总蛋白质含量并使用loading buffer染色,将总蛋白稀释统一质量浓度,95 ℃ 10 min蛋白变性后分装保存于-20 ℃备用. 配置质量分数为10%的SDS-PAGE分离胶与浓缩胶,加入定量的样品至泳道(约50 μg). 80 V电泳至样品过分离胶后转120 V电泳,接着300 mA、90 min电转,转移至PVDF膜上. 体积分数为5%的BSA室温摇床封闭90 min,然后用TBST洗膜3次,10 min /次,再加入Notch-1、NICD、Hes-1、MMP2、MMP9、ICAM-1及GAPDH对应的一抗(V一抗∶V抗体稀释液=1∶1 500),于4℃孵育过夜,次日摇床1h后TBST洗涤3次,10 min/次,再分别加入对应的辣根过氧化物酶标记的二抗Anti-mouse IgG、Anti-rabbit IgG(V二抗∶V抗体稀释液=1∶2 000),继续摇床孵育1 h,用TBST洗涤3次,10 min/次,最后 ECL法显色曝光. 采用 Image J灰度分析软件分析条带灰度值,取目的条带灰度值与内参条带灰度值的比值为目的蛋白的相对表达量.
1.3 统计学方法
2 结果
2.1 不同浓度的ANDRO对细胞增殖的影响
将不同浓度的ANDRO处理 PC-3和C4-2B细胞48 h后,随着ANDRO浓度的升高,细胞增殖受到抑制的程度越来越显著,且呈剂量依赖性. 通过SPSS统计软件分析,细胞增殖率的IC50均约为15 μmol/L,且与0 μmol/L组比较,差异有统计学意义(P<0.01, 图1), 故选15 μmol/L的ANDRO进行后续实验.

A:不同浓度ANDRO对PC-3细胞增殖的影响.B:不同浓度ANDRO对C4-2B细胞增殖的影响.1)与0 μmol/L组比较,P<0.01.
2.2 ANDRO处理不同时间对细胞增殖的影响
将浓度为15 μmol/L的ANDRO处理 PC-3和C4-2B细胞,检测不同时间点(1、2、3 d)对细胞增殖的影响. 结果表明,相比对照组,随着ANDRO作用时间的延长,PC-3与C4-2B细胞增殖受到的抑制作用越明显,且给药2 d、3 d后的抑制作用差异均有统计学意义(P<0.01,图2).
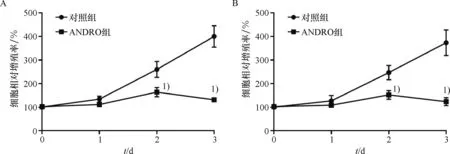
A: ANDRO不同时间处理对PC-3细胞增殖的影响. B:ANDRO不同时间处理对C4-2B细胞增殖的影响. 1)与对照组比较,P<0.01.
2.3 ANDRO对细胞周期分布的影响
流式细胞仪结果显示,ANDRO处理48 h后 PC-3与C4-2B细胞处于G1期比例较对照组增高,S期比例相应下降,差异有统计学意义(P<0.05, 表1).
2.4 ANDRO对细胞迁移能力的影响
Transwell迁移实验结果显示,15 μmol/L的ANDRO处理48 h后,PC-3和C4-2B细胞迁移能力受到抑制,其迁移率较对照组均明显减少,差异有统计学意义(P<0.01, 图3).
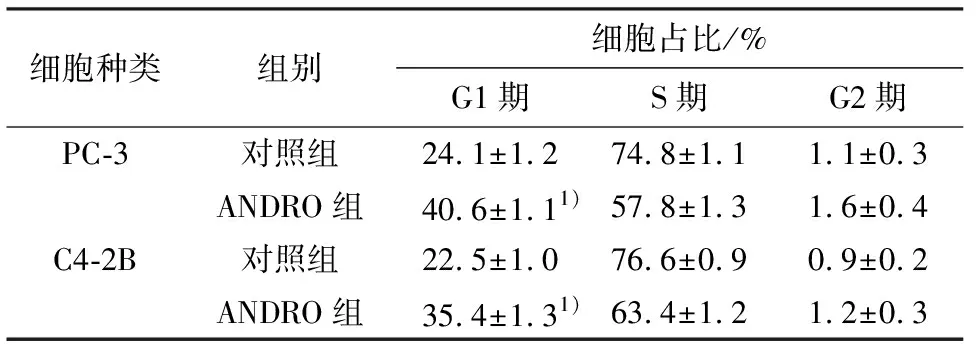
表1 ANDRO干预后PC- 3和C4-2B细胞周期分布
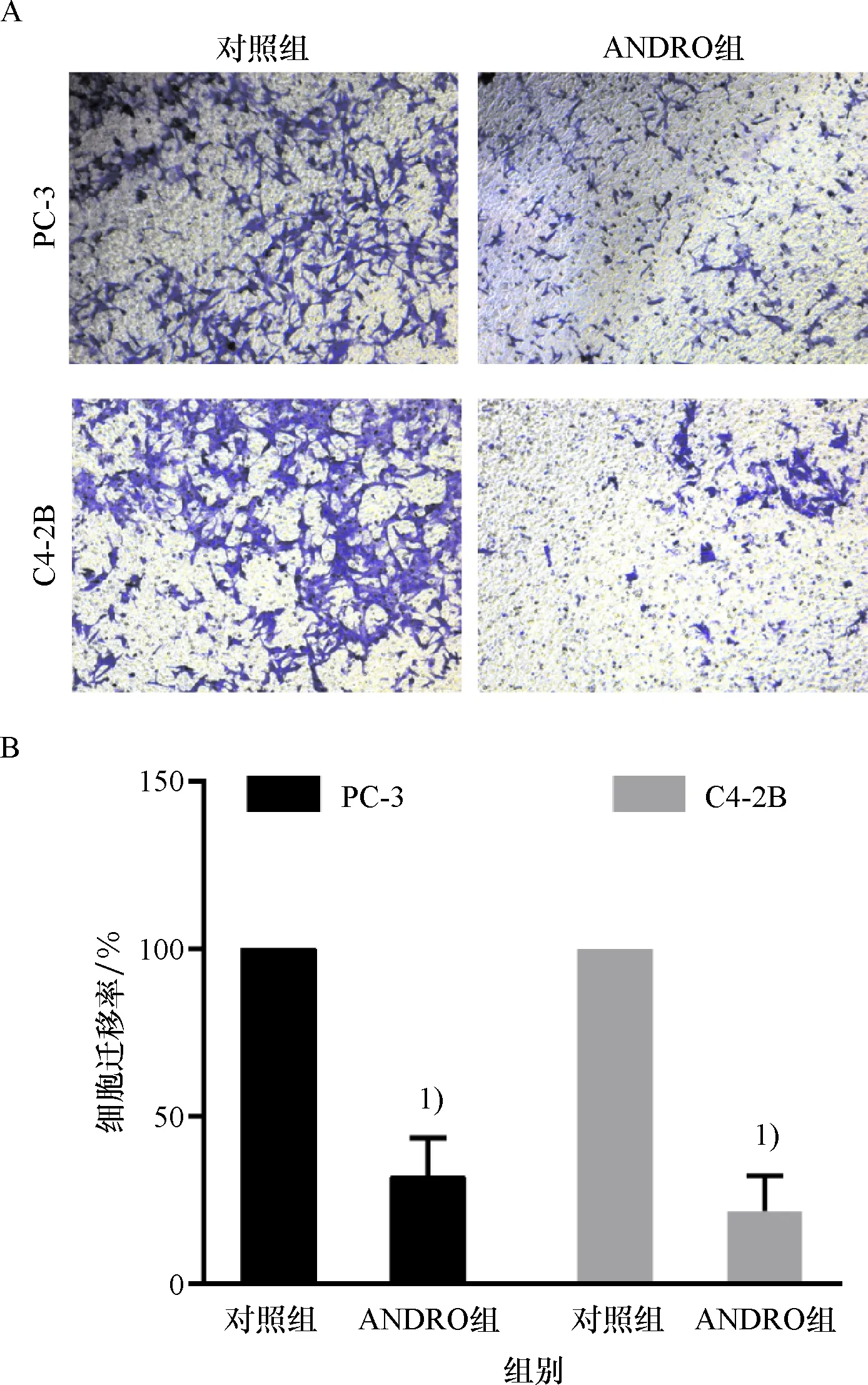
A:ANDRO对PC-3和C4-2B细胞迁移的影响;B:ANDRO作用下PC-3和C4-2B细胞迁移率与对照组对比结果.1)与对照组比较,P<0.01.
2.5 ANDRO对细胞侵袭能力的影响
Transwell侵袭实验结果显示,15 μmol/L 的ANDRO处理PC-3和C4-2B细胞48 h后,细胞的侵袭能力均明显受到抑制,其侵袭率较对照组显著减少,差异有统计学意义(P<0.01,图4).

A:ANDRO对PC-3和C4-2B细胞侵袭的影响;B:ANDRO作用下,PC-3和C4-2B细胞侵袭率与对照组对比的结果.1)与对照组比较,P<0.01.
2.6 ANDRO对细胞黏附能力的影响
与对照组相比,ANDRO处理PC-3和C4-2B细胞后,其与细胞外基质之间的黏附能力均明显下降,差异有统计学意义(P<0.01,图5).
2.7 ANDRO对Notch信号通路蛋白及肿瘤转移相关蛋白表达的影响
ANDRO处理PC-3和C4-2B细胞48 h后,相比对照组,ANDRO能显著抑制PC-3和C4-2B细胞Notch信号通路中Notch-1、 Hes-1和NICD的表达,同时也降低肿瘤转移相关蛋白MMP2、MMP9和ICAM-1蛋白的表达(P<0.01,图6),结果表明,ANDRO可以抑制Notch信号通路活性及抑制肿瘤转移相关蛋白表达.

A:ANDRO对PC-3和C4-2B细胞黏附的影响;B:ANDRO作用下,PC-3和C4-2B细胞黏附数与对照组对比的结果.1)与对照组(0 μmol/L)相比较,P<0.01.
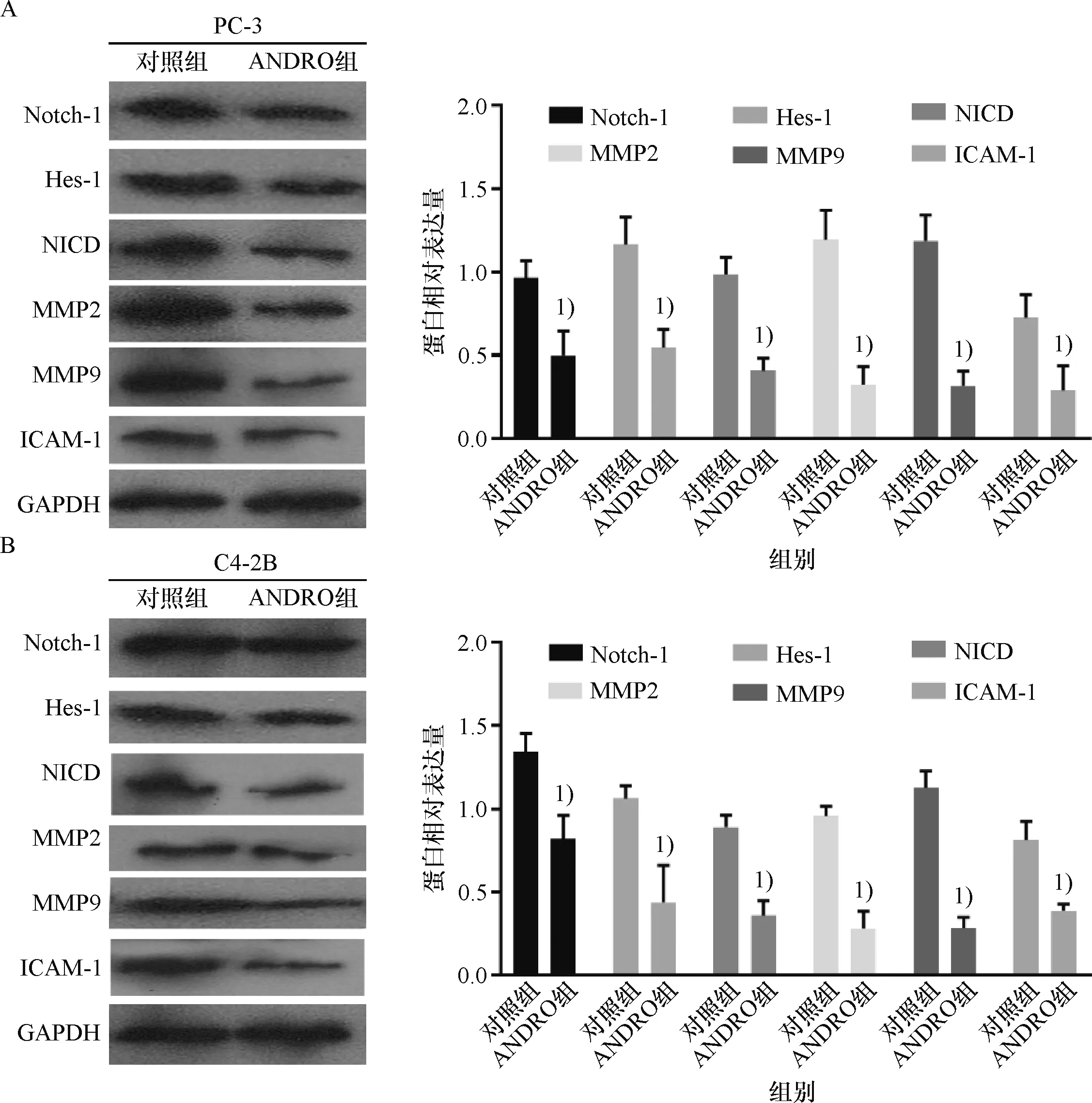
A:ANDRO作用下PC-3细胞相关蛋白的表达;B:ANDRO作用下C4-2B细胞相关蛋白的表达.1)与对照组比较,P<0.01.
3 讨论
随着人均寿命的延长及饮食结构的改变,目前我国前列腺癌的病发率也呈上升趋势[11-12]. 前列腺癌患者早期可能没有较为显著的临床症状,多于体检时直肠指检发现结节或抽血检测血清前列腺特异抗原(prostate-specific antigen,PSA)升高时发现,首诊时可有转移性骨痛,而无下尿路梗阻症状,导致确诊患者多伴有远处转移. 前列腺癌患者的死亡往往不是原发病灶,而是由于肿瘤的远处转移,特别是骨转移[13]. 目前临床上治疗前列腺癌一般选择雄激素去除治疗为主的姑息治疗,但其对晚期骨转移未能起到很好疗效,骨转移的患者预后差,平均生存时间仅为5~17.5个月[14]. 因此,前列腺癌骨转移的患者迫切需要更佳的治疗方法.
近年来,越来越多的研究主要倾向用靶向药物对前列腺癌进行治疗及预防.ANDRO作为传统中草药穿心莲中提取的有效成分,其在免疫调节、抗肿瘤等方面具有重要的意义.既往研究表明,ANDRO可以抑制小鼠免疫细胞的体外活化和增殖,抑制细胞周期而发挥免疫调节的作用[15]. 在抗肿瘤方面,ANDRO也被报道其可以抑制前列腺癌的体外增殖,郭明伟等[16]证明ANDRO可以抑制前列腺癌PC-3细胞增殖、促进其凋亡,并探讨了其可能通过调节凋亡基因Bcl-2及Bax而发挥作用;周大磊等[17]发现ANDRO可以抑制前列腺癌细胞增殖、神经内分泌分化. 但目前尚无关于ANDRO抑制前列腺骨转移病灶细胞的体外迁移、侵袭、细胞黏附能力的研究,以及其作用机制是否涉及Notch信号通路的报道. PC-3和C4-2B细胞系作为目前研究前列腺癌骨转移最常用的细胞系,因其具有一套完整的发展模型,已被广泛应用于研究前列腺癌转移的分子机制、药物筛选评价和基因治疗等[18]. 本研究通过ANDRO作用于前列腺癌骨转移细胞株PC-3和C4-2B,探讨ANDRO对前列腺癌骨转移的体外抑制作用及其可能存在的作用机制.
以往研究表明,Notch信号通路对细胞的增殖、凋亡、分化、黏附等方面具备调控作用,但在不同细胞或组织,Notch信号通路发挥的调控作用有所不同[19-20]. Notch信号通路也是当前国内外研究肿瘤领域的热点之一,如Akbarzadeh等[21]研究表明DAPT分子可以通过靶向Notch信号通路在卵巢癌中发挥抗转移作用;Wu等[22]研究发现谷氨酸脱氢酶可通过Notch信号传导途径抑制胃癌中的肿瘤生长. 在Notch信号通路中,Notch1为通路的核心蛋白,当Notch信号通路被激活后,Notch1会被γ分泌酶复合体切割,裂解并释放Notch活性结构域NICD,NICD进入细胞核与DNA结合蛋白CSL(CBFl/Suppresor of Hairless/Lag1)及MAML(mastermind-like)结合成三聚体,以启动下游基因表达,Hes-1是Notch信号通路下游重要的靶基因[23-24]. 进而本课题组推测,ANDRO在抑制前列腺癌骨转移体外生物学行为可能通过涉及Notch信号通路的表达.
本研究首先验证了ANDRO可以抑制前列腺癌骨转移细胞株PC-3和C4-2B的增殖,其药物IC50均约为15 μmol/L,且表现出浓度和时间依赖的特性,随着浓度和时间的延长,ANDRO对PC-3和C4-2B细胞增殖的抑制作用越明显. 在此基础上,进一步经过细胞迁移、侵袭、黏附等实验方法,利用IC50药物浓度的ANDRO作用于PC-3和C4-2B细胞,结果表明,ANDRO对PC-3和C4-2B细胞的迁移、侵袭、细胞黏附能力相比对照组均有较明显抑制作用.流式检测细胞周期结果显示,ANDRO处理48h后 PC-3与C4-2B细胞处于G1期比例较对照组增高,S期比例相应下降,实验表明ANDRO可调控细胞周期的分布.此外,Notch信号通路相关因子Notch-1、 Hes-1和NICD的蛋白表达明显下调,ANDRO可能抑制前列腺癌骨转移细胞中Notch信号通路关键蛋白和下游基因的表达,通过降低Notch信号活性,进而抑制PC-3和C4-2B细胞的体外增殖和调控细胞周期分布.
此外,本研究检测了ANDRO对肿瘤转移相关蛋白MMP2、MMP9和ICAM-1表达的影响. 研究表明,Notch 信号通路活性下降的会下调基质金属蛋白酶MMPs,共同抑制肿瘤的体外转移[25-26]. MMPs是一类锌依赖性内源性蛋白酶,在组织重塑和细胞外基质各种蛋白质的降解中具有多种作用. 目前已知MMPs可促进细胞增殖、迁移和分化,并在细胞凋亡、血管生成、组织修复和免疫应答中发挥作用,同时影响细胞表面的生物活性分子并调节着各种细胞和信号传导途径[27-28]. MMP-2及MMP-9是MMPs家族成员之一,MMP-2可以水解细胞外基质相关成分从而使肿瘤细胞对周围组织具有更强的侵袭能力[29],MMP-9可以降解细胞外基质并在肿瘤细胞的侵袭转移过程中发挥重要作用[30]. 此外,ICAM-1是黏附分子中免疫球蛋白超家族(immunoglobulins superfamily,IGSF)中的一员,在细胞间黏附反应中扮演重要角色[31]. 本研究发现经过ANDRO处理后,PC-3和C4-2B细胞的迁移、侵袭以及细胞与外基质的黏附能力均明显下降,且western blot结果显示,MMP-2、MMP-9、ICAM-1的蛋白表达水平较对照组下调. 进而推测,ANDRO可能通过抑制Notch信号通路及肿瘤转移相关蛋白表达,影响前列腺癌骨转移细胞株的体外增殖、迁移、侵袭和细胞黏附能力.
综上所述,ANDRO可以抑制前列腺癌骨转移细胞株的体外增殖、迁移、侵袭和细胞黏附能力,并影响其细胞周期分布,其作用机制可能与ANDRO抑制Notch信号通路蛋白及肿瘤转移相关蛋白表达有关. 这将为临床治疗前列腺癌骨转移患者提供理论依据和新的希望,但ANDRO抑制前列腺癌骨转移可能涉及多条信号通路,其具体的作用机制和临床应用仍需更深入地研究探讨.
作者贡献声明
钟少文:设计并开展实验、统计分析数据,撰写论文;王斌:提出研究思路和框架,修改论文;黄帅:提出研究思路和指导实验方法,修改论文;林卓远:指导实验方法,指导撰写论文;刘畅:收集整理数据;陈斌伟:统计分析数据.
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突.
