1例前庭水管扩大患儿SLC26A4基因的新变异研究
2021-09-01胡澜也陈洁辛渊方旭华焦宇
胡澜也 陈洁 辛渊 方旭华 焦宇
上海交通大学医学院附属上海儿童医学中心耳鼻咽喉口腔颌面外科(上海200127)
耳聋可由遗传因素或环境因素导致,至少一半的耳聋可归因于遗传因素,其中同时具备其他特殊临床特征的称为综合征性耳聋(syndromic hearing loss,SHL),不具备其他临床特征的称为非综合征性耳聋(nonsyndromic hearing loss,NSHL)[1,2]。前庭水管扩大(enlarged vestibular aqueduct,EVA)是导致NSHL的常见内耳畸形,典型特征为进展性感音神经性听力下降[3],诊断主要依靠颞骨CT及MRI影像学检查[4]。1996年Griffith等[5]首次描述前庭水管扩大有家族遗传性,随后证实其与溶质转运家族26-成 员 4(solute carrier family 26 member 4,SLC26A4)基因变异相关[6]。迄今为止,在不同国家和种族中已发现超过500种SLC26A4基因变异(http://www.hgmd.cf.ac.uk/ac/gene.php?gene=SLC26A4)。本研究中,我们对1例EVA听障患儿及其父母进行全外显子测序,发现了1种SLC26A4基因的新变异,现报道如下。
1 资料与方法
1.1 临床资料
先证者为一名2岁女孩。患儿及其父母均来自中国河南省,为汉族人。患儿出生听力筛查未做,自幼对声反应差,言语发育迟缓。出生时无窒息等异常,既往无脑膜炎、耳外伤、耳毒性药物应用史,无耳聋家族史。来我院行人工耳蜗植入手术,术前进行体格检查、听力学检查和影像学检查。
本研究通过本院伦理委员会论证批准,并由法定监护人签署书面知情同意书。
1.2 方法
1.2.1 听力学检查与影像学检查
患儿术前进行的听力学检查包括耳镜检查、畸变产物耳声发射(distortion product otoacoustic emission,DPOAE)、声导抗、听觉脑干诱发电位(auditory brainstem response,ABR)和多频稳态诱发电位(auditory steady-state response,ASSR)。影像学检查包括颞骨CT和内耳MRI。根据世界卫生组织倡导的耳聋分级标准,听力损失程度分为:轻度(26~ 40dB HL)、中度(41~ 60dB HL)、重度(61~ 80dB HL)和极重度(>80dB HL)。由于受试者年龄较小,无法配合纯音听阈测试,取ASSR 0.5-4kHz范围内的平均阈值作为定向条件反射的近似值[7]。
1.2.2 基因测序与变异验证
分别采集患儿及其父母的外周血3~ 5ml,枸橼酸钠抗凝,应用Gentra Puregene血液试剂盒(Qiagen,德国)提取基因组DNA,具体步骤参照试剂盒说明书。利用试剂盒SureSelectXT Library Prep Kit(Ag‐ilent Technologies,美国)捕获外显子,在测序平台Illumina Hiseq X Ten System(Illumina,美国)上进行高通量测序。测序数据经软件NextGENe®(Soft‐Genetics,美国)匹配分析后,上传至在线软件系统Ingenuity Variant Analysis(Ingenuity Systems,美国)进行变异过筛及解释,候选变异经北京六合华大基因科技有限公司上海分公司进行Sanger测序验证。
1.2.3 生物信息学分析
应 用 PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)、PROVEAN(http://provean.jcvi.org/ge‐nome_submit_2.php?species?human)、SIFT(http://sift.Jcvi.org/)和 MutationTaster(http://www.muta‐tiontaster.org/ChrPos.html)预测SLC26A4基因变异的潜在致病性。
2 结果
2.1 临床检查结果
术前常规全身体格检查及专科检查未见明显异常。DPOAE示双耳未引出;声导抗示双耳A型;气导ABR示左耳反应阈90dB nHL,右耳反应阈100dB nHL;骨导ABR示双耳反应阈大于40dB nHL;ASSR示双耳极重度感音神经性聋。颞骨CT示双侧前庭水管扩大;内耳MRI可见T2WI序列双侧小脑半球表面扩大的内淋巴囊和前庭水管(图1)。
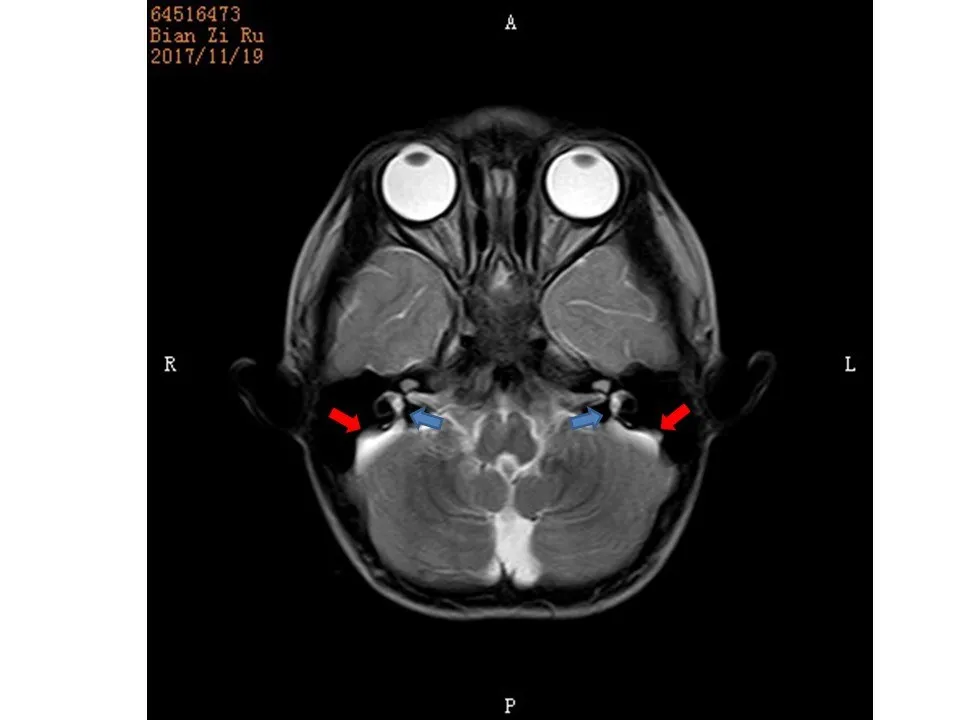
图1 内听道MRI可见前庭水管扩大(蓝色箭头所指处)和内淋巴囊扩大(红色箭头所指处)Fig.1 The inner ear MR scan images show the enlarged ves‐tibular aqueduct(blue arrows)and the enlarged endolymph sac(red arrows)
2.2 基因检测及生物信息学分析结果
先证者存在SLC26A4c.919-2A>G(c.IVS7-2A>G)和c.403C>A(p.His135Asn)的变异(图2)。父亲为c.919-2A>G的杂合变异携带者,母亲为c.403C>A的杂合变异携带者(图3)。

图2 先证者及其父母基因测序图中的异常序列。先证者在SLC26A4基因中呈c.403C>A/c.919-2A>G变异,其中c.403C>A来源于母亲,c.919-2A>G来源于父亲Fig.2 Sequence electropherograms of abnormal sequences from three members of this family.The proband harbored two variants in the SLC26A4 gene in the form of c.403C>A/c.919-2A>G.The proband’s father was a heterozygous carrier of the c.919-2A>G variant,and her mother was a heterozygous carrier of the c.403C>A.

图3 前庭水管扩大患儿家系图。正方形和圆形分别代表男性和女性。Fig.3 Pedigree map of the family with EVA.Squares and cir‐cles denote males and females,respectively
c.403C>A(p.His135Asn)位于SLC26A4基因的第4外显子,导致第135位的组氨酸转变为天冬酰胺。该变异在人类基因突变数据库(http://www.hgmd.cf.ac.uk)中未曾收录,在gnomAD(http://gno‐mad.broadinstitute.org)、ExAC(http://exac.broadin‐stitute.org)、ESP(http://evs.gs.washington.edu/EVS)和千人基因组计划(http://www.1000genomes.org)等对照数据库中亦未见报道。因此,患儿及其母亲所携带的c.403C>A是SLC26A4基因新发现的变异。通过PROVEAN、PolyPhen-2、SIFT和MutationTaster等多种软件预测,该变异可能会影响蛋白结构域的功能,具有潜在致病性(表1)。按照美国医学遗传学与基因组学学会(the American College of Medical Genetics and Genomics.ACMG)变异分类标准[8],归类为“可能致病性(likely pathogenic)”变异。

表1 c.403C>A(p.His135Asn)变异的生物信息学分析结果Table 1 In silico analysis of the c.403C>A variant
3 讨论
SLC26A4基因,也称作PDS基因(pendred’s syndrome gene,PDS),位于染色体7q22-31.1,包含21个外显子[9]。其编码的Pendrin蛋白是一种含有780个氨基酸的高疏水性膜蛋白,具有12个跨膜结构域[9,10],主要表达于内耳、甲状腺和肾脏,在液体运输、阴离子运输和维持耳蜗内电位中起着重要作用[11-13]。SLC26A4基因变异与EVA有关,扩大的前庭水管使脑脊液压力传递至内耳,进而导致耳聋的发生。EVA患者没有特定的听力水平,听力从正常到极重度聋均有可能。耳聋可以是先天性的,或者发生在出生后1-2年。听力下降模式可呈现为缓慢进展、突然加重或者波动性,但通常呈进展性。由于EVA的第三窗效应,低频听力存在气骨导差。EVA患者最初可能具备接近正常的听力,这种情况下可暂不处理。随着波动性和进展性听力下降,患者需要佩戴助听器。听力下降通常会持续进展下去,最终需要进行人工耳蜗植入[3]。
SLC26A4基因的热点变异体现出地区和种族差异。白种人中主要检测到的变异为p.L236P(c.707T>C)、p.T416P(c.1246A>C)和 IVS8+1G>A(c.1001+1G>A)[14],南美和北美分别以 p.V609G(c.1826T>G)和 IVS8+1G>A(c.1001+1G>A)为主[15],捷克人群中最常见的变异为p.V138F(c.412G>T)[16],韩国人群中主要为 p.H723R(c.2168A>G)[17],中国人群中主要为IVS7-2A>G(c.919-2A>G)和p.H723R(c.2168A>G)[18]。本研究中我们对1例非综合征性耳聋的患儿及其听力正常的父母进行了全外显子测序。先证者在SLC26A4基因中存在 c.919-2A>G(c.IVS7-2A>G)和 c.403C>A(p.His135Asn)两个变异,其中c.919-2A>G来源于父亲,c.403C>A来源于母亲。既往研究表明,c.919-2A>G属于剪接位点变异,位于第7内含子,是中国人群中SLC26A4基因最常见的致病变异[18]。本研究新发现的c.403C>A属于错义变异,位于第4外显子,根据前文生物信息学分析结果,该变异使第135位的组氨酸转变为天冬酰胺,可能会影响Pendrin蛋白结构域的功能,按照ACMG变异分类标准,归类为“可能致病性”变异。本文家系为携带者婚配,遗传方式为常染色体隐性遗传,若该家庭有再次生育意愿,孕期应进行产前诊断,以避免再次生育耳聋后代。
本研究发现了1种SLC26A4基因的新变异,扩展了中国人群中SLC26A4基因变异谱,有助于为患有EVA的耳聋患者的遗传咨询提供更多信息。
