幕上实质型血管母细胞瘤的影像特征与预后的关系
2021-08-25唐业欢蒋牧良秦宇红李向荣毛一朴龙莉玲
唐业欢,蒋牧良*,秦宇红,李向荣,毛一朴,龙莉玲
1.广西医科大学第一附属医院放射科,广西 南宁 530021;2.广西南宁市第一人民医院放射科,广西 南宁 530022;*通信作者 蒋牧良 jmlgxmu@gmail.com
血管母细胞瘤(hemangioblastoma,HB)来源于血管内皮细胞,是一种高度血管分化的良性肿瘤,占颅内肿瘤的1.1%~2.4%[1]。典型的HB 好发于小脑半球,以大囊小结节型多见,术前多能准确诊断;而发生于幕上且为实质型的HB 非常罕见。国内外关于幕上HB 大多为个案报道或文献复习,缺乏系统性的影像学分析[2-4]。此外,临床上幕上实质型血管母细胞瘤(supratentorial solid hemangioblastoma,S-SHB)术中易发生大出血,致残、致伤率高,故术前准确诊断尤其重要[5]。本研究拟分析S-SHB 患者的影像及病理特征,探讨其与预后的关系,为提高本病的诊断准确率,及对患者个体化治疗的制订与预后评估提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2009年1月—2019年6月广西医科大学第一附属医院及广西壮族自治区人民医院经手术病理证实为幕上S-SHB 11 例。纳入标准:①具有CT 或MRI 影像及临床资料;②均接受外科手术切除,具有大体病理标本切片结果且经免疫组化确诊。排除标准:①影像学表现为大囊小结节型或单纯囊型的HB;②肿瘤位于幕下;③图像质量无法满足分析需要。11 例患者中,男5 例、女6 例,年龄30~67 岁,平均(45.0±13.5)岁,均为首次发病,无希佩尔-林道综合征(Von Hippel-Lindau,VHL)家族史,均为散发型HB。临床表现:反复头痛、头晕6 例,伴肢体抽搐3 例,精神异常1 例,无症状1 例。2 例行CT 平扫,5 例行MRI 平扫及增强扫描,4 例行CT 及MRI 联合检查。本研究通过医院伦理委员会批准[2020(KY-E-105)]。11 例肿瘤中:术前误诊为脑膜瘤7 例、血管周细胞瘤3 例、胶质瘤1 例。
1.2 影像学检查
1.2.1 CT 检查 采用Siemens Somatom Sensation 64层螺旋CT 扫描仪。常规颅脑轴面扫描,扫描范围自听眦线至颅顶部,层厚5 mm,层间距5 mm,管电压120 kV,管电流380 mA。
1.2.2 MRI 检查 7 例采用Philips Archiva 3.0T、2 例采用Siemens Verio3.0T 超导MR 扫描仪,标准头颅线圈,常规扫描轴位T1WI(TR 2 000 ms,TE 20 ms)、T2WI(TR 2 600 ms,TE 80 ms)及液体衰减反转恢复(FLAIR)序列(TR 6 000 ms,TE 120 ms),视野512 mm×512 mm,层厚5 mm;增强扫描采用对比剂Gd-DTPA,剂量0.1 mmol/kg,经肘静脉团注,速度3 ml/s,行轴位、冠状位及矢状位T1WI 扫描。
1.3 观察指标与方法 分别由1 名放射科主治医师和1 名副主任医师采用盲法阅片,意见有分歧时,经协商达成一致。观察11 例S-SHB 的影像学表现,包括肿瘤部位、大小、信号/密度、边界、瘤周水肿、瘤内血管流空征、强化方式、病变与硬脑膜的关系等,以及手术方式、病理表现(大体及镜下病理)及免疫组化[血管内皮细胞CD34、间质细胞Vim、Ki-67、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、S-100 蛋白(S-100)、细胞角蛋白(cytokeratin,CK)]。肿瘤最大径取2 位医师测量的平均值。
其中瘤周水肿标准按水肿指数(edema index,EI)=(VTumor+Edema)/(VTumor)进行评价,即EI=1为无水肿,EI=1~1.5 为轻度水肿,1.5~3 为中度水肿,>3.0 为重度水肿[6]。
1.4 预后随访 对符合条件的入选患者进行术后随访,随访时间截止至2019年11月。患者复查均行CT 或MRI 检查,以肿瘤复发作为随访终点。无复发生存期(recurrence free survival,RFS)为手术当日至肿瘤复发或末次随访时间段。
1.5 统计学方法 采用SPSS 20.0 软件进行分析。计数资料以例(%)表示,计量资料以±s表示。生存分析中单因素分析采用Kaplan-Meier 法,进行Log-rank检验,筛选预后因素。P<0.05 表示差异有统计学意义。
2 结果
2.1 影像学表现
2.1.1 CT 表现 5 例患者行CT 检查,均为单发实性肿块,形态呈圆形或分叶状,边界清晰,最大径1.6~4.9 cm,平均(3.3±1.2)cm;3 例呈等密度,2 例呈稍高密度。肿块CT 值28.0~53.4 Hu,平均(36.8±9.7)Hu。病变位置表浅,4 例位于额顶叶大脑镰旁,1 例位于大脑凸面,与硬脑膜关系密切。
2.1.2 MRI 表现 9 例患者行MRI 检查,其中7 例为实性肿块,2 例伴少许囊变,边界清晰,形态呈圆形或分叶状;与周围脑实质信号相比,9 例T1WI 均呈稍低信号,T2WI/FLAIR 均呈稍高信号,瘤内或瘤周均可见漩涡状或蚯蚓状血管流空影,常规MRI 增强扫描7 例呈显著均匀强化(即强化程度近似血管强化),2 例中度不均匀强化,增强扫描均未见脑膜尾征。11 例病灶均可见瘤周水肿,其中7 例重度水肿,3 例中度水肿,1 例轻度水肿。位置表浅,5 例位于额顶叶大脑镰旁,4 例位于大脑凸面,与硬脑膜关系密切,最大径2.8~4.6 cm,平均(3.4±0.6)cm,见表1、图1。

表1 11例S-SHB患者的临床资料及影像学特征(例)
2.2 病理学特征 大体病理示肿瘤组织表面粗糙,切面呈暗红色,质地中等。光镜显示肿瘤组织主要由大量致密的毛细血管网以及呈巢状排列的间质细胞组成,伴细胞活跃增生。免疫组织化学显示血管内皮细胞CD34(7 例)、间质细胞Vim(9 例)呈阳性表达,可见较多小-中等血管增生,Ki-67 1%~3%,GFAP、CK、S-100 均不表达,见图1。

图1 男,30岁,S-SHB。A、B.横断位T2WI及FLAIR示边界清楚的高信号肿块(星号)伴瘤周重度水肿带(箭头),病灶位于左侧额叶大脑镰旁,瘤内见多发漩涡状细小流空血管影(箭);C.横断位T1WI示肿瘤呈均匀低信号(箭);D~F.增强横断位T1WI肿瘤呈均匀显著性强化,边缘呈浅分叶状,与邻近硬脑膜关系密切,但无脑膜尾征(箭);G.光镜下观察示肿瘤组织主要由大量致密的毛细血管网、以及血管网之间呈巢状排列的间质细胞组成,细胞活跃增生(HE,×100);H.免疫组化示血管内皮细胞CD34、间质细胞Vim呈阳性表达(Envision法,×200)
2.3 生存分析 本组患者随访时间1~10年,2 例出现肿瘤复发,平均RFS 为5年。对影像、病理相关数据进行单因素分析,Log-rank 检验结果显示肿瘤部位、瘤周水肿、流空血管、免疫组化指标(CD34、Vim、Ki-67)对患者的RFS 无预测意义(P>0.05)。不同影响因素作用下的生存曲线见图2、3。

图2 各影像因素下的相关生存曲线。单因素分析结果显示肿瘤部位(A)、瘤周水肿(B)、流空血管(C)与预后无关,对患者的RFS无预测意义
3 讨论
3.1 S-SHB的特点及影像表现、病理特征分析 HB是来自中胚层的血管内皮细胞在原始血管形成过程中发育障碍,残余胚胎细胞形成的良性肿瘤。在WHO(2016年)中枢神经系统肿瘤分类中,将其归为间质、非脑膜上皮性肿瘤(WHO Ⅰ级)[1]。HB可发生于中枢神经系统任何部位,以后颅窝多见,好发于小脑半球,幕上非常罕见[2-4]。HB影像学分为大囊小结节型(70%~90%)、实质型(10%)、单纯囊型(10%)[7]。S-SHB在大体病理上呈红色实性结节,光镜下结节由充满血液的毛细血管网和血管间的网状内皮细胞组成[8]。
本组11例均为S-SHB,临床上极为罕见,影像学误诊率极高(本组病例均误诊为其他肿瘤),其影像学特征包括:①位于幕上的HB病灶形态多规则,边界清晰,位置表浅,靠近大脑镰旁或大脑凸面表浅部位,与硬脑膜关系密切,但增强扫描无脑膜强化及脑膜尾征。有研究证实,脑膜尾征主要由于肿瘤细胞浸润和血管扩张所致;而组织学显示HB周围组织少有肿瘤细胞浸润,境界清楚[9]。本组病例术中证实肿瘤边界清晰,有包膜,局部与硬脑膜粘连,但无组织浸润的征象。②S-SHB体积一般较大且瘤体密实,这与HB肿瘤核浆比高、肿瘤细胞排列紧密、基质稀少有关[10]。本组8例瘤体直径均>3 cm,表现为实性成分肿块,CT平扫呈稍高密度,MRI平扫大部分病灶信号均匀,T1WI呈稍低信号,T2WI/FLAIR呈稍高信号,仅2例出现小囊变(囊变率<20%)。其密度/信号强度与肿瘤细胞的密度、细胞外间隙和组织结构等保持一致。③病灶常有瘤内或瘤周漩涡状或蚯蚓状血管流空影,以T2WI显示最佳。本组中9例MRI均可见此特点,此
为实质型HB的MRI典型特点,与文献报道类似[11-12],可能与HB瘤体内富含大量不成熟的毛细血管有关。④病灶增强扫描呈显著性均匀强化,血供十分丰富。本组7例强化程度近似血管强化,部分可见增粗的供血动脉。组织学上HB由不同成熟阶段的薄壁血管及血管网内皮细胞2种成分构成[13]。由于肿瘤的不成熟薄壁小血管缺乏血-脑屏障导致的肿块显著性强化,是HB诊断及鉴别诊断的关键所在。⑤与幕下HB瘤周水肿轻或无不同,幕上HB瘤周水肿较为显著。本组重度水肿多见(7/11),中度水肿(3/11)、轻度水肿少见(1/11),可能与部分瘤体富含大量不成熟的毛细血管、致毛细血管通透性增加、血管内液渗出较多,以及实性肿瘤的占位效应使局部静脉回流障碍等因素有关[14]。
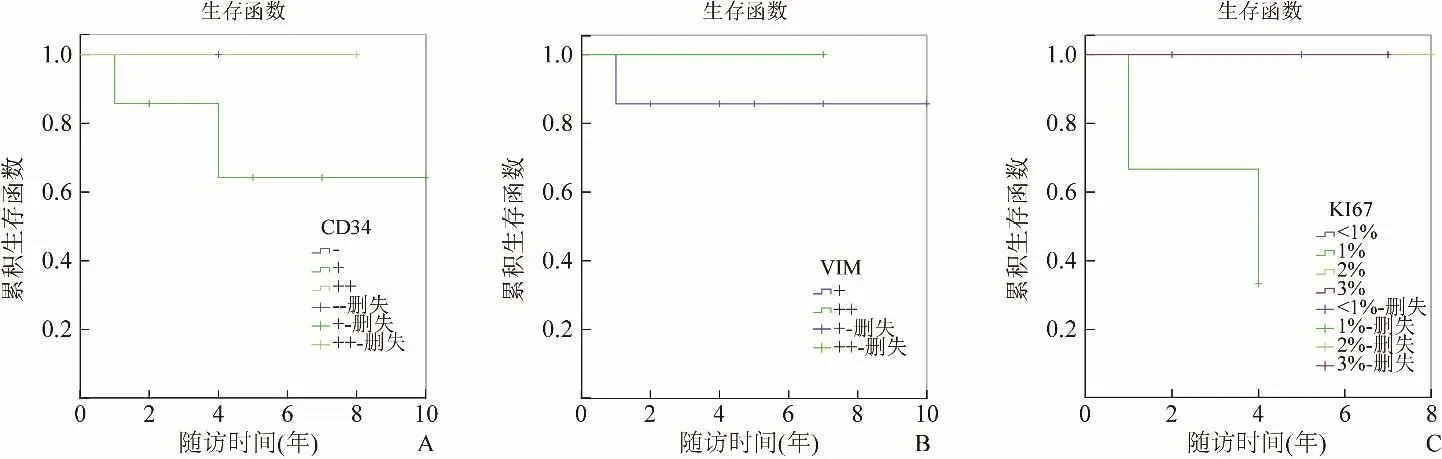
图3 各免疫指标因素的相关生存曲线。单因素分析结果显示血管内皮细胞CD34(A)、间质细胞Vim(B)、Ki-67(C)与预后无关,对患者的RFS无预测意义
3.2 幕上实性HB的临床、治疗及预后分析 本组S-SHB均为散发型,无VHL综合征家族史,临床症状缺乏特异性。其中7例以反复头痛、头晕为首发症状,3例以抽搐为首发症状。目前S-SHB以显微手术切除为主,放化疗效果尚存在争议[15]。
与囊性为主的HB相比,S-SHB血供极其丰富,瘤体以血管性结构为主,手术切除难度及风险大,分块切除易大出血且难以控制。针对此种情况,对于肿瘤较大者(>4 cm)可先行肿瘤供血动脉的栓塞,有助于缩小肿瘤体积、减少术中出血、分离肿瘤和正常脑组织[16]。本组中1例复发S-SHB患者临床先行肿瘤供血动脉栓塞,待病情好转后再行肿瘤分块切除,术后随访效果良好。
对于治疗残留、复发或难以切除的HB患者可行放疗。使S-SHB的血管闭塞,肿瘤细胞死亡,达到控制肿瘤生长的目的,使肿瘤缩小或停止生长,国外报道有效率达97.4%[17]。有研究表明,伽马刀对于中小型S-SHB具有良好的中短期控制作用,可延缓肿瘤复发[18]。本组中1例复发的S-SHB行伽马刀治疗后随访病灶缩小,效果良好。
HB组织学显示肿瘤细胞大小形态比较一致,形态温和,有丰富的毛细血管网,周围的神经组织很少见到肿瘤细胞浸润,病理性核分裂象少见,Ki-67增殖指数不高,大部分<3%。本组中Ki-67表达率在原发组与复发组中并无显著差异,这可能表明肿瘤即使复发,潜在的生物学行为并未发生明显的改变,仍属于良性范围,即WHO分级I级。本组患者中位无瘤期达到36个月。
HB虽然为良性肿瘤,术后并发症也较少,但常可局部复发,复发率为15%~27%[19]。本组11例共2例复发,复发率为18%,与文献报道基本一致[19]。本研究探索肿瘤影像学特点、免疫组化指标及预后之间无显著关系,其原因可能与样本量较少有关,尚无法得出有意义的预测结果。因此,影响预后的因素还有待进一步探讨。本研究认为影响预后的因素主要取决于手术方式及切除范围。建议HB患者术后需定期随访,以便早期发现复发或散播。
3.3 鉴别诊断 S-SHB位置表浅,多靠近大脑镰旁或大脑凸面,影像学常误诊为脑膜瘤或血管周细胞瘤(hemangiopericytoma,HPC)。本研究总结鉴别在于以下要点。①流空血管征:注意观察瘤内及瘤周有无流空血管影,此为HB的典型特点;部分HPC亦可见此征象,但易发生囊变坏死,而脑膜瘤一般无此征象。②与硬脑膜附着形式:脑膜瘤多以宽基底附着,增强扫描常见脑膜尾征,HB和HPC多与硬脑膜窄基底相连,增强扫描无脑膜尾征。③邻近颅骨破坏程度:HPC具有侵袭性生物学行为,常引起邻近颅骨破坏,而脑膜瘤可引起邻近颅骨骨质增生改变;HB为良性肿瘤,不会引起颅骨骨质破坏。④瘤周水肿程度:HB多见瘤周中重度水肿;脑膜瘤及HPC属脑外肿瘤,其瘤周水肿多为轻中度水肿。⑤定位征象:脑膜瘤或HPC是脑外肿瘤,生长于蛛网膜外,凸向脑内生长,与脑组织之间有脑脊液相隔,常见白质挤压征;而HB是脑内肿瘤,肿瘤主体最大径位于脑实质内。
本研究的局限性为:①样本量较小,结果尚需更大样本量的随访研究进一步验证;②影像资料为常规图像,未包含功能成像如扩散和灌注成像等。有研究表明影像组学对颅内肿瘤的鉴别诊断有一定的价值[20]。后续研究可进一步探讨影像组学在鉴别实性HB和血管瘤型脑膜瘤的价值。
总之,位置表浅、瘤内或瘤周血管流空影、瘤周水肿明显等影像特点是S-SHB的特征性表现,是术前诊断和制订治疗决策的重要依据,掌握其特点有助于减少误诊,提高手术安全性。
