一种高活性乙烯合成酶的鉴定和性质研究
2021-08-24苏宾宾张佟佟刘海萍
苏宾宾,张佟佟,刘海萍
(1. 天津科技大学 生物工程学院,天津300457;2. 中国科学院天津工业生物技术研究所 化学生物学中心,天津300308)
乙烯,作为全世界最重要的工业化学品之一,是各种塑料、橡胶、纺织品以及化学品等工业制品的基本原料,具有巨大的经济价值[1-2]。现阶段,乙烯主要是通过石油裂解工艺获得。然而,在石油化工生产乙烯的同时,消耗了大量不可再生的化石能源并且排放出二氧化碳、二氧化硫、硫化铵等废气污染物,造成了严重的环境污染问题[3]。因此,开发乙烯生物合成途径成为合成生物学研究的热点。
微生物如丁香假单胞菌[4-6](Pseudomonassyringae)和指状青霉[7](Penicilliumdigitatum)具备乙烯合成途径,该途径是以α-酮戊二酸(2-oxoglutarate,2-OG)和精氨酸(L-Arg)为底物,经乙烯合成酶(Ethylene forming enzyme,EFE)催化生成乙烯。同时,该反应还会生成1-吡咯啉-5羧酸盐(1-pyrroline-5-carboxylate, P5C)。这种乙烯合成途径对微生物没有毒害作用,而且比植物途径[8-9]更简单。因此,在乙烯生物合成途径的工业化生产应用中,微生物来源的乙烯合成酶潜力巨大。
目前,活性最高、研究最多的乙烯合成酶仅来源于Pseudomonassyringaepv.phaseolicolaPK2[10-11](PsEFE,Kudzu strain),在将该种属efe基因引入蓝藻[12-14]表达体系中后,通过改进启动子、转录因子、优化代谢通路、优化表达条件等方式使得乙烯产量有所提高[15-16],但由于酶本身催化活性限制,产率较低,无法达到工业化生产要求。此外,PsEFE在酶促反应过程中表现出明显的底物抑制作用,这成为它在未来工业化应用中的负面因素[17]。因此,需要深入挖掘催化活性更高、催化性能更好的乙烯合成酶并对其酶学性质进行分析研究[18]。
本研究对不同微生物中乙烯合成酶(EFE)同源基因的筛选,实现了6种不同种属来源efe基因在大肠杆菌BL21(DE3)中的异源表达,通过金属离子螯合亲和层析、离子交换层析、凝胶过滤层析3种纯化方法制备得到了高纯度EFE目的蛋白,并且利用气相色谱法与茚三酮显色法测定了各个种属EFE纯酶比酶活。成功获得了一种Neofusicoccumparvum(NpEFE)来源的高活性乙烯合成酶。通过选用不同pH缓冲液确定了高活性NpEFE催化反应最适pH条件,并对其底物动力学参数做了研究分析。
1 材料与方法
1.1 质粒与菌株
根据EFE的基因进化树,除Pseudomonassyringaepv.phaseolicolaPK2(PsEFE)外,另选取5个不同种属来源的efe同源基因(表 1),委托GenScript公司合成。大肠杆菌感受态细胞DH5α、BL21(DE3)购自北京全式金公司。
1.2 主要试剂
PCR试剂、T4 DNA连接酶、DNA Marker、限制性内切酶NdeI、XhoI以及蛋白Marker均购自Takara公司。质粒小提试剂盒、DNA凝胶回收试剂盒购自康为世纪生物科技有限公司;其他试剂购自北京索莱宝科技有限公司。HisTrap HP组氨酸标记亲和层析柱、HiTrapTMQ HP和SuperdexTM200 pg分子筛层析柱购自GE healthare公司。
1.3 重组质粒构建
以GenScript公司合成的基因为模板,通过聚合酶链式反应(PCR)扩增目的基因片段,所用引物由中国科学院天津工业生物技术研究所合成(表 2)。纯化PCR产物并经NdeI、XhoI限制性内切酶酶切后构建到pET28a载体上,将构建好的重组质粒转化至大肠杆菌感受态细胞DH5α中,次日挑取阳性转化子培养并提取质粒委托金唯智基因公司测序。

表2 pET28a载体系列重组质粒所用引物Table 2 The primers of pET28a series recombinant plasmids
1.4 EFE的表达和纯化
将重组质粒转化至大肠杆菌BL21(DE3)感受态细胞中,选取阳性转化子接种至1 L LB培养基中,37 ℃摇瓶培养至OD600值为0.6~0.8时添加0.5 mmol/L IPTG,16 ℃、200 r/min过夜诱导表达。
离心收集菌体并用裂解缓冲液(20 mmol/L Tris-HCl pH 8.0,200 mmol/L NaCl)重悬菌体,使用高压均质仪破碎细胞,高速离心获取上清液后依次使用HisTrap HP组氨酸标记亲和层析柱、HiTrapTMQ HP阴离子交换柱以及SuperdexTM200 pg分子筛层析柱纯化目的蛋白并进行SDS电泳检测,收集含高纯度乙烯合成酶的目的蛋白组分,浓缩到10 mg/mL后-80 ℃保存备用。
1.5 EFE酶活测定
EFE酶活力单位(U)是指在特定反应条件下每分钟催化生成1 nmol产物(乙烯或P5C)所需的酶量。酶比活力是指每毫克酶蛋白具有的酶活力(U/mg蛋白)。
1.5.1 气相色谱法测定乙烯合成活性
检测反应体系[7]为1 mL,组成成分为40 mmol/L Hepes pH 7.5,0.4 mmol/L L-ascorbic acid,0.5 mmol/L 2-OG, 0.5 mmol/LL-Arg, 0.2 mmol/L (NH4)2Fe(SO4)2,10 μg/mL EFE蛋白。室温密闭反应3 min后,使用气密针抽取1 mL气体手动上样检测。所用气相色谱仪是Agilent 7890B,色谱柱为HP-Plot Q柱,规格为30 m×530 μm×40 μm,氢焰离子检测器,柱箱温度为32 ℃±1 ℃。依据乙烯浓度标准曲线定量所检测到的乙烯生成量。所有实验进行3次平行实验,最后结果为3次实验的平均值。
根据乙烯浓度标准曲线,将乙烯吸收峰面积换算成乙烯生成量。乙烯合成比活力为乙烯的量(nmol)/[3 min×蛋白量(0.01 mg)]。
1.5.2 茚三酮显色法测定P5C合成活性
P5C可由茚三酮显色法进行测定[19-20],反应体系与测定乙烯产量体系相同。加入HCl终止反应,然后加入250 μL茚三酮,100 °C水浴15 min,室温冷却,离心弃除上清液,保留红色沉淀,加入50 mmol/L Tris-HCl,pH 8.0以及1 mL 47.5%乙醇后重悬均匀,在UV620nm条件下检测吸光值,确定P5C产量,计算P5C合成活性。
1.6 NpEFE酶学性质表征
选用柠檬酸钠(pH 4.0、4.5、5.0和5.5)、MES(pH 6.0、6.5)、HEPES(pH 7.0、7.5和8.0)、Tris-HCl(pH 8.5和9.0)不同pH缓冲液测定NpEFE的乙烯合成酶酶活力,确定酶催化反应最适pH条件。酶活测定方法和比活力计算方法与上述乙烯合成酶活性测定方法相同。
测定NpEFE稳态动力学参数时,保持α-酮戊二酸和精氨酸两种底物中的一种底物浓度恒定在500 μmol/L,而改变另外一种底物浓度(0~640 μmol/L),其余测活体系组成成分与气相色谱测活反应体系相同。根据已经建立的乙烯标准曲线定量乙烯产量,利用Graphpad Prism 7.0软件中的底物抑制动力学模型对初速度数据进行非线性回归分析。
2 结果与分析
2.1 EFE蛋白的表达纯化与酶活测定
将各种efe基因构建到pET28a载体后提取质粒,测序得到质粒序列,经比对,与设计序列完全一致。在大肠杆菌BL21(DE3)中成功实现了PsEFE、RsEFE、NpEFE、PdEFE、CpEFE以及NcEFE的异源表达并获得可溶性蛋白。将纯化后的上述6种蛋白进行SDS-PAGE检测,结果显示(图1),每种EFE蛋白纯度高并且蛋白分子质量与其理论值一致,产量均为10 mg左右。
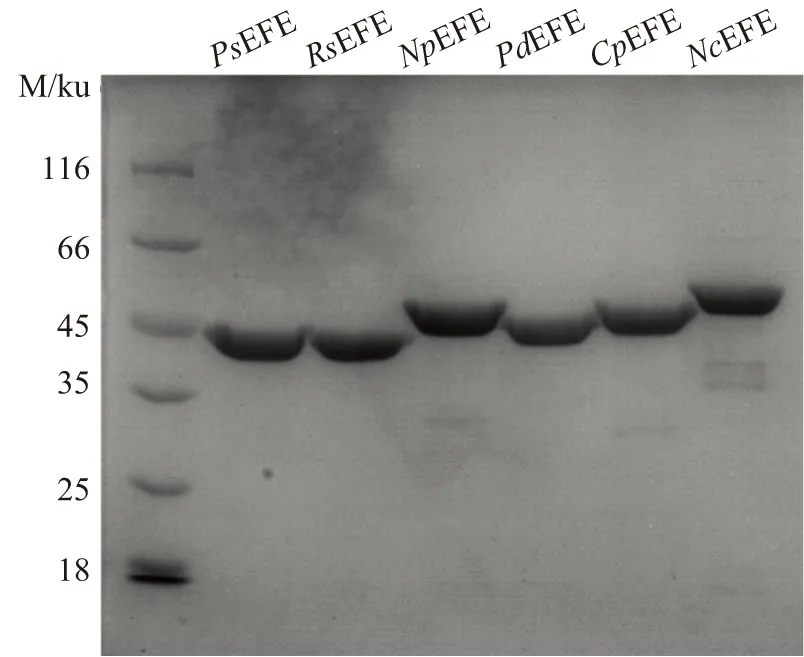
图1 各个种属EFE的SDS-PAGE检测分析Figure 1 SDS-PAGE analysis of EFEs
用气相色谱法测定上述6种乙烯合成酶催化产生的乙烯产量并计算比活力,经比较发现(表3),NpEFE酶活性明显高于PsEFE,为6种乙烯合成酶中活性最高的酶,因此,选择NpEFE作后续酶学性质研究。
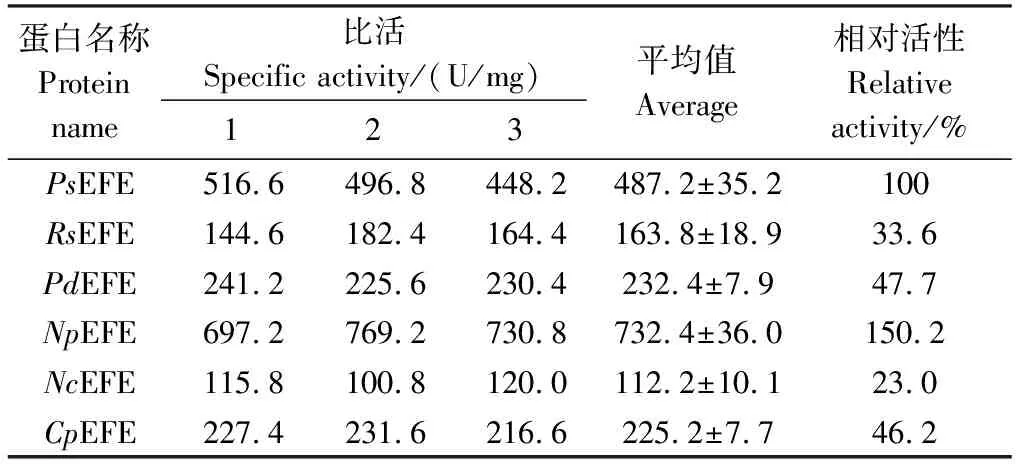
表3 不同种属EFE酶的乙烯合成活性Table 3 The ethylene forming activities of different EFEs
2.2NpEFE酶学性质表征
2.2.1NpEFE催化反应最适pH条件
在pH 4.0~5.5条件下,NpEFE活性受到抑制,酶比活力为零。随着pH值升高,酶比活力逐步提高。在pH 7.5时,NpEFE酶比活力达到最高,为(730.7±56.9) U/mg。当pH值继续升高,酶比活力逐步降低,在pH 9.0时,NpEFE仍有活性,但酶比活力仅为最高状态时的40%(图 2)。因此,NpEFE催化反应最适pH值为7.5。
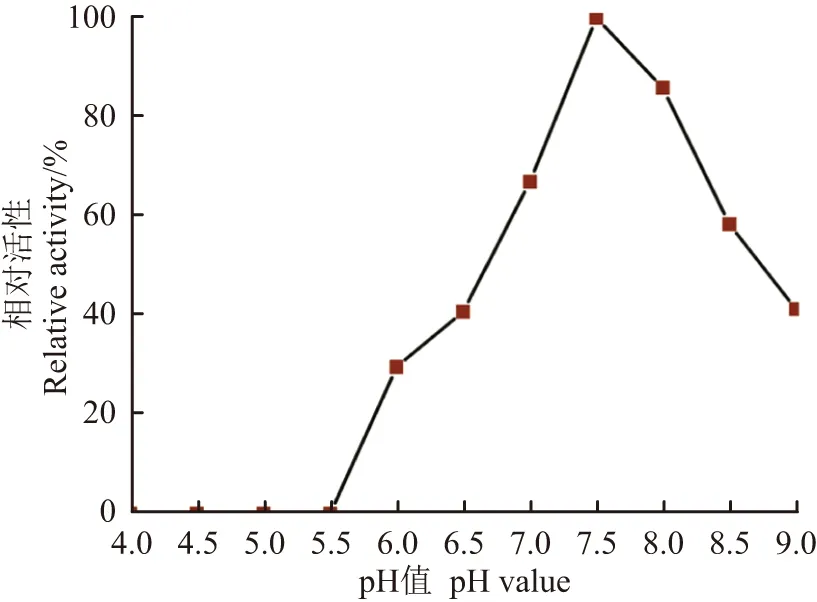
图2 pH值对NpEFE催化活性的影响Figure 2 Effects of pH values on the enzymatic activity of NpEFE
2.2.2NpEFE动力学特征
保持α-酮戊二酸和精氨酸两种底物中的一种底物浓度恒定在500 μmol/L而改变另外一种底物浓度(0~640 μmol/L),根据产物乙烯产量或者P5C产量测定乙烯合成酶在不同底物浓度下的酶活,通过Graphpad Prism 7.0软件中的动力学模型对初速度数据进行非线性回归分析(图3),计算得出了NpEFE和PsEFE对于两种底物α-酮戊二酸和精氨酸的动力学参数(表4)。 利用软件自带的方程拟合得到Km和Vmax值,kcat值由Vmax/酶的浓度计算得到。
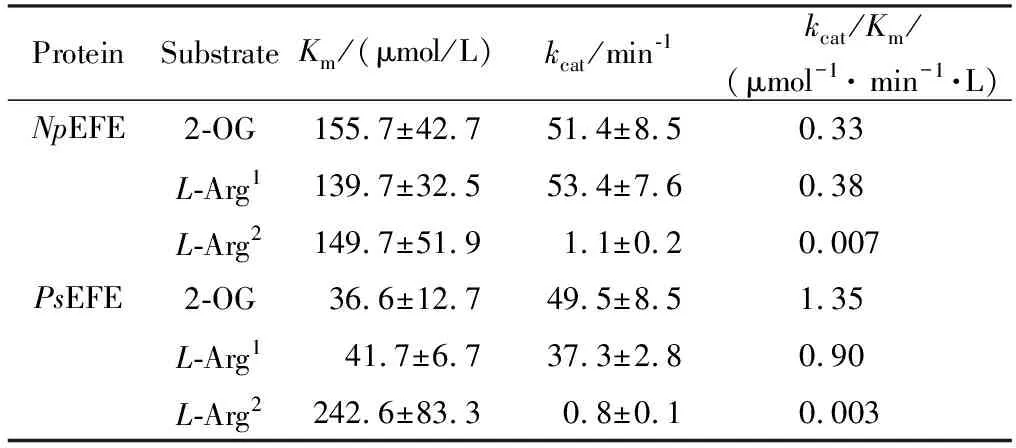
表4 NpEFE和PsEFE对于底物α-酮戊二酸和精氨酸的动力学参数Table 4 NpEFE and PsEFE kinetic parameters for the substrates of 2-OG and L-Arg
NpEFE在不同浓度α-酮戊二酸下的乙烯生成活性和不同浓度L-精氨酸下的P5C生成活性均符合经典的酶催化反应。因此,在用Graphpad Prism 7.0软件分析时,采用标准的Michaelis-Menten方程拟合[图3 (a)和(c)]。在不同L-精氨酸浓度下,NpEFE的乙烯生成反应曲线则表现出较弱的底物抑制作用。因此,采用底物抑制动力学模型对其进行拟合[图3 (b)]。PsEFE在不同浓度α-酮戊二酸和不同浓度L-精氨酸下的乙烯生成反应曲线都表现出明显的底物抑制作用,采用底物抑制动力学模型进行拟合[图3(a)和(b)]。
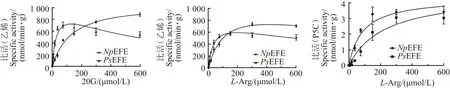
(a)NpEFE与PsEFE在底物α-酮戊二酸不同浓度下催化生成乙烯的酶活性曲线;(b)NpEFE与PsEFE在底物L-精氨酸不同浓度下催化生成乙烯的酶活性曲线;(c)NpEFE与PsEFE在底物L-精氨酸不同浓度下催化生成P5C的酶活性曲线。图3 NpEFE与PsEFE的酶活性曲线Figure 3 Enzymatic activity les of NpEFE and PsEFE
3 讨论
本研究通过多种微生物乙烯合成酶基因在大肠杆菌中的表达纯化和活性测定,发现来源于蓝莓枝枯病菌Neofusicoccumparvum的乙烯合成酶NpEFE具有较高活性,并系统测定了NpEFE的酶学性质,包括其反应动力学参数以及反应最适pH值。目前已知活性最高的乙烯合成酶是来源于丁香假单胞菌的PsEFE,文献报道其乙烯合成比酶活为(548±30) U/mg[11,21]。在我们实验室条件下测定的PsEFE比酶活为(487.2±35.2) U/mg,与文献报道值相当。相同实验条件下测定的NpEFE和PsEFE的活性和酶动力学参数表明NpEFE的活性明显高于PsEFE。PsEFE对α-酮戊二酸和L-精氨酸均表现出明显的底物抑制作用,而NpEFE对α-酮戊二酸没有表现出底物抑制作用,高浓度的L-精氨酸仅略微降低了NpEFE的活性。当底物浓度高于300 μmol/L时,NpEFE酶活性要高于PsEFE酶活性。当底物浓度进一步提高到大于600 μmol/L时,NpEFE酶活性几乎是PsEFE酶活性的2倍。另一方面,在高浓度底物条件下,NpEFE催化生成副产物P5C的活性与PsEFE几乎相同,也说明NpEFE产生的副产物比例更低。目前已有很多关于将PsEFE应用到工业菌株蓝藻中产生乙烯的研究并取得了一定进展[13-16],但乙烯产量仍然偏低,其中乙烯合成酶的活性、底物抑制效应和副产物是重要的制约因素。因此,对未来生物乙烯的工业化生产而言,来源于Neofusicoccumparvum的NpEFE表现出更加优良的酶学性质,具有更大的应用潜力。
目前,已有晶体学研究阐明了α-酮戊二酸和L-精氨酸这两种底物与PsEFE的结合方式[17,22]。NpEFE与PsEFE氨基酸序列比对一致性结果为52.0%。有趣的是,在两个种属的乙烯合成酶中,参与底物结合的残基都是相同的。因此,可能是其他位置的结构变化,特别是底物进出通道的大小和极性对催化反应速率、底物抑制和正副反应选择中发挥了作用。目前有关乙烯合成酶的催化机制只来源于有关PsEFE的研究,且尚有较大争议[17,22],底物进出通道也未得到合理的揭示。NpEFE的发现及其性质鉴定为进一步阐明EFE的作用机制提供了新的研究视角。
致谢:感谢中国科学院工业生物技术研究所技术支撑中心顾芮萌和张洁在气相色谱和蛋白纯化方面的帮助。
