谷氨酸棒杆菌漆酶基因NCgl0908的克隆、表达及功能
2021-08-24司雅楠刘秀霞杨艳坤詹锦玲白仲虎
司雅楠,刘秀霞,杨艳坤,詹锦玲,白仲虎
(1. 江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122;2. 江南大学 工业生物技术教育部重点实验室,无锡 214122;3. 江南大学 生物工程学院,无锡 214122)
漆酶是一种含铜的多酚氧化酶,能催化酚类和芳香类化合物的氧化,使之生成相应的苯醌,同时伴随着电子的转移,将分子氧还原成水。其底物为单酚、二元酚、多酚类、甲氧基取代的酚类和芳香二胺等,此外也能与非酚类化合物反应[1]。催化底物的广谱性使得漆酶具有较高的生物技术应用潜力以及工业应用价值。目前漆酶已相继应用在纺织工业、造纸工业、环境保护、生物修复、新能源开发等众多领域[2-4]。在对已经功能鉴定的漆酶蛋白进行一级结构分析时,发现4个铜离子结合位点的氨基酸序列高度保守,分别是HXH、HXH、HX2HXH和HXHX3HX(X代表任何一种氨基酸残基)。4个铜离子中包括Ⅰ型铜离子1个(单电子受体,具有顺磁性,在λ610nm处有特征吸收峰);Ⅱ型铜离子1个(单电子受体并具有顺磁性,无特征吸收峰);Ⅲ型铜离子2个(双电子受体,具有反磁性,在λ330nm处有宽的特征吸收峰[5])。这些铜离子是漆酶发挥催化作用的重要辅基。在漆酶与底物进行反应时(图1),底物被Ⅰ型铜离子氧化,并将电子通过His-Cys-His三肽传递给Ⅱ型铜离子和Ⅲ型铜离子组成的三核中心,在三核中心处氧分子被还原成水。随着对漆酶研究的不断深入,其晶体结构也被解析出来。它是由3个杯状结构域组成,每个结构域都具有1个β-桶装结构。Ⅰ型铜离子位于结构域3,Ⅱ型铜离子和Ⅲ型铜离子组成的三核中心处于结构域1和3之间[6]。
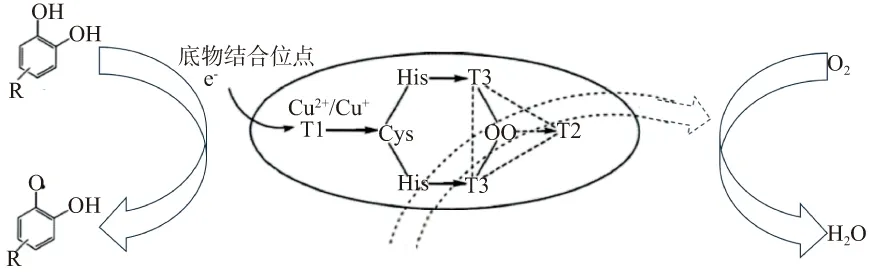
图1 底物/氧/铜离子的电子转移过程Figure 1 Substrates/oxygen/copper ions electronic transfer pathway of laccase
在自然界中漆酶种类繁多,分布广泛,但其生产周期长,产量较低,供不应求。鉴定克隆新的漆酶基因,开发高产量高活性的漆酶已经成为研究热点。目前已有大量的细菌漆酶基因被克隆出来,如大肠杆菌的CueO、枯草芽孢杆菌的CotA、谷氨酸棒状杆菌的CgL1、丁香假单胞菌的CopA等[7-10]。同来源于真核生物的漆酶相比,细菌漆酶具有基因克隆方便、热稳定性好、酶活pH值广泛、无糖基化修饰等优点[11]。这些优点可以使细菌漆酶弥补传统漆酶的不足,应用到真菌漆酶不适用的地方,扩大漆酶的应用范围。
研究用PCR技术从谷氨酸棒杆菌ATCC13032的基因组中扩增得到一个1 542 bp的DNA片段,经过NCBI的BLAST分析发现其编码漆酶的可能性。将这个基因在大肠杆菌中进行重组表达,同时研究了重组漆酶的酶学性质,为后续细菌漆酶的开发与应用奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
大肠杆菌BL21、谷氨酸棒杆菌ATCC13032、表达载体pCold Ⅱ在本实验室保藏。实验中所用的引物见表1,引物的合成和后续的测序均由苏州金唯智公司负责。
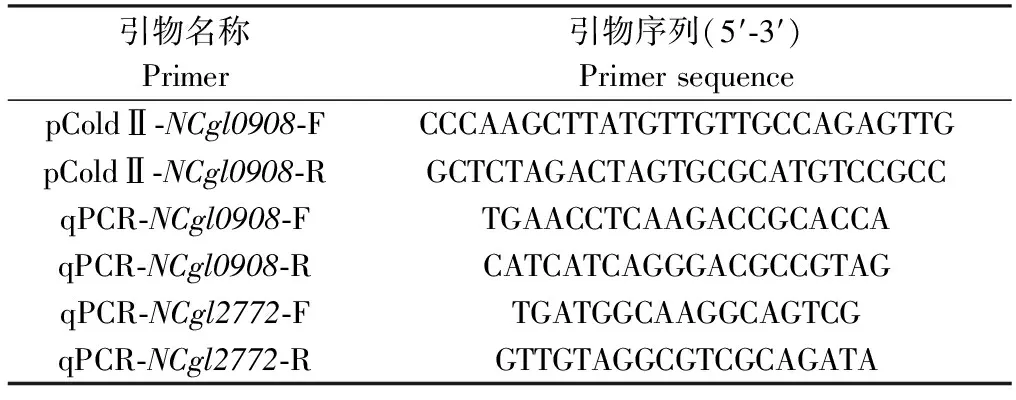
表1 本实验所用的引物
1.1.2 培养基和培养条件
在37 ℃下用LB培养基培养大肠杆菌,在30 ℃下用LBB(LB+1%脑心浸出液)培养基培养谷氨酸棒杆菌,转速均为220 r/min。氨苄抗生素在大肠杆菌中的使用终浓度为34 mg/L。
1.1.3 酶和试剂
Hind Ⅲ、XbaⅠ限制性内切酶(Thermo Fisher Scientific);Primer STAR Max Premix高保真DNA聚合酶(TaKaRa);EsTaqMasterMix聚合酶(康为世纪生物科技);ligation连接酶(TaKaRa);质粒DNA小量提取试剂盒(AXYGEN)、PCR产物纯化试剂盒(AXYGEN)、胶回收试剂盒(AXYGEN);细菌基因组DNA提取试剂盒(天根生化科技);细菌总RNA提取试剂盒(ThermoFisherScientific);反转录试剂盒(TaKaRa);2,2′-连氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS),丁香醛连氮(SGZ),2,6-二 甲 氧 基 苯 酚(DMP)为Aladdin公司产品;HRP-anti 6×His抗体(proteintech)。
1.1.4 主要耗材和仪器
PCR仪LongGene A300(朗基科仪);实时荧光定量PCR仪StepOnePlus(Applied Biosystem)超声波细胞破碎仪VCX800(SONICS);台式高速冷冻离心机Sorvall ST16R(Thermo);紫外可见光分光光度计759S(上海棱光技术);蛋白纯化仪KTA purifier UPC10(GE Healthcare);超滤管(Millipore)。
1.2 方法
1.2.1 生物信息学分析
实验所用到的基因序列从美国国立生物技术信息中心 NCBI(https://www.ncbi.nlm.nih.gov/)中获得;BLAST被用于序列比对;软件MEGA 7.0用于构建系统发育树。
1.2.2 RNA的提取及cDNA的合成
实验采用Trizol 法提取待测样品的总RNA,具体操作过程参考总RNA提取试剂盒的说明书。RNA的质量通过1%琼脂糖凝胶电泳验证,浓度由Q5000进行测定。用反转录试剂盒将待测样品的总RNA反转成cDNA,RNA浓度稀释为1 000 ng/μL。
1.2.3 qRT-PCR法分析转录水平
使用Vazyme的ChamQ SYBR qPCR Master Mix试剂盒进行qRT-PCR反应,反应体系为10 μL:Master Mix (2×) 5 μL,Forward Primer 0.4 μL,Reverse Primer 0.4 μL,样品cDNA 1 μL,RNase Free ddH2O 3.2 μL,加样时要保持低温且避光。扩增机器为ABI StepOnePlus Real-Time PCR System,qPCR反应程序参照文献[12]。以谷氨酸棒杆菌中筛选到的稳定内参基因NCgl2772为内参基因,采用StepOne Software自带的2-ΔΔCt方法计算基因的相对表达量。
1.2.4NCgl0908基因的扩增
使用细菌基因组DNA提取试剂盒提取谷氨酸棒杆菌ATCC13032的基因组DNA。利用引物pColdⅡ-NCgl0908-F/R对基因组进行PCR扩增,得到带有Hind Ⅲ和XbaI接头的NCgl0908基因。
1.2.5 重组表达载体的构建
PCR扩增产物和表达载体pColdⅡ经过Hind Ⅲ和XbaⅠ双酶切后胶回收纯化,然后用Ligation连接酶16 ℃连接2 h,转化至大肠杆菌BL21感受态细胞中,在含氨苄抗生素的LB平板上筛选阳性克隆,并将阳性克隆提取质粒后送到苏州金唯智公司进行测序。
1.2.6 目的蛋白诱导表达及纯化
在15 ℃,220 r/min摇床内培养BL21-pColdⅡ空载菌,BL21-pColdⅡ-NCgl0908重组菌至OD600为0.5时,加入诱导剂IPTG(终浓度为24 μg/mL)后继续培养20 h,诱导目的蛋白的表达。将诱导后的菌液在4 ℃,5 000 r/min的条件下离心10 min后,弃去上清液,用PBS清洗3次,加入30 mL的蛋白纯化上样缓冲液(NaCl 8 g/L, KCl 0.2 g/L, Na2HPO4·12H2O 3.58 g/L, KH2PO40.27 g/L, 20 mmol/L 咪唑, pH 7.4)重悬菌体。置于冰上预冷后进行超声破碎,35%的功率,破碎时间1 s,间隔时间2 s,破碎时间25 min。破碎完成后5 000 r/min离心10 min收集上清液。用0.22 μm针头式滤器将上清液进行过滤并置于冰上作为待纯化的样品。
纯化时先用已抽滤并脱气的超纯水对整个系统进行冲洗,接上蛋白纯化镍柱后,继续用水冲洗10个柱体积,以除去蛋白纯化柱中残留的20%乙醇,用蛋白上样缓冲液平衡柱,将待纯化的蛋白样品以0.5 mL/min的流速进行进样,进样后继续用5个柱体积的蛋白上样缓冲液平衡柱以洗脱杂蛋白,再用洗脱缓冲液(NaCl 8 g/L, KCl 0.2 g/L, Na2HPO4·12H2O 3.58 g/L, KH2PO40.27 g/L, 500 mmol/L 咪唑, pH 7.4)进行梯度洗脱,收集洗脱峰。采用 SDS-PAGE以及 Western Blot检验纯化结果。将具有目标蛋白的洗脱峰用超滤管进行浓缩和缓冲液替换(用PBS缓冲液进行多次替换,除去纯化样品中的咪唑,以防影响后续实验结果)。
1.2.7 漆酶活性的鉴定
实验采用ABTS作为底物检测漆酶活性:将3 mL的待测样品反应液(2 700 μL HAc-NaAc buffer, 200 μL ABTS, 100 μL 纯化后样品)在室温下放置30 min后检测反应液在3 min内420 nm下的OD值变化[13]。把经过15 min沸水浴去除酶活性的纯化蛋白作为对照组。
1.2.8 米氏常数的测定
米氏方程指一个酶促反应的起始速度(V)与底物浓度(S)关系的速度方程:V=Vmax·S/(Km+S),米氏常数由酶的特性决定,Km和Vmax的测定主要采用Lineweaver-Burk双倒数作图法[14]。加入不同浓度的底物ABTS(15~500 μL),420 nm处按照1.2.6的方法分别测定酶活,计算得到Vmax和Km。
2 结果与分析
2.1 NCgl0908基因的生物信息学分析
在NCBI数据库中,NCgl0908基因注释为多铜氧化酶,全长1 542 bp,编码513个氨基酸,其分子质量理论计算值为56 ku左右。将NCgl0908基因序列在NCBI上进行BLAST分析,选择相似度较高的细菌和真菌漆酶采用MEGA 7.0构建系统进化树,见图2(a)。结果表明其与大肠杆菌的漆酶基因CueO具有高度的同源性。此外将它们的4个铜离子结合位点进行比对,发现这些结构域高度保守,分别为HXH、HXH、HX2HXH和HXHX3HX,见图2(b)。基于以上生物信息学分析,推测NCgl0908基因是谷氨酸棒杆菌中一个未被鉴定的漆酶基因。
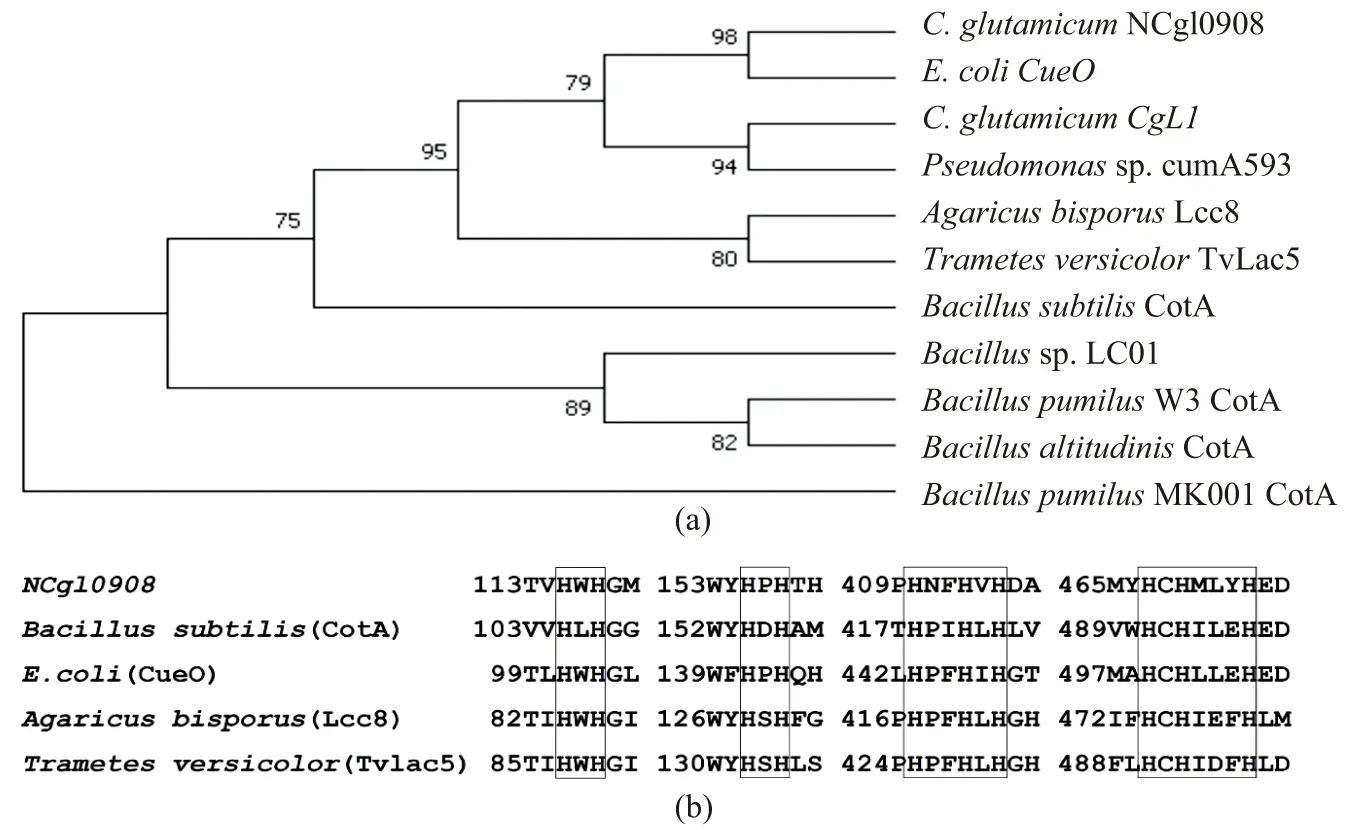
图2 NCgl0908和部分细菌、真菌漆酶基因进化树及保守结构域分析 Figure 2 Evolutionary tree and conserved domain analysis of NCgl0908 and some bacteria and fungal laccase genes
2.2 不同底物诱导后NCgl0908基因表达模式分析
为了从转录水平上验证生物信息学分析的结论,将谷氨酸棒杆菌以1%的接种量接种到3瓶分别含有ABTS、SGZ、DMP的LBB液体培养基中,加入等体积ddH2O的LBB培养基作为对照,4瓶培养基在摇床中培养到对数期后分别取样提取样品中的总RNA,反转成cDNA后通过qRT-PCR方法检测NCgl0908基因的转录水平,结果(图3)显示NCgl0908在存在底物的情况下其mRNA水平显著提高。在ABTS的存在下,NCg10908转录水平被上调了5.76倍,在DMP的存在下被上调了2.40倍,在SGZ的存在下被上调了4.37倍。尽管它们都是漆酶的底物,但相同的酶对不同的底物具有不同的亲和力。因此,这些底物对NCgl0908的诱导表达程度略有不同。
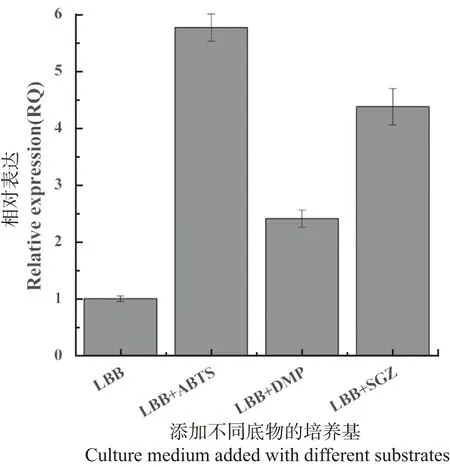
图3 NCgl0908基因转录水平的检测Figure 3 Detection of NCgl0908 gene transcription level
2.3 NCgl0908基因的克隆、表达及纯化
以谷氨酸棒杆菌ATCC13032基因组扩增NCgl0908基因,PCR 产物经 1% 琼脂糖电泳检测大小约为1.5 kb,与预期大小相符。将目的基因片段与带有His标签的pColdⅡ载体经酶切酶连构成NCgl0908表达载体。将经菌落PCR、酶切验证[图4(a)]以及测序正确的表达载体转化到表达宿主大肠杆菌BL21中。经IPTG诱导目的蛋白表达后,利用镍柱亲和层析法将待纯化样品进行纯化。纯化结果如图4(b)所示,重组漆酶的SDS-PAGE电泳呈现单一条带且无其他杂蛋白,表明重组漆酶纯化效果较好,且与软件预测的大小一致。经Western Blot分析表明[图4(c)],重组漆酶可以特异性地与HRP-anti 6×His抗体发生反应。
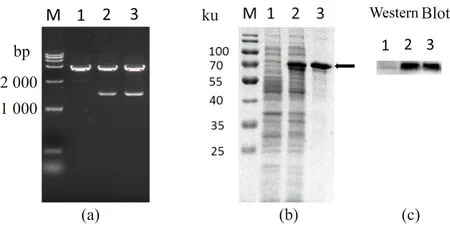
(a)1为pColdⅡ空载体;2、3为NCgl0908表达载体。(b)和(c)1为含有pColdⅡ空载体的大肠杆菌BL21;2为样品原液;3为纯化后样品。图4 表达载体酶切验证结果及蛋白纯化结果Figure 4 Expression vector digestion verification result and the protein purification
2.4 重组漆酶的活性检测
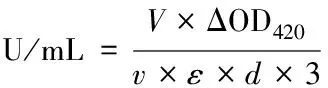

1:蛋白+底物;2:底物;3:失活后蛋白+底物。图5 纯化的NCgl0908蛋白与漆酶底物ABTS的活性检测Figure 5 Activity detection of purified NCgl0908 protein and laccase substrate ABTS
2.5 重组漆酶动力学常数测定
为了测定NCgl0908漆酶的米氏常数,以6种浓度梯度的ABTS作为底物,加入相同NCgl0908漆酶进行酶促反应,具体反应体系如表2所示。以ABTS底物浓度的倒数1/S为横坐标,以1/V为纵坐标,得到NCgl0908漆酶的双倒数曲线如图6所示,经米氏方程计算,得出其米氏常数Km=2.22×10-4mol/L,最大反应速率Vmax=2.432×10-6mol/(L·min)。
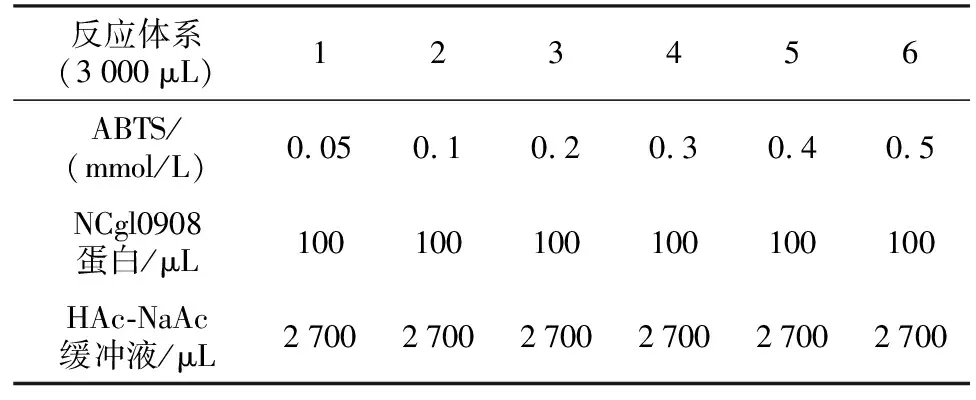
表2 酶促反应体系
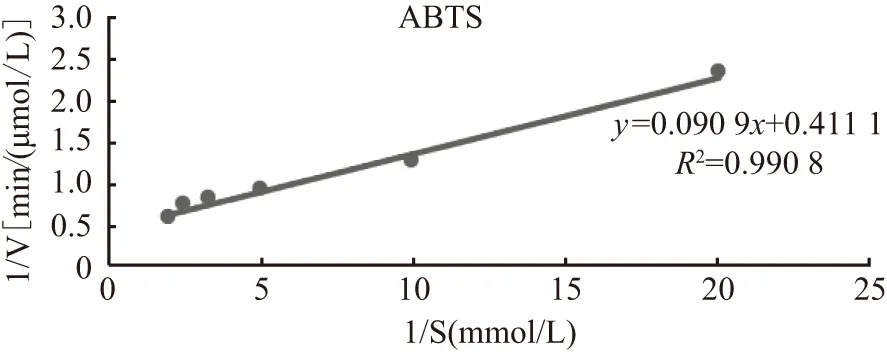
图6 NCgl0908漆酶与漆酶底物ABTS的双倒数作图Figure 6 Plot of NCgl0908 laccase with ABTS as substrate
3 讨论与结论
早期漆酶被认为只存在于真核生物中,但随着基因组学的不断发展与完善,人们根据已知的真核生物中漆酶的氨基酸序列,发现了第一个来源于生脂固氮螺菌的细菌漆酶[15]。随后,基因组学的快速发展以及生物信息学技术的进步使得数据库中积累了越来越多的被注释的细菌漆酶基因[16]。但迄今为止,细菌漆酶的可用工具箱还很有限,工业生产应用中还是以真菌漆酶为主。
谷氨酸棒杆菌因其在工业生产中的诸多优点被广泛应用于氨基酸和有机酸的生产,同时还具有高附加值外源蛋白的表达宿主。先前Ricklefs等[17]从谷氨酸棒杆菌中发现了一种新的细菌漆酶CgL1,该酶不仅具有漆酶活性,还显示出亚铜氧化酶活性。这使得CgL1成为生物技术应用的潜在候选者。研究发现了谷氨酸棒杆菌中的又一个漆酶基因。从谷氨酸棒杆菌ATCC13032中克隆了一个多铜氧化酶基因NCgl0908,并实现其在大肠杆菌中的可溶性表达。目的蛋白经纯化后,其漆酶活性以及动力学参数也经过了实验的测定。与其他细菌漆酶相比,该酶在大肠杆菌中的可溶性表达量较高,可达56 mg/L;而漆酶CgL1在大肠杆菌中的可溶性表达量为35 mg/L[17];链霉菌漆酶SsL1在大肠杆菌中的可溶性表达量为40 mg/L[18]。但其对漆酶底物ABTS的催化效率并不高,如假单胞菌漆酶MMB-1的Km值为1.84×10-3mol/L,克雷伯氏菌漆酶Klebsiellasp.601的Km值为5.63×10-3mol/L[19]。虽然NCgl0908漆酶基因离实际的工业应用还有很大的距离,但该研究扩展了可用细菌漆酶的工具箱,并为后续细菌漆酶研究和开发提供了有利的参考和理论支持。此外,对于研究中的一些不利因素,我们可以在后续的实验中进行改善。如重组漆酶的活性不高,来源于栓菌属的漆酶LacD在毕赤酵母中表达后其活性可达到83 U/mL[20]。后续可以通过表达条件的优化或更换表达系统来进行活性的提高;对于其酶学性质和催化效率,也可通过定点突变和定性进化等方式进一步提高。
