SARS-CoV-2核衣壳蛋白预测与原核重组表达应用
2021-08-24秦小波张冰冰高继海
秦小波, 高 华, 张冰冰, 高继海
(1. 四川省自然资源科学研究院,成都 610015; 2. 成都中医药大学 药学院 西南特色中药资源国家重点实验室,成都 611137; 3.成都市第三人民医院 血液科,成都 610031; 4. 成都大学 医学院(护理学院), 成都 610106)
新型冠状病毒(SARS-CoV-2)是具有包膜的正链RNA病毒,属冠状病毒属(Coronavirus);其感染引起的肺炎被世界卫生组织命名为新型冠状病毒肺炎(COVID-19)[1]。SARS-CoV-2属于β属的新型冠状病毒,其颗粒多是多形性,直径约60~140 nm;其基因特征与中东呼吸综合征冠状病毒(MERS-CoV)和急性呼吸系统综合征冠状病毒(SARS-CoV)有明显区别[2];其RNA既可像mRNA 一样直接进行蛋白翻译,也可当作模板合成负义链,再经负义链复制子代RNA,具有很高的突变率[3]。
已公布的SARS-CoV-2基因组序列[4-5]中,基因组全长约30 kb,预测的开放读码框架(ORF)达11个,可能编码已知或未知的成熟功能蛋白20余种;其基因组具有典型的冠状病毒基因组结构,依次为5′-非翻译区、5′-复制酶多聚糖蛋白基因(orf1/ab)、刺突糖蛋白基因(Spike, S)、小包膜糖蛋白基因(envelope,E)、膜糖蛋白基因(membrane,M)、核衣壳蛋白基因(nucleocapsid,N)以及3′-非翻译区[6]。SARS-CoV-2作为一个新变种,其流行规律、致病机制与病原学特征都和以往流行的冠状病毒具有差异。SARS-CoV-2全基因组序列的破译,为COVID-19的诊断与相关研究提供了非常有用的基础。又因其与SARS-CoV基因组表现出较高的序列同源性[2,6],相关研究可通过与已有的其他冠状病毒的蛋白编码特征比较预测,为后续研究提供有力的指导。
核衣壳蛋白即N蛋白,是RNA病毒的主要结构蛋白之一,与致病性密切相关。SARS-CoV-2 N蛋白的功能主要与结合病毒RNA发挥作用相关,可能参与RNA的转录及复制等,更全面的生物学功能还需深入研究。从预测的蛋白质氨基酸序列分析,其可能还具有与致病机理相关的新功能,因此在COVID-19的诊断以及疫苗研发方面具有重要意义。
通过公开的新型冠状病毒的全基因组数据分析发现,N蛋白在不同地区的SARS-CoV-2中几乎没有变异,在冠状病毒间变异也较小,且核心结构区域保守。因此,其重组抗原对亚单位疫苗的研究和诊断试剂的研制具有重要价值。本研究利用生物信息学预测分析SARS-CoV-2的N蛋白结构,构建原核系统并进行表达,获得了大量高效表达的重组蛋白,为其作ELISA包被抗原开展抗体检测提供基础,也为后续相关深入研究提供借鉴和帮助。
1 材料与方法
1.1 材料
大肠杆菌菌株BL21、质粒载体pET-28实验保存。核衣壳蛋白基因编码序列等根据GenBank:NC_045512由擎科生物科技有限公司根据密码子偏好优化合成。各种限制性内切酶、连接酶等购自TaKaRa公司;Ni-NTA 柱购自QIAGEN公司;抗His-tag多克隆抗体购自YEASEN公司;山羊抗兔IgG购自中杉金桥公司;Marker、质粒提取试剂盒和胶回收试剂盒购自天根生物有限公司;其他常规化学试剂均为进口或国产分析纯。
1.2 序列分析及预测
1.2.1 SARS-CoV-2 核衣壳蛋白核酸及氨基酸序列分析
从国家生物信息中心(https://bigd.big.ac.cn)和NCBI 数据库(https://www.ncbi.nlm.nih.gov)获得SARS-CoV-2 与其他冠状病毒的核衣壳区域核苷酸及其氨基酸序列,并分析预测分子质量、等电点及氨基酸组成。利用ClusterX进行序列比对分析同源区域及保守区。
1.2.2 SARS-CoV-2 核衣壳蛋白二级结构预测
应用EXPASY 服务器(https://www.expasy.org/resources)上的SOPMA、GOR 等方法分析预测核衣壳蛋白的二级结构[7-8],以及PROSCAN预测蛋白的修饰位点,SignalP预测蛋白的信号肽。
As the understanding of myocardial protection improved,the use of mildly hypertrophic left ventricles with short ischaemic times were also proposed with the caveat that there were no ECG changes[116].
1.2.3 SARS-CoV-2 核衣壳蛋白三级结构预测
采用Swiss-model(https://swissmodel.expasy.org)预测分析核衣壳蛋白的三级结构[9]。
1.2.4 SARS-CoV-2 核衣壳蛋白跨膜预测
采用TMHMM (http://www.cbs.dtu.dk/services/TMHMM)预测验证其是否存在跨膜结构。
1.3 核衣壳蛋白基因序列的克隆
根据基因设计引物,结合质粒载体pET-28 多克隆位点,将BamH I与SacI两个限制性酶切位点引入引物。引物:SV2NPF:5′-CGGGATCC ATGTCTGATAATGGACCCCA-3′;SV2NPR:5′-CGAGCTC GAGGCCTGAGTTGAGTCAG CAC-3′。PCR 条件:95 ℃预变性5 min; 94 ℃ 变性30 s,53 ℃退火30 s,72 ℃延伸1 min 20 s,30个循环;然后72 ℃再延伸10 min。
1.4 重组载体转化
将利用高保真酶扩增的PCR 产物双酶切胶回收后连入pET-28载体。转化BL21感受态细胞, 以获得重组菌pET-N。在含50 mg/L卡那霉素的LB 培养基上进行初步筛选,挑取阳性克隆的菌落测序鉴定。
1.5 重组蛋白的诱导表达与可溶性分析
挑取重组菌pET-N,接入含卡那霉素的LB 液体培养基,37 ℃ 振荡培养至OD600值为0.6~0.8时,取培养物作为诱导前样品;向其余培养物中加入IPTG诱导表达。收集诱导后的菌体,重悬于PBS 溶液,液氮反复冻融4 次,再冰上超声波处理(6 s × 9 s),直到菌液澄清。4 ℃离心后,取上清液和沉淀分别上样。SDS-PAGE 电泳检测重组载体的蛋白表达。Western Blot转移,以抗His-tag 多克隆抗体作为一抗,羊抗兔IgG 多克隆抗体作为二抗,进行Western分析。
1.6 表达产物的纯化
2 结果与分析
2.1 核衣壳蛋白氨基酸序列分析
SARS-CoV-2 N蛋白的氨基酸有419个氨基酸,相对分子质量约为45.6 ku,等电点10.07,是碱性蛋白,且亲水性强,疏水性弱。利用国家生物信息中心和NCBI 数据库公开数据,选取了10个全球各地代表性的SARS-CoV-2 N蛋白氨基酸序列,同时选取了10个其他代表性冠状病毒的N蛋白氨基酸序列,进行氨基酸序列比对,结果如图1所示。分析发现各地SARS-CoV-2 N蛋白氨基酸序列几乎没有变异,但SARS-CoV-2 N蛋白氨基酸序列与其他冠状病毒的N蛋白间存在一定变异,特别是N-端和C-端。结合三级结构预测比对分析发现N蛋白序列存在2个保守区域Region1和Region2,而在这两个区域间的序列,SARS-CoV-2与其他冠状病毒仍存在较多变异。
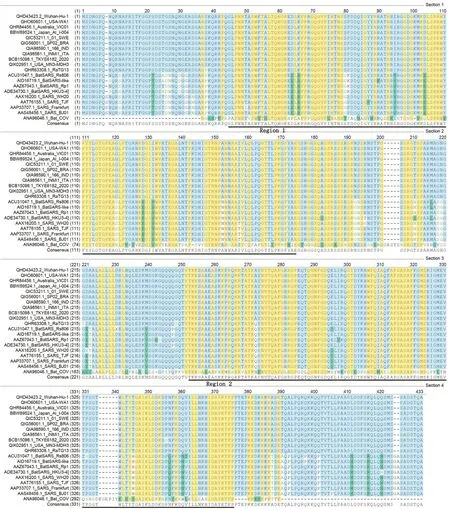
序列编号已标注在图中。图1 不同地区SARS-CoV-2 N蛋白氨基酸序列与其他β冠状病毒的同源性比较Figure 1 Comparison of amino acid sequence of SARS-CoV-2 N protein with other β-coronaviruses in different regions
2.2 核衣壳蛋白的修饰位点预测
翻译后修饰是蛋白质能够发挥作用的重要过程,通过PROSCAN预测SARS-CoV-2 核衣壳蛋白的修饰位点。发现其氨基酸序列中有3个N-糖基化位点(N-glycosylation site),1个cAMP-和 cGMP-依赖的蛋白激酶磷酸化位点(cAMP-and cGMP-dependent protein kinase phosphorylation site),10个蛋白激酶C磷酸化位点(protein kinase C phosphorylation site),6个酪蛋白激酶II磷酸化位点(casein kinase II phosphorylation site),12个N-酰化位点(N-myristoylation site),1个酰胺化位点(amidation site),见表1。蛋白激酶C磷酸化位点特征序列是[ST]-x-[RK],C-端的碱性氨基酸残基R或K可以很大程度上提高磷酸化反应的Vmax和Km。同时,体内的蛋白激酶C可以让氨基酸Thr或Ser磷酸化,从而通过氨基酸的磷酸化调节蛋白质的活性[10]。分析发现所有位点中,共有17个蛋白激酶磷酸化位点,排在第一位。蛋白激酶磷酸化位点的存在,支持病毒RNA在转录过程中需要磷酸化活化。
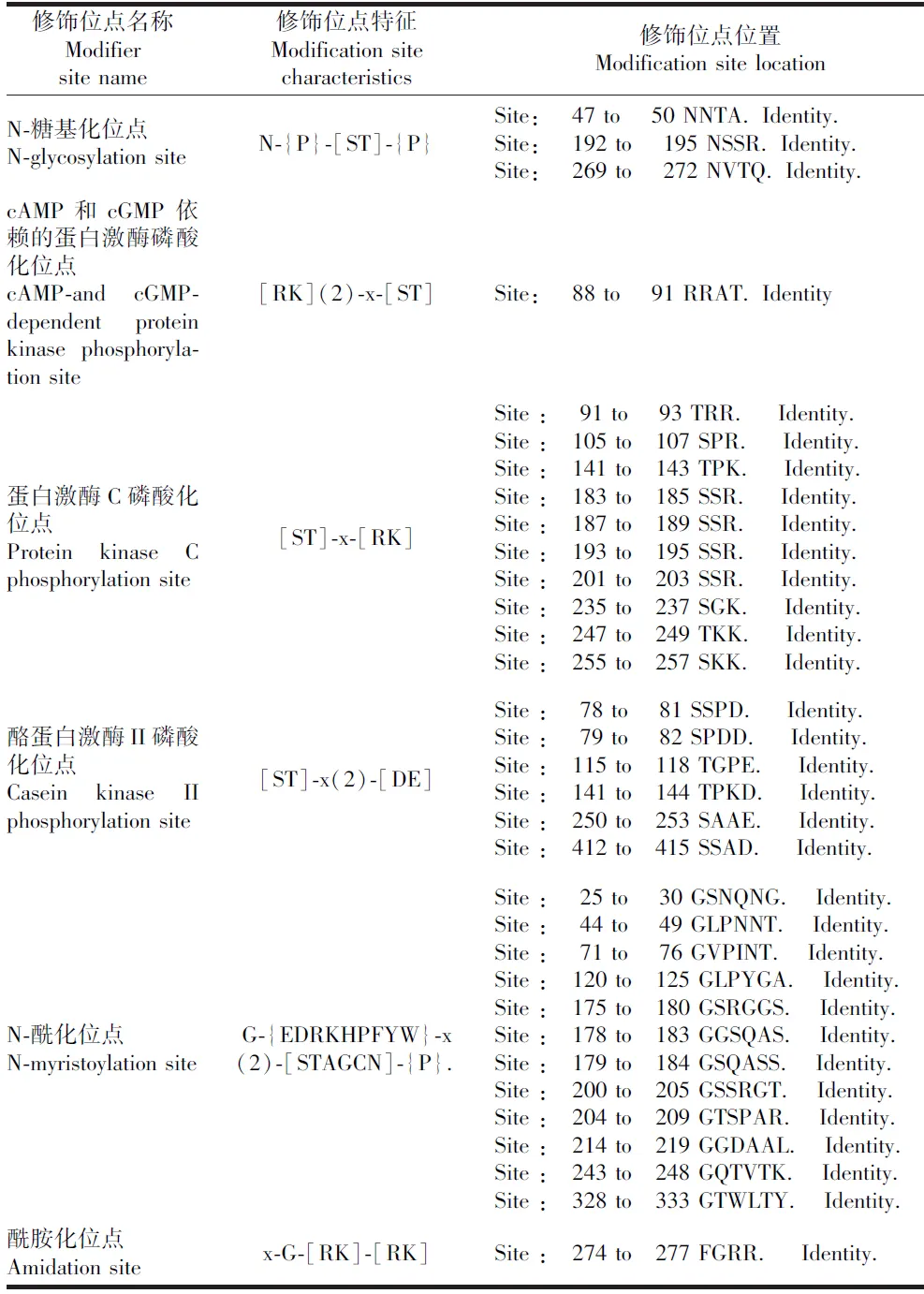
表1 SARS-CoV-2核衣壳蛋白的修饰位点的预测
2.3 核衣壳蛋白的结构预测
应用SOPMA、GOR分析工具预测SARS-CoV-2 核衣壳蛋白的二级结构(图 2)。2 种方法对SARS-CoV-2 N蛋白的二级结构预测有较好的一致性,都显示其二级结构中的柔性区域以无规卷曲为主,少见β-转角(表2)。
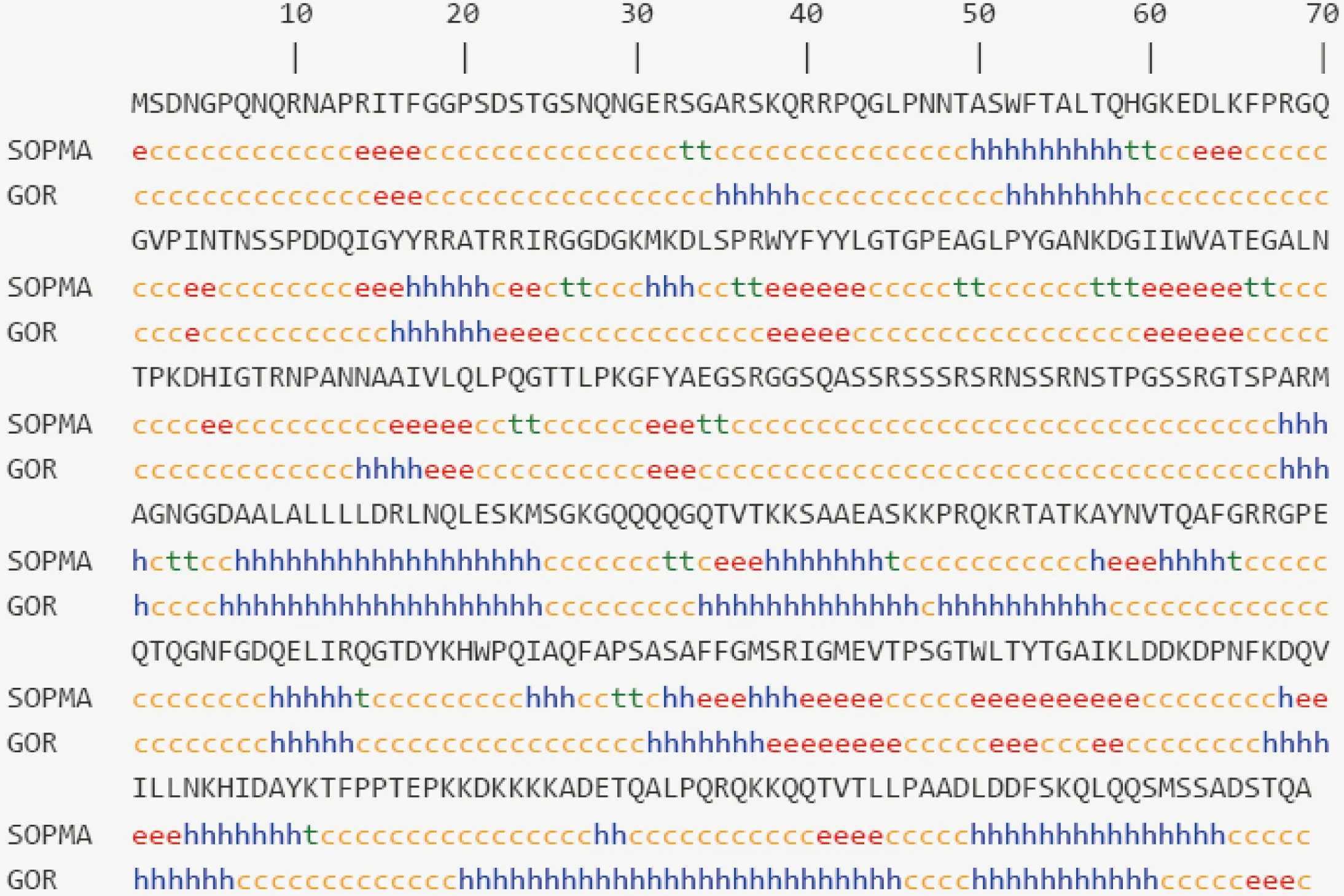
SOPMA、GOR 为不同的预测方法;h:α-螺旋;e:β-片层;c:无规卷曲;t:β-转角。图2 SARS-CoV-2 核衣壳蛋白二级结构预测Figure 2 Prediction of secondary structure of SARS-CoV-2 N protein
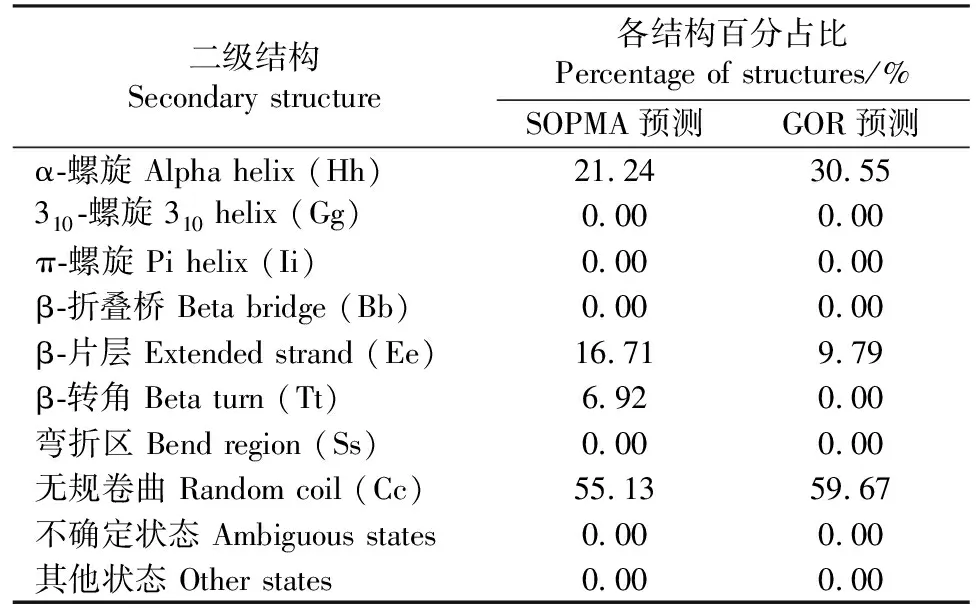
表2 SARS-CoV-2 核衣壳蛋白二级结构百分占比
应用Swiss-model分析工具预测SARS-CoV-2 核衣壳蛋白的三级结构。通过比对蛋白质数据库,发现其满足同源建模条件,模拟三级结构如图3所示。同时结合序列分析,发现其存在2段同源性高达90%以上的同源保守区域(图1)。
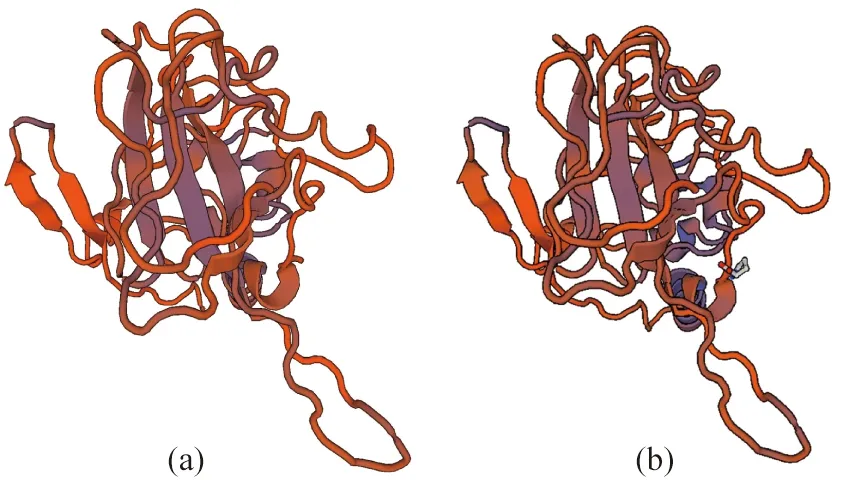
(a)为核衣壳蛋白的三维结构;(b)为引入载体His标签序列的核衣壳蛋白的三维结构。
2.4 核衣壳蛋白跨膜区预测
经TMHMM预测分析,SARS-CoV-2 N蛋白无跨膜结构(图4);而SignalP分析发现其无信号肽序列,其特征符合冠状病毒核衣壳蛋白的主要特征。
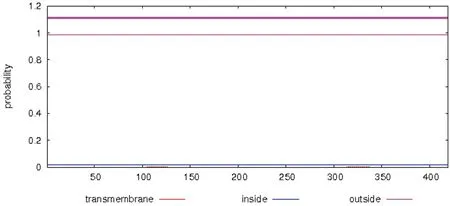
图4 TMHMM 预测SARS-CoV-2 核衣壳蛋白分析
2.5 核衣壳蛋白原核表达载体构建及表达
以经过大肠杆菌密码子优化的合成核衣壳蛋白基因为模板,利用设计的带BamH I 和SacI酶切位点的特异性引物进行PCR扩增,并胶回收获得大量目的片段。将目的片段与pET-28载体分别经BamH I 和SacI 双酶切,然后连接连入载体,构建重组原核表达载体pET-N。将连接产物转化大肠杆菌BL21感受态,挑选阳性克隆,接入LB液体培养基振荡培养,取样通过测序验证序列一致性后得到pET-N重组大肠杆菌。
pET-N重组大肠杆菌接入含相应抗生素的LB液体培养基中,经37 ℃振荡培养至OD600值为0.6~0.8时,取培养物作为诱导前样品;然后加入 IPTG至浓度1.0 mmol/L进行诱导。诱导培养6 h 后,收集菌体,并将样品进行12% SDS-PAGE 电泳。电泳后,蛋白胶进行扫描分析蛋白Marker 和目的蛋白迁移率Mr,并根据 lgMw-Mr 的线性关系计算目的蛋白分子质量。分析显示,在分子质量约50 ku处出现蛋白条带,该蛋白与带His 标签的重组蛋白理论大小相符;同时目的蛋白表达量达菌体总蛋白的15%以上(图5)。
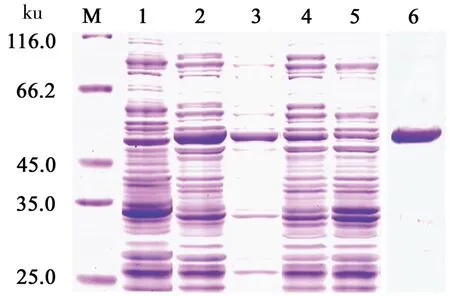
1:空载体诱导对照;2:诱导重组菌;3:超声裂解后包涵体;4:超声裂解后相应可溶性蛋白;5:未诱导重组菌对照;6:纯化的目的蛋白。
2.6 重组蛋白Western检测与可溶性分析及纯化
在重组表达设计时,为了便于重组蛋白的纯化及鉴定,引入了载体上带有的His 标签。以兔抗His-tag 多克隆抗体为一抗,羊抗兔IgG抗体为二抗,进行核衣壳重组蛋白的Western Blot 分析。结果显示,在约50 ku处出现了特异性条带,与预期结果相吻合,表明该重组蛋白为目的蛋白SARS-CoV-2 N蛋白(图6)。
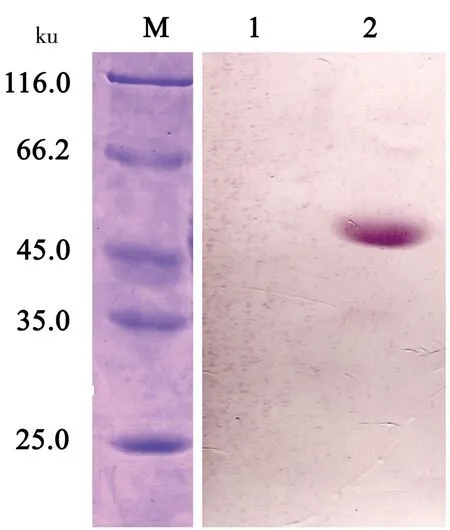
M:蛋白质Maker;1:未诱导;2:诱导重组蛋白。
将诱导后收集的菌体进行超声波破碎,离心后分别取上清液和沉淀作为样品进行SDS-PAGE电泳,结果发现上清液与沉淀中都含有目的条带,且包涵体中目的蛋白较多。由此表明,所表达的重组蛋白存在的包涵体可能与诱导条件有关,适当降低IPTG终浓度可以减少目的蛋白包涵体的产生(图5)。
通过对pET-N重组表达菌的振荡培养,IPTG诱导处理,收集菌体,并进行超声波破碎及包涵体溶解;然后利用目的蛋白C末端带有的His标签,进行Ni-NTA柱亲和层析,收集洗脱峰,得到纯化的融合蛋白。12% SDS-PAGE 电泳检测分析表明,通过Ni-NTA 柱洗脱得到的样品,经复性、透析除盐后,可检测到单一的蛋白电泳条带,因此获得了较纯的融合蛋白,纯度可以达到90%。通过该重组蛋白,利用医疗机构已有的ELISA检测基础,可开展SARS-CoV-2感染者血清中理论上存在的IgG或IgM抗体检测,从而辅助补充核酸等检测的不足。同时,利用核衣壳蛋白的免疫原性,结合胶体金等方式,可开发SARS-CoV-2抗体检测试剂盒等。
3 讨论与结论
全基因组测序结果提示,SARS-CoV-2 与SARS CoV 基因组序列同源性较高,说明两者的结构和功能有一定的相似性[4,11]。本研究通过氨基酸同源比对分析,也发现SARS-CoV-2与SARS CoV的核衣壳蛋白(N 蛋白)氨基酸序列同源性较高,具有两段同源性很高的保守区域,但在N端和C端差异较为明显(图1)。
核衣壳蛋白是冠状病毒中一种与RNA相关的重要结构蛋白,一般位于病毒的核心,呈长螺旋核壳体,与病毒RNA结合,参与病毒包装过程[12]。对不同地区提交的SARS-CoV-2基因组分析,推测N蛋白具有419 aa,分子质量大小约为45.6 ku,位于3′-端。预测显示其等电点高达10.07,是典型的碱性蛋白;同时其中性亲水性最强,氨基酸占比达44%,疏水性较弱,占比仅33%;与SARS CoV的N蛋白亲疏水性有一定差异。SARS-CoV-2 N蛋白序列分析显示,其177~207的序列存在多个SRXXX的特征序列,其可能是与RNA结合的位点[13],同时在SARS-CoV N蛋白序列的相应位置也发现具有该SRXXX特征序列;因此,推测177~207序列区域可能是SARS-CoV-2 N蛋白的RNA结合区域的部分。此外,SARS-CoV N蛋白位点分析发现在373~390蛋白序列区存在核转移信号,但SARS-CoV-2 N蛋白序列在相应区域与SARS-CoV存在多个氨基酸变异,没有该核转移信号基序。而SARS-CoV-2 N蛋白序列中存在大量蛋白激酶磷酸化位点;磷酸化作为一种分子开关,可以改变RNA转录与剪接凝聚物(condensates)与蛋白复合物的亲和力;这揭示SARS-CoV-2 N蛋白在病毒RNA的转录上可能存在开关功能[14]。
利用全病毒抗原进行诊断或试剂盒开发需要PⅢ级实验室的支撑,成本高且易造成环境污染。因此,重组表达具有免疫原性重组蛋白是更好的选择。大肠杆菌是一种最广泛的原核表达系统,其表达目的蛋白,具有快捷、经济、高效等诸多优点。本研究通过构建SARS-CoV-2 N蛋白的重组载体,重组融合蛋白在大肠杆菌中得到高效表达,但目的蛋白中的大部分以包涵体形式存在。虽然外源蛋白的表达容易形成无活性的包涵体是原核表达系统的不足[15],但通过适当降低温度和IPTG浓度等可以减少包涵体的形成。而且,以包涵体形式表达的蛋白也容易纯化,同时不经复性也可作包被抗原来检测抗体,这在单纯的免疫反应检测上更具高效性。而冠状病毒N蛋白的相关研究均揭示N蛋白具有很强的免疫原性[16-17]。在SARS期间,针对其N蛋白与患者体内血清的免疫原性研究已表明N蛋白对SARS-CoV诊断试剂的研制具有很高的价值[16],这对SARS-CoV-2病毒N蛋白的免疫原性及相关开发提供有力参考。虽然目前针对SARS-CoV-2 感染的免疫反应研究很少,仅有研究提到COVID-19 患者的N蛋白特异性抗体反应[4],这反映SARS-CoV-2病毒的N蛋白参与了机体的体液免疫。因此,本研究构建的SARS-CoV-2病毒N蛋白的重组表达蛋白可进行COVID-19的临床检测;同时本研究也为SARS-CoV-2 抗原抗体检测试剂盒开发以及后续的SARS-CoV-2 基因组选择性包装等研究提供了技术支撑。
