42Sp50/eEF1a在正常和gsdf缺失型青鳉性腺中的表达差异
2021-08-24武小雯张新亭常宇阳汪丝雨陈良标关桂君
武小雯,张新亭,常宇阳,汪丝雨,陈良标,关桂君
(1. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306; 2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306; 3. 上海海洋大学 水产科学国家实验教学示范中心, 上海 201306)
脊椎动物的原始生殖细胞(Primordial germ cell,PGC),从未分化的I型到进入雌雄各异的II型分裂活跃期,最终发育成雌雄配子的分子机制仍然不明[1]。青鳉(Oryziaslatipes)Y染色体存在雄性决定基因dmy[2-3]能直接调控体细胞衍生因子(Gonadal soma derived factor,gsdf),一种转化生长因子β(Transforming growth factor-β,TGF-β)超家族成员,开启/关闭青鳉雄性配子发生和发育[4-5]。敲除gsdf后产生gsdf-/-XY卵巢[5],且伴有大量发育停滞的初级卵母细胞[6]。研究发现gsdf-/-XY的青鳉卵巢中有异质型生殖细胞的囊性分裂簇[7],并观察到组蛋白三甲基化H3K27me3表达阳性和阴性两种粗线期生殖细胞,即非姐妹染色体DNA重组时或之前已具有雌雄分化特征[7]。小鼠H3K27me3是胚胎期生殖细胞进入雌性分化和减数分裂的标记物之一,并在X-染色体失活和染色体重组中起重要调控作用[8-9],因此推测gsdf可能具有选择性抑制XY型生殖细胞雌性发育的功能。
蛋白组学比对分析结果显示,真核翻译延伸因子1(Eukaryotic translation elongation factor 1a,eEF1a)家族中的卵巢型基因42Sp50在gsdf-/-卵巢中的表达显著升高[7]。eEF1a能够结合转运 tRNA 到核糖体[10],并能够与其他蛋白质结合形成复合体发挥作用[11]。青鳉42Sp50是青鳉胚胎期性腺雌性分化的最早标志物之一[12],参与卵细胞生成和发育的整个过程[13]。非洲爪蟾(Xenopuslaevis)[14]、罗非鱼(Oreochromisniloticus)[15]的研究结果显示42Sp50同卵母细胞发育必需的雌性因子合成和代谢,雌激素代谢的维持和降解等密切相关。
为研究42Sp50和eEF1a在雌雄配子发育中的作用,本研究在蛋白组学比对分析的基础上,用实时定量qPCR和细胞免疫荧光技术,比较并分析了正常和gsdf缺失性腺eEF1a和42Sp50在性分化和性成熟期性腺中的雌雄表达变化。
1 材料与方法
1.1 材料
青鳉野生型和gsdf-/-纯合子突变体,喂养在上海海洋大学青鳉研究鱼房循环水系统中。水环境为淡水,pH 7,水温维持在24 ℃~25 ℃,光周期为14 h光照和10 h黑暗。每日产卵,鱼卵在27 ℃±2 ℃环境下孵育,受精后10 ~ 12 d出壳。本试验所需的gsdf-/-青鳉通过合成锌指酶(ZFN)基因编辑技术获得[16]。
1.2 方法
1.2.1 青鳉eEF1a和42Sp50基因序列分析
从NCBI数据库查询青鳉eEF1a(ID 100049188)和eEF1a的卵巢异构体42Sp50(ID 100049338)的基因全长以及氨基酸序列,并对基因组进行线性分析,利用GSDS网站比较青鳉eEF1a和42Sp50外显子模式图,利用Vector NTI对比基因序列以及氨基酸序列,分析相似度。
1.2.2 RNA提取和实时定量PCR(qPCR)分析
提取组织总RNA(Trizol,LifeScience),并用oligo-dT(18)引物和AMV逆转录酶(Takara,中国)逆转录成第一链cDNA。表1中列出了扩增42Sp50 和β-actincDNA的引物。采用SYBR Fast qPCR mix(Takara,China),在7500型实时PCR系统(Applied Biosystems,Foster City,CA,美国)进行实时定量PCR(qPCR)分析。qPCR结果经过管家基因-肌动蛋白的qPCR结果(内参)标准定量,得到相对表达值。通过对各组相对表达值的t检验进行统计学分析,P<0.05时呈显著差异。数据来自2个独立实验的各3次以上重复试验结果的平均值±标准差。
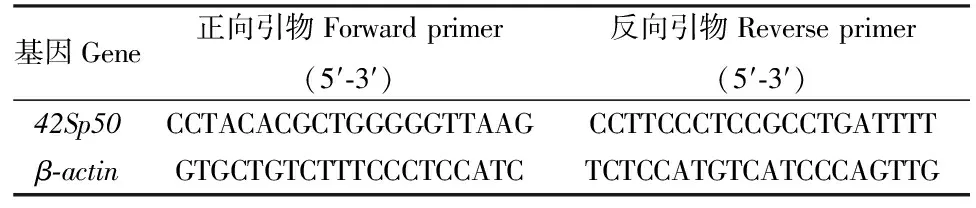
表1 qPCR分析的基因及其引物
1.2.3 蛋白质组学分析
采集3月龄性成熟成年个体(3 mon)的性腺3~5个,混合组成正常对照组(野生型XX卵巢和XY精巢),以及gsdf缺失XY卵巢组,以避免个体差异的影响。Label Free蛋白组学及质谱定量比对和数据的生物信息分析,参考文献[7]。用DAVID分类工具和已有的Oryziaslatipes的uniprot数据库进行了基因GO和KEGG通路的注释和富集分析。对4批实验数据交集中2 556个有效总蛋白进行聚类分析,依据Euclidean distance和complete linkage clustering算法对所有类别及其P值针对这些类别进行了过滤,这些类别中至少1个聚类的P<0.05。使用函数x=-log10(P值)转换此滤波后的P值矩阵。最后,对每个功能类别,将x值进行z转换。通过单向层次聚类(欧几里得距离,平均链接聚类)以z得分聚类[7, 16]。
1.2.4 免疫荧光分析
将性腺组织切块放入质量分数4%多聚甲醛(PFA)固定液中固定后,经常规的体积分数50%至100%酒精系列脱水处理,浸蜡包埋,再用组织切片仪(LeicaRM2265,德国)制备6 μm的石蜡切片。42 ℃烘片固定3 h后,经脱蜡和酒精梯度复水,体积分数0.1%曲拉通-100(生工,中国)增强细胞通透性,用体积分数为5%的羊血清(生工,中国)进行非特异性抗原封闭处理(室温避光湿盒中1 h)后,用抗人EEF1A和H3K27me3作为一抗(1∶ 200封闭液稀释)覆盖整个组织并4 ℃孵育过夜。青鳉和人的EEF1A的氨基酸序列高度相似(92%),抗人H3K27me3抗体的特异性在文献[7]中已讨论,均可适用于青鳉。次日分别进行二抗(1∶ 1 000封闭液稀释)孵育(抗体详细信息参见表2);用TSA TM-Plus TMR/Fluorescein System进行荧光信号放大增强(PerkinElmer,德国);用DAPI复染细胞核(2-(4-Amidinophenyl)-6-indolecarbamidine dihydrochloride,Sigma,美国);加FluoroshieldTM(Sigma,美国)荧光淬灭抑制剂,并用盖玻片和透明指甲油封片,在共聚焦激光扫描显微镜(DMi8 TCS SP8,德国徕卡)下观察荧光信号并拍摄图像。

表2 免疫组化实验所需抗体信息
2 结果与分析
2.1 青鳉eEF1a和42Sp50基因在功能域和核糖体结合部位上的差异分析
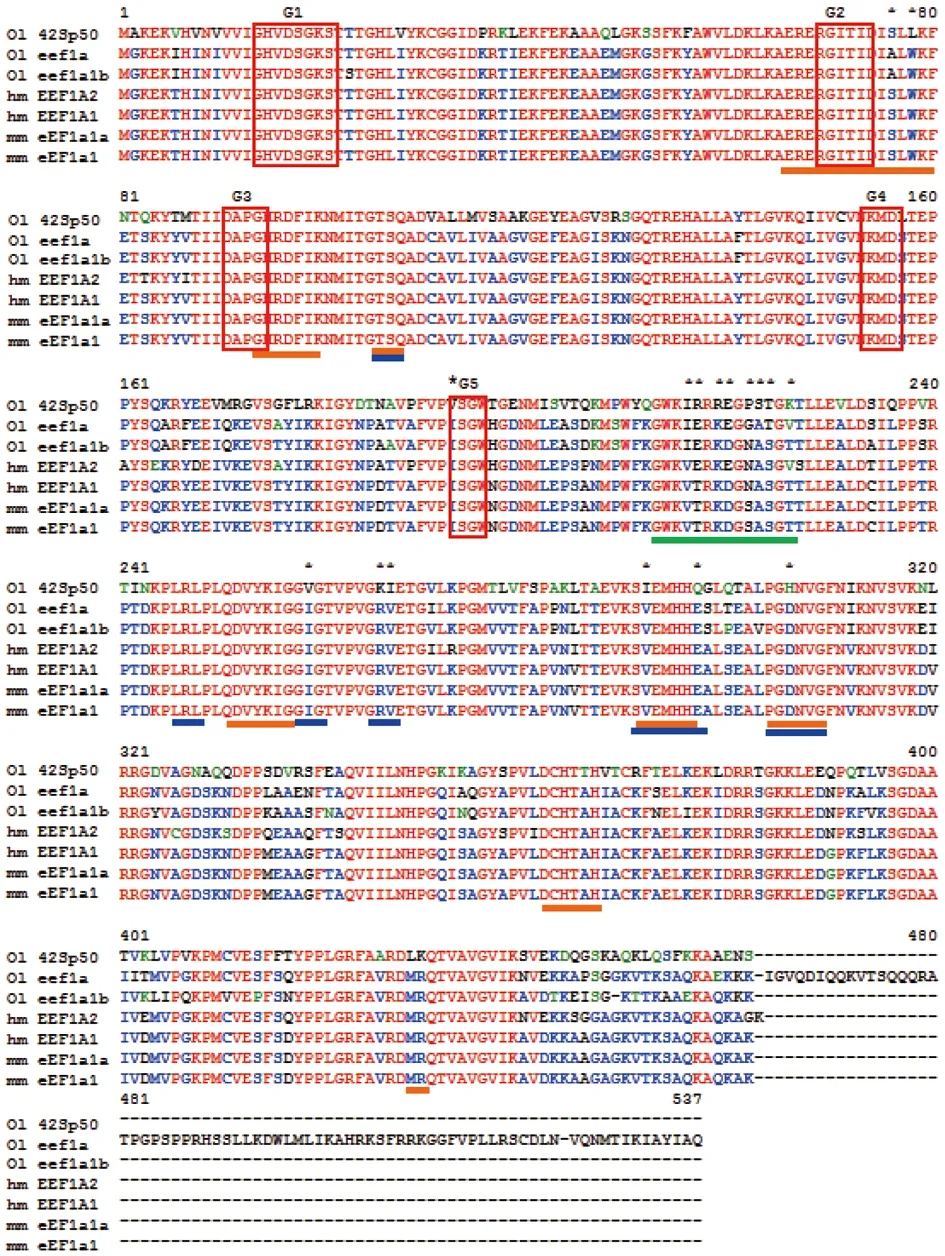
从NCBI数据库查询得到青鳉eEF1a和42Sp50序列分析都有7个外显子,每一个外显子的长度一样[图1(a)],基因结构保守。青鳉中的eEF1a有两种编码区cds序列,eEF1a(103)和eEF1a(102),这两种序列具有12个核酸碱基突变位点,但每个突变位点都是单个核苷酸的突变,其氨基酸的翻译不受影响,属于无义突变,两者最终都编码序列完全一样的462个氨基酸(图2)。42Sp50编码457个氨基酸,与eEF1a编码的氨基酸序列呈68.2%相似(图2)。
比较基因组的进化线形分析显示,青鳉42Sp50和eEF1a分别在15号和11号染色体上。42Sp50同ddx43、kcnq5、slc17a5和map3k4共线形连锁片段,存在于人6号染色体的对应区域,而eEF1a周围的slc9A1和kdm1b也可以在人6号染色体EEF1A的附近找到[图1(b)]。由此推断,42Sp50和eEF1a可能是经过硬骨鱼基因组扩增后产生的两个复制,同人6号染色体的EEF1A1附近的片段,起源于同一个共同祖先。
G结构域的核苷酸结合基序用红色框出; 蛋白结合集团(橙色下划线);氨基酰基结合囊(蓝色下划线);核糖体结合部位(绿色下划线);eEF1a和42Sp50的氨基酸差异(星号*)[18]。
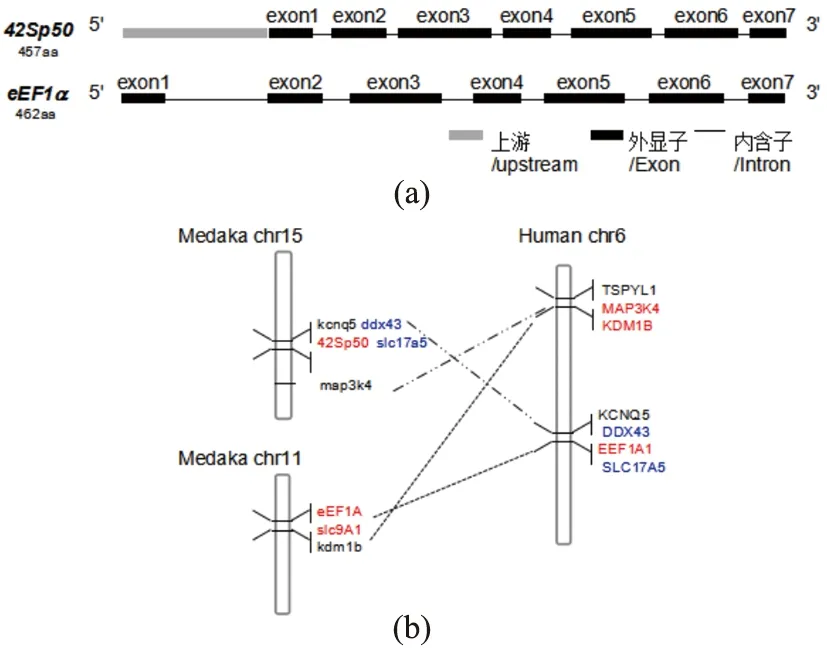
(a)青鳉中42Sp50和eEF1a外显子和内含子模式图的比较;(b)42Sp50和eEF1a基因组进化分析,青鳉42Sp50和eEF1a分别位于15号染色体和11号染色体上,对应于人类的6号染色体上。
对照eEF1a分子结构进化保守功能域的蛋白结合集团,氨基酰基结合囊,以及核糖体结合部位(绿色下划线),发现青鳉eEF1a和42Sp50的氨基酸差异(星号*表示),主要集中在GTP结合功能域(G1-G5)以外的部位(图2),在氨基酰基结合囊功能域和核糖体结合部位[17],尤其在以核糖体结合部位有显著差异。推测青鳉eEF1a和42Sp50可能各自选择性结合并运载特异氨基酰基至特异的核糖体上,具有不同分工。
2.2 青鳉42Sp50在XX和XY型gsdf 敲除卵巢中的转录差异表达
qPCR结果显示,42Sp50虽然在不同组织中有表达,但主要在卵巢中表达[图3(a)]。脑和眼睛可检测到微弱表达产物,雄性肝脏明显高于雌性,而卵巢的表达显著高于精巢。发现gsdf-/-XX卵巢和gsdf-/-XY卵巢中42Sp50的mRNA表达量呈显著差异[图3(b)],提示42Sp50的mRNA转录表达,可能同卵细胞自身的XX和XY性染色体相关联[图3(b)]。
蛋白组学比对分析显示,eEF1a蛋白产物在正常精巢和正常卵巢中无明显差异,在gsdf-/-卵巢中略有上升[图3(c)橙色Q9YIC0]。然而,正常卵巢的42Sp50蛋白表达量比正常精巢高250倍[图3(c)]。
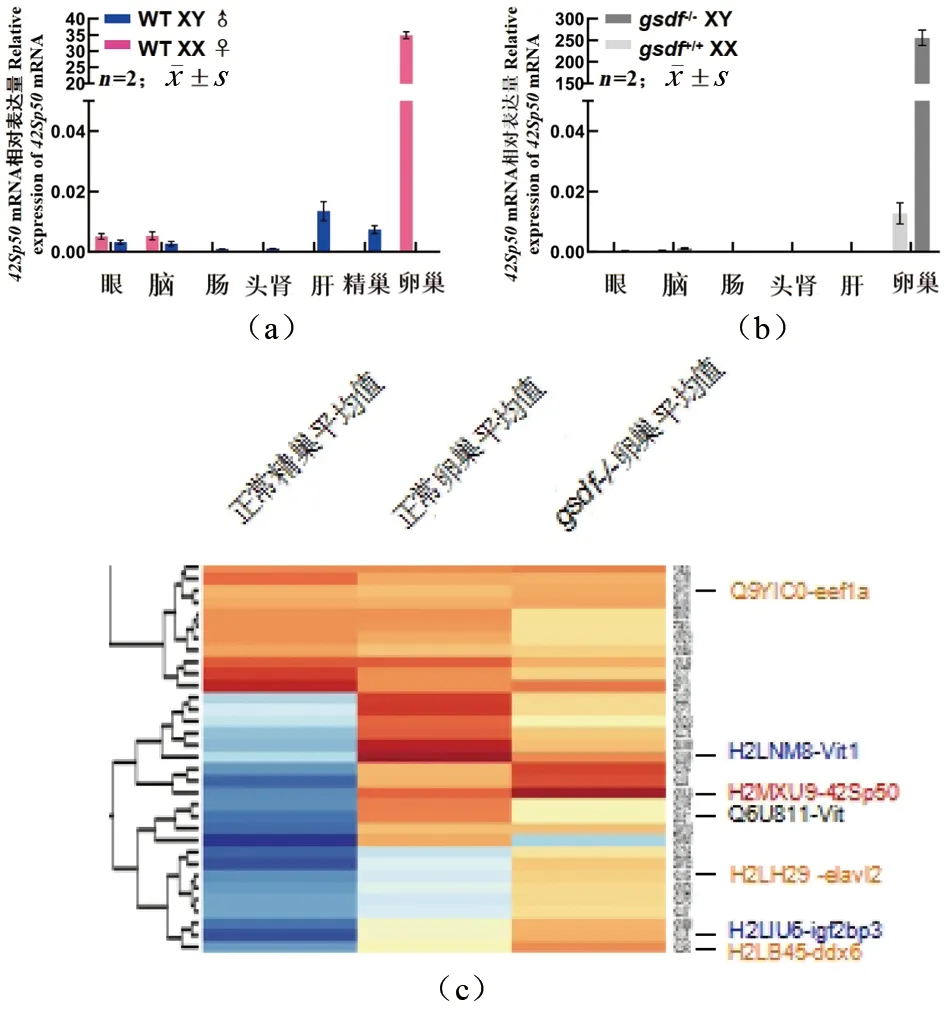
(a)42Sp50在正常青鳉各个组织中mRNA产物表达情况,主要在卵巢中表达,雄性精巢、肝脏、脑和眼也能检测到;(b)42Sp50在gsdf-/- 卵巢中mRNA产物的表达情况;(c)蛋白组学结果显示几种关键因子在gsdf-/-卵巢中的变化。
2.3 eEF1a在性腺分化过程中的差异表达
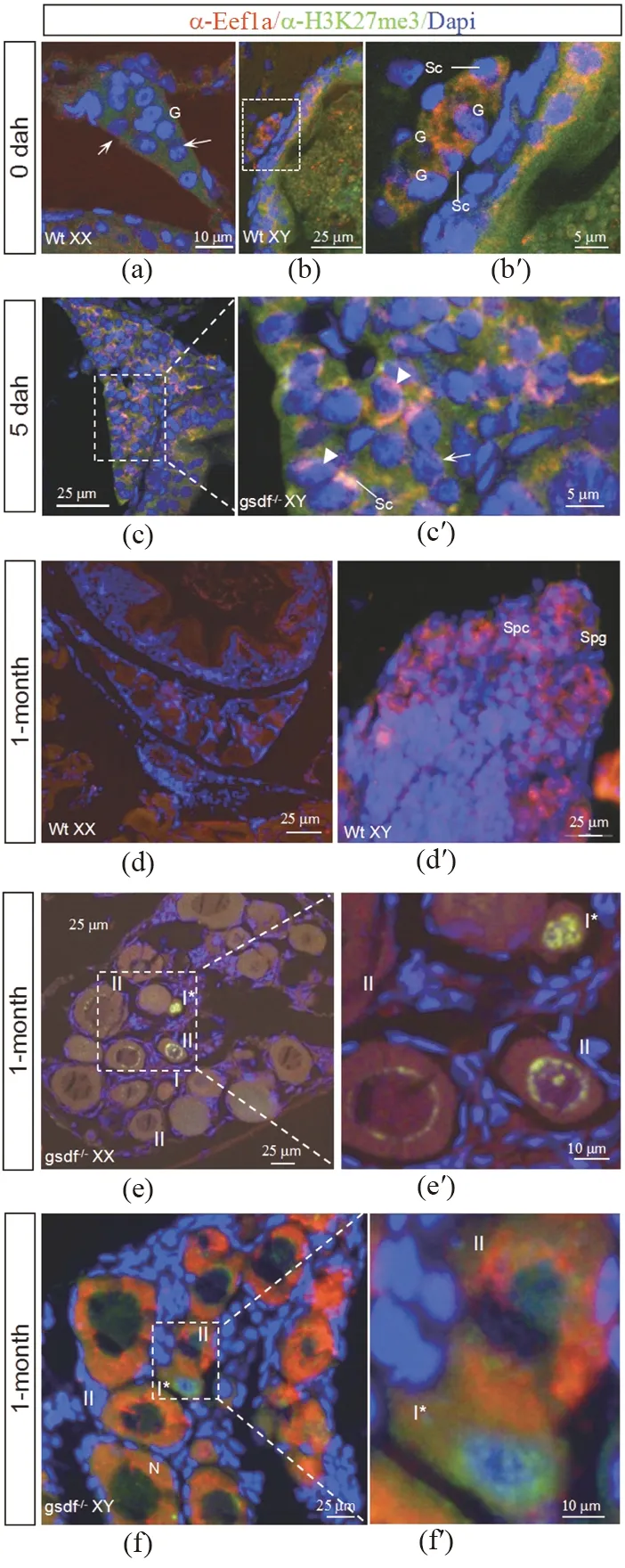
(a)XX正常卵巢发育0 dah时eEF1a/H3k27me3的表达情况,白色箭头指示进入减数分裂的生殖细胞;(b)和(b′)XY正常精巢发育0 d时eEF1a/H3k27me3的表达情况;(c)和(c′)gsdf-/-孵化5 d的卵巢(5dah)eEF1a/H3k27me3的表达情况,三角指示阳性生殖细胞,箭头指示阴性生殖细胞;(d)和(e)XX正常卵巢和XY正常精巢发育1 mon时 eEF1a/H3k27me3的表达情况;(f)和(f′)gsdf+/+卵巢发育1 mon时eEF1a/H3k27me3在I细胞和II细胞中的不同表达情况;(g)和(g′)gsdf-/-卵巢发育1-month时 eEF1a/H3k27me3的表达情况。 eEF1a:红色;h3k27me3:绿色;Dapi:蓝色;G:生殖细胞; Sc:体细胞; I:I期卵母细胞; II:II期卵母细胞。图4 eEF1a在XY性腺和XX性腺中的差异表达Figure 4 Differential expression of eEF1a between XX and XY gonad
在幼鱼孵化时,正常XX雌性性腺中的生殖细胞数目已明显多于XY雄性[图4(a)和(b)],有部分生殖细胞进入减数分裂偶线期[图4(a)]。用抗人EEF1A的抗体几乎检测不到免疫荧光信号,而正常XY精巢生殖细胞数目要比雌性的少,却有抗EEF1A的强信号[图4(b)和(b′)]。从细胞核形状上判断,生殖细胞(G)和周围的体细胞(Sc)中都能监测到抗EEF1A信号[图4(b)和(b′)]。孵化后5 d(5 dah)gsdf-/-XY卵巢中生殖细胞的数量明显多于正常XY雄性和XX雌性[图4(c)和(c′)]。生殖细胞和周围体细胞都能检测到抗EEF1A的荧光信号,荧光信号阳性和阴性生殖细胞并存[图4(c)和(c′),三角和箭头所示]。在1 month龄正常XX卵母细胞中检测到微弱信号的抗EEF1A红色信号[图4(d)],这种信号在正常XY精巢中的精原细胞和精母细胞也能检测到[图4(e)]。研究发现1-month龄gsdf-/-XY卵巢中抗EEF1A信号较gsdf-/-XX型强[图4(f)和(g)],同mRNA转录相对定量分析的qPCR结果一致。gsdf-/-XX卵母细胞中有大量抗EEF1A(红色)和抗H3k27me3(绿色)共表达蛋白颗粒,双重信号叠加而呈黄色,这些蛋白颗粒在卵细胞发育中随染色体动态变化,由核内向核周转移至核膜[图4(f′)];在gsdf-/-XY卵细胞中没有明显的黄色颗粒,反映出EEF1A和H3k27me3共表达蛋白颗粒在XX型和XY型卵细胞中有明显的量差[图4(g)]。XY型初级卵母细胞中抗EEF1A红色信号只在细胞质中,同细胞核的抗H3K27me3绿色信号不重叠[图4(g′)]。这些观察结果显示,eEF1a和H3k27me3的表达量和聚集分布在gsdf-/-XX和gsdf-/-XY初级卵母细胞中呈显著差异。
3 讨论与结论
在青鳉中发现了42Sp50在gsdf缺失XY型卵细胞中的转录表达,显著高于正常XX卵细胞[图3(b)]。免疫荧光结果亦显示在卵细胞发育过程中,H3K27me3和eEF1a蛋白的共表达在XX型和XY型之间有明显差异[图4(f′)和(g′)]。小鼠PGCs在胚胎性分化之前,要经历表观遗传的重编程过程,而H3K27me3和H3K4me2/3是体细胞/前驱细胞从休眠转向活跃的关键表观遗传调控因子,H3K27me3表达的减少或增加,受性染色体和X连锁的体细胞/前驱因子等的调控[18],这一机制可能在低等脊椎动物的青鳉中也进化保守存在。
在dmy体细胞性别决定因子启动性分化之前,青鳉XX和XY生殖细胞形态上相似,且具有两性可塑性。常染色体foxl3基因在性分化启动前的II型生殖细胞中表达,具有抑制XX生殖细胞进入雄性生精通路的功能系统[19]。本文发现H3K27me3和eEF1a蛋白在XX型和XY型卵细胞中的表达和分布,存在显著差异,可能是性染色体上的dmy性别决定因子和常染色上的foxl3共同调控的结果。我们归纳整理了青鳉性腺雌雄性分化的分子信号通路(图5),在dmy-gsdf雄性信号通路被阻断的XY生殖细胞中,H3K27me3无法正常完成对XY生殖细胞的核内重编程,并可能在foxl3或未知雌性因子的作用下,使部分生殖细胞进入雌性通路,形成XY型gsdf缺失卵巢中特有的雌雄生殖细胞并存的单囊簇[7]。gsdf虽不是雌雄配子发生的必需因子,但可能直接或间接地调控和影响着XX和XY生殖细胞进入雌性或雄性分化的未知关键因子,影响eEF1a和42Sp50的表达量变化,以及H3K27me3蛋白颗粒的核内至核膜的分布变化。这些变化是生殖细胞开启雌性或雄性配子发生的原因还是结果,有待进一步深入解析和确认。
综上所述,我们发现eEF1a蛋白表达量在正常成鱼的精巢和卵巢中差别不大,在正常卵巢和gsdf缺失卵巢中也变化不明显;但是42Sp50蛋白表达量呈显著雌雄性别差异表达,雄性非常微弱,在正常雌性卵巢中高表达。抗H3K27me3和EEF1a双色荧光免疫反应显示,正常XX和gsdf缺失的XY卵细胞有明显差异。这些结果为进一步研究脊椎动物雌雄配子发生和分化的分子机制,提供了新线索。
