毕赤酵母Sut2对甲醇代谢的调控研究
2021-08-24郑雅婷王鹏程杨艳坤白仲虎
郑雅婷,李 翔,王鹏程,杨艳坤,白仲虎
(江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122)
毕赤酵母(Pichiapastoris)是一种广泛应用于异源蛋白质生产的宿主[1],具有高密度生长和高蛋白质分泌能力等优点[2]。毕赤酵母高效表达外源蛋白的关键是甲醇代谢通路(methanol utilization pathway,MUT),该通路中醇氧化酶对其底物的亲和力很低,所以需要大量酶以维持细胞在甲醇上的生长,特别是第一种限速酶Aox1(Alcohol oxidase 1, 醇氧化酶1)[3-4]。Aox1约占总mRNA的5%,占可溶性蛋白的30%[2]。据报道,细胞生长在抑制碳源上(甘油等)时缺乏Aox1活性[5],且细胞中无法检测到Aox1的mRNA,所以这种严格的调控主要作用于转录水平[6-8]。
通过前期研究,发现PAS_chr1-4_0516(与酿酒酵母中的sterol uptake 2, 即Sut2基因同源)等基因的表达可积极响应碳源变化,并在甲醇中有更高的表达量[9]。据报道,Sut2是Zn2Cys6家族的潜在转录因子[10-11],推测在毕赤酵母中,该基因可能对甲醇代谢具有调控作用。有研究发现,酿酒酵母中Sut2在厌氧条件下与Sut1一起调节麦角固醇的摄取,并参与麦角固醇的生物合成[12],而毕赤酵母中不具有同源基因Sut1。据报道,麦角固醇是酵母细胞膜及过氧化物酶体膜的主要成分[13],毕赤酵母中麦角固醇的合成与转运机制尚不清楚。
为表征Sut2在毕赤酵母中的功能,在毕赤酵母中分别过表达和敲除Sut2,研究Sut2与MUT之间的相关性,通过添加甲醇及其代谢物来探究Sut2的诱导剂,并研究Sut2功能与麦角固醇的关系。
1 材料与方法
1.1 菌株、质粒和试剂
毕赤酵母GS115和载体pUC19、pMD19-T、pPICZ B均为本实验室保存。限制性内切酶和T4 DNA ligase均购自Thermo Fisher Scientific;2×PfuMasterMix、2×TaqMasterMix购自北京康为世纪生物科技有限公司;质粒小量试剂盒、PCR纯化试剂盒、胶回收试剂盒购自AXYGEN;DNA分子量Marker、反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser和荧光定量试剂盒SYBR®PremixExTaqTMII购自TaKaRa;Ampicillin购自上海生工;Zeocin购自美国Invitrogen公司;酵母浸出物、蛋白胨购自英国OXOID公司。文中所涉及的引物列于表1。
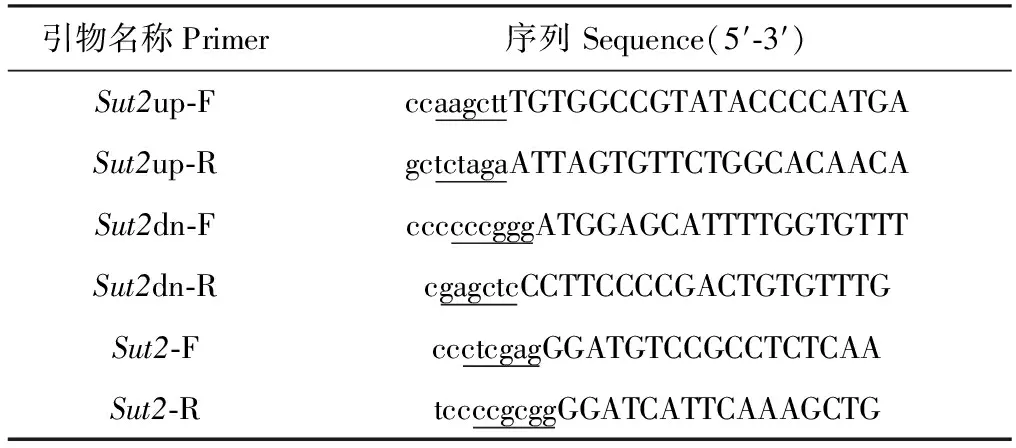
表1 本研究所用的引物序列
1.2 方法
1.2.1Sut2敲除菌株构建
用基因组DNA作模板,PCR扩增Sut2上游Sut2-up(0.6 kb)。并以质粒pMD19-T-GT1-del(实验室前期构建)作模板,PCR扩增Kan基因及其启动子和终止子(1 556 bp)。用相应的内切酶切Sut2-up和Kan,然后将产物与用Hind III/SmaI双酶切的pUC19载体连接,获得重组质粒pUC19-Sut2up-Kan。PCR扩增Sut2下游Sut2-down(0.6 kb),将SmaI/SacⅠ酶切的基因片段和pUC19-Sut2up-kan载体连接,得到质粒pUC19-Sut2-del。以pUC19-Sut2-del为模板,PCR扩增得到Sut2敲除片段,将其电转化GS115,以0.3 mg/mL G418筛选抗性转化子,流程如图1。
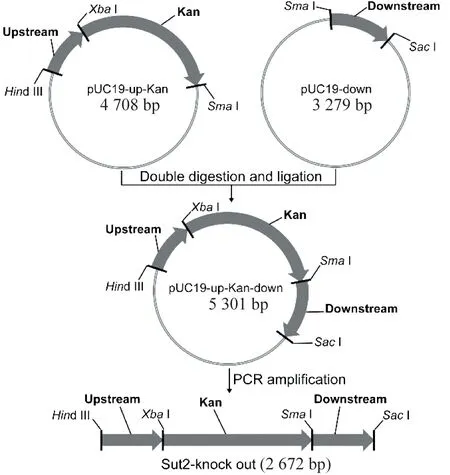
图1 Sut2敲除片段构建Figure 1 The construction of Sut2-knockout sequence
1.2.2Sut2过表达菌株构建
以GS115基因组DNA为模板,PCR扩增得到Sut2片段(1 kb)。再经EcoR I/XhoI双酶切,连接至载体pGAPZ B中,转化感受态DH5α,得到重组质粒pGAPZB-Sut2。AvrII单酶切线性化pGAPZB-Sut2,电转化GS115,获得Sut2过表达菌株GS115-Sut2,流程如图2。
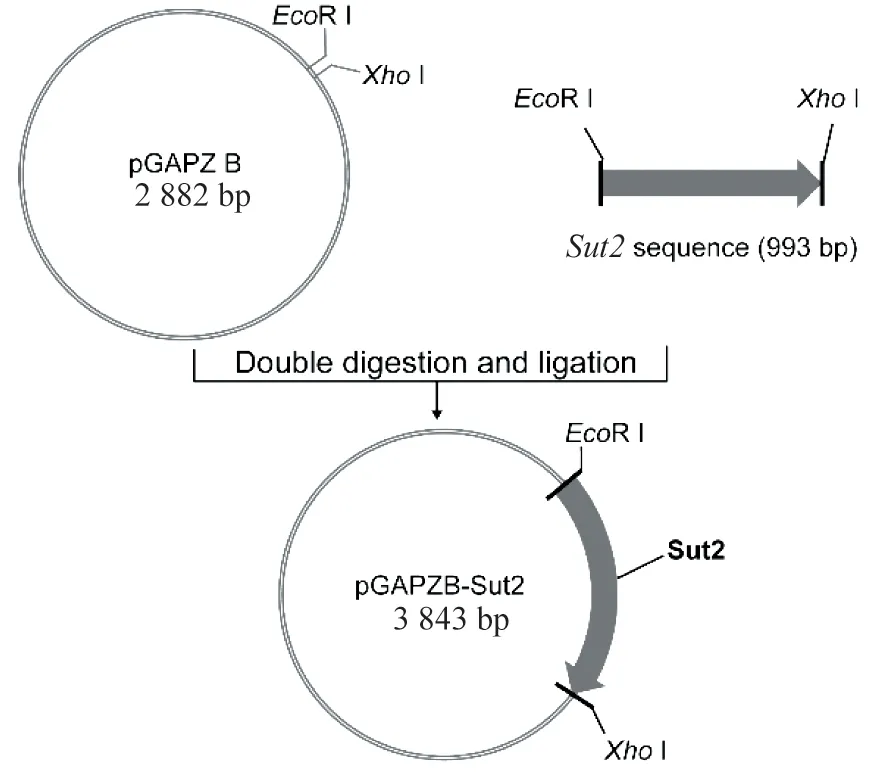
图2 Sut2过表达载体构建Figure 2 The construction of Sut2 overexpression plasmid
1.2.3 麦角固醇水平检测
YPD活化后的菌株以初始OD600为0.5转接基本培养基MM(1.34% YNB,0.004% histidine, 4×10-5% biotin,1% methanol)。对数末期取样,4 ℃、3 000 r/min离心5 min,上清液和菌体分开处理。上清液用甲醇稀释10倍,震荡10 min,翻转混匀5 min,离心后取200 μL以检测上清液中麦角固醇含量。菌体用双蒸水洗涤2次,然后使用冻干机将酵母细胞在-80 ℃下冷冻干燥,取10 mg悬浮于甲醇∶1-丙醇(体积比1∶1)溶液中,用Ultra Turrax匀浆仪(IKA, Staufen, Germany)匀浆5 min,离心后将上清液转移至样品瓶中以检测胞内麦角固醇含量。通过HPLC分析样品,使用SYMMETRY C18,4.6×250 mm柱(Waters,MA,USA),用流速为0.8 mL/min的甲醇作流动相,在30 ℃下进行检测。
1.2.4Aox1SDS-PAGE和酶活检测
将菌株接种于5 mL YPD (1% yeast extract, 2% peptone, 2% glucose)培养基中,30 ℃,230 r/min摇床培养过夜活化。离心收集菌体,以BMGY(10 g/L yeast extract, 20 g/L peptone, 3 g/L K2HPO4, 11.8 g/L KH2PO4, 13.4 g/L YNB, 4×10-4g/L biotin,2.5 mL/L glycerol)培养基重悬至OD600为0.2进行培养,22 h补加甲醇至终浓度为10 mL/L,培养45 h,检测10、22、35和45 h时菌株Aox1表达量。每个时间点取1 mL菌液,稀释至OD600为3.0,取1 mL菌液离心5 min后弃上清液;加入 0.5 mL细胞裂解液悬浮细胞,再加入0.3 g 425~600 μm玻璃珠振荡30 s,于冰上放置 1 min,重复10次;4 000 r/min离心5 min,取上清液进行SDS-PAGE实验,具体参见文献[14]。另取部分上清液,在酶标板中加入100 μL醇氧化酶检测溶液,加入上清液5 μL;再加3 μL甲醇,室温反应15~30 min,最后加20 μL 2 mol/L硫酸(含0.1 mol/L亚硫酸钠)终止反应,并于492 nm测量吸光度。
1.2.5 实时荧光定量PCR (RT-qPCR)
用GeneJet RNA纯化试剂盒(Thermo Fisher Scientific)的标准方法提取总RNA,按照HiScript II Q Select RT SuperMix for qPCR(诺唯赞,中国南京)标准方法进行反转录。将得到的cDNA按照ChanQ Universal SYBR qPCR Master Mix(诺唯赞,中国南京)标准方法进行荧光定量PCR。
2 结果与分析
2.1 GS115-ΔSut2、GS115-Sut2和GS115菌株中Aox1的转录与翻译水平检测
通过PCR分析Sut2敲除质粒,电泳结果见图3(a),与预期大小2.7 kb相符。用于Sut2过表达菌株构建的pGAPZ B和Sut2片段的双酶切结果见图3(b),与预期大小2.8 kb和1 kb相符。重组菌株的PCR鉴定结果见图3(c),与预期大小1.2 kb相符,且测序验证正确。
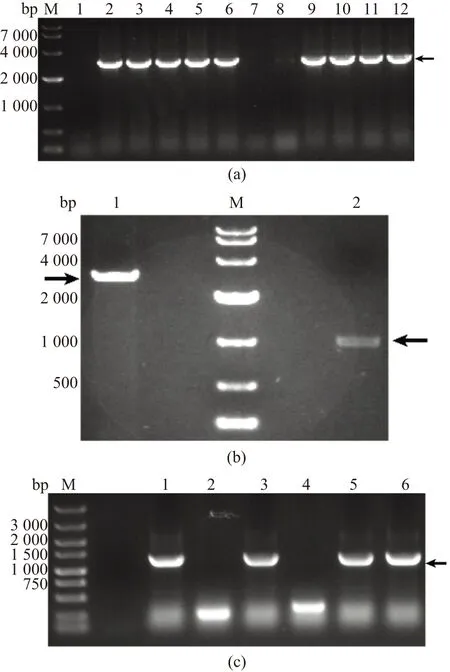
(a)M:DL10k Marker;1~12:Sut2敲除质粒PCR产物(2.7 kb)。(b)M: DL10k Marker;1:pGAPZ B双酶切(2.8 kb);2:Sut2双酶切(1 kb)。(c)M: DL5k Marker;1~6:Sut2过表达菌株基因组PCR产物(1.2 kb)。图3 Sut2敲除与过表达的PCR鉴定Figure 3 PCR results for knock-out and overexpression of Sut2
将GS115-ΔSut2、GS115-Sut2和GS115菌株活化后,用BMMY(10 g/L yeast extract, 20 g/L peptone, 3 g/L K2HPO4, 11.8 g/L KH2PO4, 13.4 g/L YNB, 4×10-4g/L biotin, 10 mL/L methanol)培养基进行培养,在对数末期取样,通过RT-qPCR检测Sut2和Aox1的转录水平。通过验证GS115-ΔSut2和GS115-Sut2,分别实现Sut2的敲除和过表达,见图4(a)。GS115-ΔSut2菌株中Aox1的转录水平比野生型低约22%,GS115-Sut2菌株的Aox1转录水平比野生型高约13%,见图4(b)。
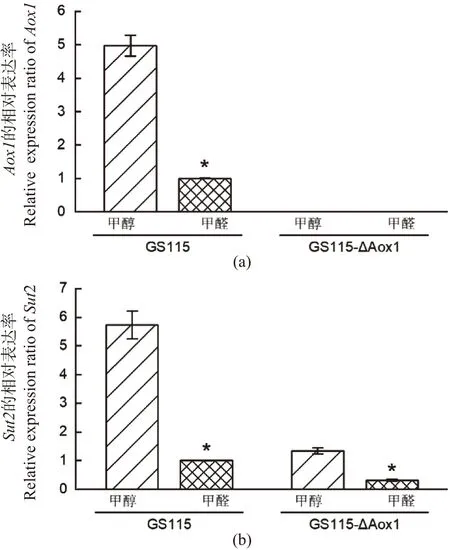
(a) Aox1的转录水平; (b) Sut2的转录水平(对照为甲醇中的GS115菌株,*为P<0.05)。图6 RT-qPCR 检测Aox1和Sut2在不同诱导剂条件下的表达Figure 6 Detection of Aox1 and Sut2 expression with different inducers by RT-qPCR
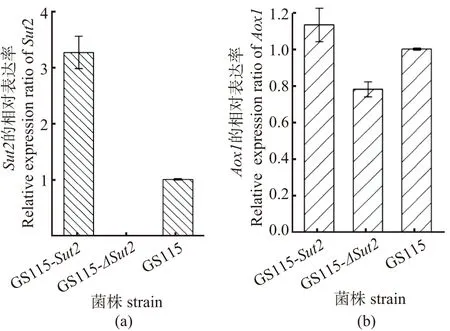
(a) Sut2的转录水平;(b) Aox1的转录水平。图4 RT-qPCR 检测Sut2和Aox1在不同菌株中的表达Figure 4 Detection of Sut2 and Aox1expression in different strains by RT-qPCR
检测GS115-ΔSut2、GS115-Sut2和GS115菌株中Aox1蛋白的表达量,结果发现:经甲醇诱导后,过表达Sut2菌株的Aox1酶活最高,缺陷型与野生型的Aox1酶活相近(图5)。以各菌株最高表达量为例(45 h),GS115-Sut2酶活较野生型高约17%,GS115-ΔSut2较野生型高约6%;而以甘油为唯一碳源时,各菌株的Aox1酶活相对较低,且无明显差异。
结合图4和图5可知:过表达Sut2可提高Aox1的转录与翻译水平;Sut2的敲除会导致Aox1转录水平的降低,而Aox1翻译水平无明显下降,这可能是翻译过程中存在的其他因素综合调控的结果。由此表明,Sut2可能对Aox1的转录水平存在一定程度的正调控。
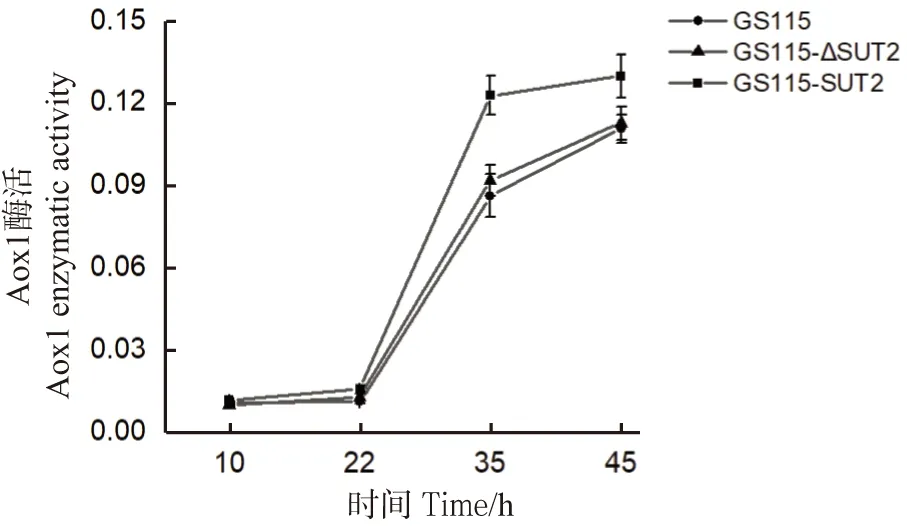
图5 不同菌株摇瓶培养不同时间取样检测Aox1酶活Figure 5 Enzyme activities of Aox1 fermentation in different strains at different time
2.2 不同碳源对Sut2表达的影响
P.pastorisAox1是MUT途径的首步酶和限速酶,主要作用是将甲醇氧化为甲醛以及过氧化氢,从而启动甲醇代谢过程[15]。为探究MUT途径中诱导Sut2表达的具体物质,将GS115和GS115-ΔAox1菌株(实验室前期构建,方法类似于GS115-ΔSut2的构建)活化后,以BMY(配方为上文所述的BMMY培养基不加甲醇)培养基加6 mmol/L甲醇或甲醛为碳源对其进行培养。检测Sut2和Aox1基因的转录水平,从而进一步确定Sut2表达的诱导剂。结果发现:在GS115和GS115-ΔAox1菌株中,碳源为甲醇时Sut2的转录水平比甲醛中分别高约5.7和4.2倍(图6)。
2.3 GS115-ΔSut2、GS115-Sut2和GS115菌株中麦角固醇含量检测
将GS115-ΔSut2、GS115-Sut2和GS115菌株活化后,用基本培养基进行培养,利用HPLC检测细胞内外麦角固醇的含量。如图7所示,随着Sut2表达量的提高,胞内麦角固醇含量具有5%~10%的提高,而胞外麦角固醇含量具有30%~40%的提高。
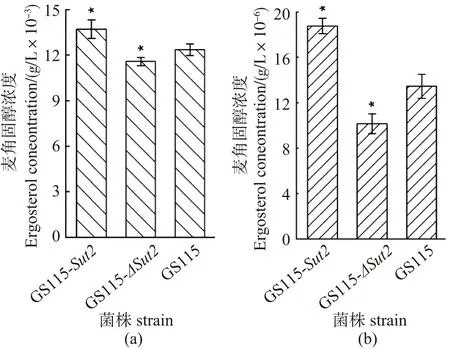
(a)胞内麦角固醇含量;(b)胞外麦角固醇含量(以GS115菌株为对照,*为P<0.05)。图7 HPLC检测细胞内外麦角固醇含量Figure 7 Detection of intracellular and extracellular ergosterol by HPLC
3 讨论与结论
基于毕赤酵母转录组数据[9]可推断,潜在转录因子Sut2可能参与了甲醇代谢通路,然而具体机制尚不清楚。据报道,ScSut1是Zn2Cys6锌指蛋白家族之一,其上调能促进有氧条件下外源甾醇的摄取和胞内甾醇的生物合成。研究表明,结构相关基因YPR009(Sut2)是Sut1的功能同系物[12]。
为研究Sut2是否对Aox1有调节作用,通过敲除和过表达Sut2,检测不同菌株中Aox1的转录和翻译水平。结果表明:Sut2对Aox1有一定程度的正调控作用,且这一调控很可能发生在转录水平。在甲醇及其代谢物对Sut2的诱导实验中发现,甲醇对GS115和GS115-ΔAox1菌株的诱导作用均显著高于甲醛,这可能是培养环境中甲醛的存在,使细胞不需要大量的醇氧化酶,从而导致Aox1和Sut2在甲醛中低表达。野生型菌株中Sut2与Aox1的转录水平变化非常相似,结合Aox1的表达受甲醇诱导可知,甲醇是Sut2表达的主要诱导剂。另一方面,通过麦角固醇检测实验发现,细胞内外麦角固醇含量与Sut2呈正相关。由于基本培养基中不含有麦角固醇,因此细胞内外的麦角固醇均来自菌体自身合成。由此可推测,毕赤酵母中Sut2可能参与调控麦角固醇的合成。据报道,麦角固醇是毕赤酵母过氧化物酶体膜上的重要组成成分,是过氧化物酶体增生所必需的结构原材料[16];而过氧化物酶体是甲醇代谢的主要场所,在甲醇为唯一碳源的时候,毕赤酵母中的过氧化物酶体会急剧增生,这是甲醇代谢的重要特征之一[2]。因此推测Sut2可能通过调控麦角固醇的合成来参与甲醇代谢,这一假设有待进一步在体内体外实验验证。
研究发现并初步鉴定毕赤酵母甲醇利用途径有关的新基因Sut2,它是一个潜在转录因子。Sut2的表达可以被甲醇(及其氧化过程)诱导,且在一定程度上正向调控Aox1的表达,其中的机制有待进一步研究。另外,发现Sut2基因的功能与麦角固醇合成的联系,这为解析甲醇代谢通路奠定了基础。
