发酵乳中沙门氏菌依赖解旋酶恒温基因扩增快速检测方法的建立
2021-08-10许苗苗史国华
王 赞,李 献,王 慧,许苗苗,张 捷,刘 帅,周 巍,2,*,史国华,*
(1.河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050200;2.河北师范大学生命科学学院,河北 石家庄 050000)
发酵乳作为人们日常食用的一种乳制品,因其营养丰富、钙含量高,添加各种水果、果酱后适口性好,乳糖不耐受的人群也可以食用,得到各年龄段消费者的喜爱[1]。发酵乳中含有大量益生菌,能有效改善肠胃胀气,对促进消化有显著作用。同时发酵乳还是人体较好的钙元素来源,长期适量食用发酵乳对减少心血管疾病、降低胆固醇有一定的功效。
目前我国市面上销售的发酵乳主要有普通发酵乳、风味型发酵乳和功能型发酵乳。发酵乳一般由保加利亚乳杆菌、嗜热链球菌发酵制成,经过对发酵菌株多年的研究,人们发现更多优秀发酵菌种,其发酵的酸乳口感更加细腻,如双歧杆菌、嗜酸乳杆菌等益生菌[2]。因发酵乳含有丰富的益生菌,其运输贮藏过程对温度要求较为严格,4 ℃左右的低温条件下益生菌存活时间较长。在实际情况中,贮藏条件、微生物污染等影响发酵乳的质量和货架期,微生物中有害菌的增殖是引起发酵乳变质的重要原因。已发生过沙门氏菌和肉毒杆菌污染酸乳,造成食物中毒的事件[3-4]。
沙门氏菌作为酸乳中的一种有害微生物,感染后潜伏期为1~3 周不等,最长潜伏期可达2 个月,症状主要为食欲不振、高热、嗜睡、头疼、腹痛、腹泻等,病程会持续2~4 周,感染后死亡率可高达10%[5]。沙门氏菌是各国和国际组织食品安全标准中普遍提出限量要求的致病菌[6],快速、精准、省时、省力的检测更符合实际生产要求[7-9]。
国内各类检测机构对于食品中污染菌及致病菌的检测方法主要有国标方法、分子生物学方法和基于免疫学的检测方法[10-13]。国标方法需要将目标微生物进行各种染色实验及生化实验,方法较为可靠,具有精准、直观、假阳性低的特点,缺点是增菌、分离、纯化等步骤时间较长,无法满足快速检测的需求。分子生物学方法自发明以来,因其灵敏度高、特异性好的特点应用非常广泛[11],但其扩增效果受多种因素影响,常引起非特异性扩增,且所需仪器价格昂贵,在基层不能得到广泛推广[14]。依赖解旋酶恒温基因扩增(helicase-dependent isothermal DNA amplification,HDA)快速检测方法是以分子生物学方法为基础发展起来的一种新的基因扩增方法,和其他方法相比,HDA法更简单有效[15]。HDA快速检测法主要是在恒温条件下,由解旋酶打开DNA双链结构,同时单链DNA结合蛋白(single-stranded DNA binding protein,SSB)与形成的单链DNA相结合,使解开的单链保持稳定,为引物提供结合模板,然后由DNA聚合酶催化合成互补链,解旋酶再次将新合成的双链解开形成单链,新形成的单链成为模板,进入下一轮循环扩增,如此反复循环,靶序列可以实现指数增长[16-17]。HDA法的特异性反应较强,所需仪器设备较为基础,可在短时间内完成实验[18],适合基层快速、现场检测。
本研究将HDA方法应用到发酵乳中沙门氏菌的检测中,利用该方法自身特点,结合乳制品生产企业对于基层快速、准确检测的需求,开发出满足基层检测机构现场检测的HDA检测体系,也为HDA技术在其他污染菌和致病菌检测中的应用推广提供参考。
1 材料与方法
1.1 材料与试剂
200 批次发酵乳 当地超市及市场。实验用菌株均为本实验室保存菌株,如表1所示。

表1 实验用菌株Table 1 Strains used in this study
脱氧核糖核苷三磷酸、Tris-HAc、腺嘌呤核苷三磷酸、DNA Marker、高效液相色谱级引物 生工生物工程(上海)有限公司;多胺、Phi29嗜温聚合酶、牛血清白蛋白(bovine serum albumin,BSA)、RecA蛋白、海藻糖、二硫苏糖醇、Bst聚合酶、Lysis Buffer、蛋白酶K美国Sigma公司;T4 gp32蛋白、UvrD解旋酶 新西兰Biolabs公司;木糖赖氨酸脱氧胆盐(XLD)培养基美国BD公司;营养肉汤培养基、MRS液体培养基、双歧杆菌培养基、脑心浸液培养基、亚硫酸铋(BS)琼脂北京陆桥技术有限责任公司。
1.2 仪器与设备
DK-98-1电热恒温水浴锅 东方电工仪器厂;Reference®2微量电动移液器 德国Eppendorf公司;BHC-300IIA/B3生物安全柜 苏州净化仪器设备有限公司;MS3振荡涡旋混匀器 德国IKA公司;MIR254恒温培养箱 美国Thermo公司;Whatman T梯度聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪 德国耶拿分析仪器股份公司;FiveEasy Plus™pH计 瑞士梅特勒-托利多公司;3K15冷冻高速离心机德国Sigma公司;Gel Doc(MP)凝胶成像系统、电泳槽、电泳仪 美国伯乐公司;NanoDrop 1000微量核酸蛋白测定仪 美国Thermo公司。
1.3 方法
1.3.1 沙门氏菌特异性引物设计
通过查阅文献[19-21]分析沙门氏菌的基因序列,从Genebank数据库中公布的已知序列中选取特异性强、进化稳定且相对保守的通用目的基因序列进行引物设计,将沙门氏菌invA基因选定为靶标基因,将确定的基因序列进行BLAST在线比对,利用Primer Premier 6.0设计引物探针,并通过Oligo 7.37进行验证,获得沙门氏菌特异性检测引物,如表2所示。

表2 引物序列与目的扩增产物大小Table 2 Primer sequence and size of the PCR products
1.3.2 菌株基因组DNA提取
将所需菌株用营养肉汤指示培养基进行活化,在适宜的温度下培养,转接传代3 次,备用。将传代3 次的细菌培养液充分摇匀,吸取100 μL增菌液加入到2 mL灭菌透明离心管中;将400 μL融化至室温的Reagent D溶液移入装有增菌液的离心管中,静置避光培养5 min;将离心管放置于卤素灯下,曝光培养5 min后,8 000 r/min离心5 min;去除上清液,在离心管中加入100 μL无菌去离子水,涡旋振荡,制成可直接用于提取基因组DNA的菌悬液。
采用FoodProof磁珠提取仪法提取实验所需菌株基因组DNA。取1 mL上述菌悬液加入2 mL试管中,8 000 r/min离心5 min,移除上清液,在沉淀物中添加700 µL Lysis Buffer及80 µL蛋白酶K,放入振荡水浴锅中65 ℃振荡30 min,取出12 000×g离心5 min,取上清液,备用。准备仪器需要的Tip plate、Binding plate、Washing plate Ⅰ、Washing plate Ⅱ、Washing plate Ⅲ、Elution plate,使用微量移液器将各板对应的Buffer添加至样品孔,将250 µL Binding buffer和20 µL磁珠颗粒混合均匀,加入Binding plate样品孔中,600 µL Washing buffer Ⅰ加入到Washing plate Ⅰ样品孔,800 µL Washing buffer Ⅱ加入到Washing plate Ⅱ样品孔,80 µL Elution buffer加入到Elution plate。取第1步离心完毕添加过Lysis Buffer的裂解液500 µL,转移至加入磁珠颗粒的Binding plate和Binding buffer对应样品孔。打开仪器,选择MPKⅣ程序,将板子放入指定位置,开始自动提取,待程序运行完毕,卸载相应板子,移除样品孔废液,转移Elution plate上提取的DNA至洁净离心管,直接用于后续实验。
1.3.3 HDA反应体系优化和建立
采用时间短、较为便捷的一步法HDA反应体系:5 μL 10×Buffer(含1 mg/mL BSA、100 mmol/L二硫苏糖醇、350 mmol/L Tris-HAc、100 mmol/L MgSO4)、10 U Bst聚合酶、0.16 μmol/L ATP、0.04 μmol/L dNTPs、0.1 μg UvrD解旋酶、25 μmol/L海藻糖、5.0 μg T4 gp32、2 μL模板DNA、终浓度为20 pmol/L的引物,最后用ddH2O补至50 μL[15-16]。仅对反应体系中UvrD解旋酶、T4 gp32的添加量进行优化。反应条件:65 ℃金属浴、恒温2 h。
UvrD解旋酶添加量的优化:选择UvrD解旋酶添加量分别为0.30、0.25、0.20、0.15、0.10、0.05 μg进行实验,确定不同靶标菌株反应体系中较适UvrD解旋酶添加量。
T4 gp32添加量的优化:选择T4 gp32添加量分别为6.0、5.0、4.0、3.0、2.0、1.0 μg进行实验,确定不同靶标菌株反应体系中较适T4 gp32添加量。
HDA结果检测:2%琼脂糖凝胶电泳检测(恒压100 V,电泳45 min),通过凝胶成像系统进行成像分析。
1.3.4 HDA法检测沙门氏菌的特异性
为了验证沙门氏菌HDA法检测特异性,将表1与沙门氏菌进化关系较近且易影响检测结果的金黄色葡萄球菌、福氏志贺氏菌、单核细胞增生李斯特菌、阪崎克罗诺杆菌、婴儿双歧杆菌、大肠埃希氏菌及嗜热链球菌经复苏培养后,按照1.3.2节建立的方法提取相应菌株的DNA,加入1.3.3节建立并优化的反应体系进行检测。
1.3.5 HDA法检测靶标菌株的产物分析
将沙门氏菌基因组DNA加入到1.3.3节建立的反应体系中,用HDA法扩增后,进行2%琼脂糖凝胶电泳(100 V、45 min)。回收凝胶产物的目的条带并纯化,送上海派森诺生物科技有限公司进行测序,将测序结果在NCBI数据库中进行在线BLAST,比较扩增产物的同源性。
1.3.6 HDA法检测实际样品中沙门氏菌的检出限
将采购的样品按照GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》进行检测,用定量方法证实所购样品中不含沙门氏菌。将沙门氏菌人为添加到发酵乳中,将其含量控制在2.6×100~2.6×107CFU/g,按照1.3.2节方法提取菌株基因,加入1.3.3节建立并优化的反应体系进行检测,根据结果得到其检出限。
1.3.7 实际样品测定
用HDA法和GB 4789.4—2016方法同时对所购200 批次样品进行检测。
2 结果与分析
2.1 HDA法反应体系优化结果

图2 HDA法T4 gp32添加量优化实验中沙门氏菌电泳图Fig. 2 Electrophoretogram of showing optimal concentration of T4 gp32
由图1~2可知,当UvrD解旋酶添加量为0.1 μg、T4 gp32添加量为5.0 μg时,肉眼可见清晰、明亮条带,此优化条件下沙门氏菌HDA法检测效果较好。

图1 HDA法UvrD解旋酶添加量优化实验中沙门氏菌电泳图Fig. 1 Electrophoretogram showing optimal concentration of UvrD helicase
2.2 沙门氏菌HDA法检测特异性
由图3可知,乙型副伤寒沙门氏菌、肠炎沙门氏菌、鼠伤寒沙门氏菌均有长度为304 bp的清晰、明亮扩增条带,与目的片段大小一致,而与沙门氏菌进化关系较近易影响检测结果的金黄色葡萄球菌、福氏志贺氏菌、单核细胞增生李斯特菌、阪崎克罗诺杆菌、婴儿双歧杆菌、大肠埃希氏菌、嗜热链球菌按照优化后的HDA法进行实验,均无扩增现象,说明该方法对沙门氏菌检测的特异性良好。

图3 HDA法沙门氏菌特异性检测电泳图Fig. 3 Electrophoretogram showing specificity of HAD for Salmonella
2.3 HDA法检测沙门氏菌回收凝胶产物测序结果分析
将回收凝胶产物测序结果在NCBI数据库中进行BLAST在线比对。由表3可知,使用HDA法靶向invA基因检测沙门氏菌的扩增产物同源性为100%,其扩增产物均为目的扩增产物,证实了该方法的可行性。
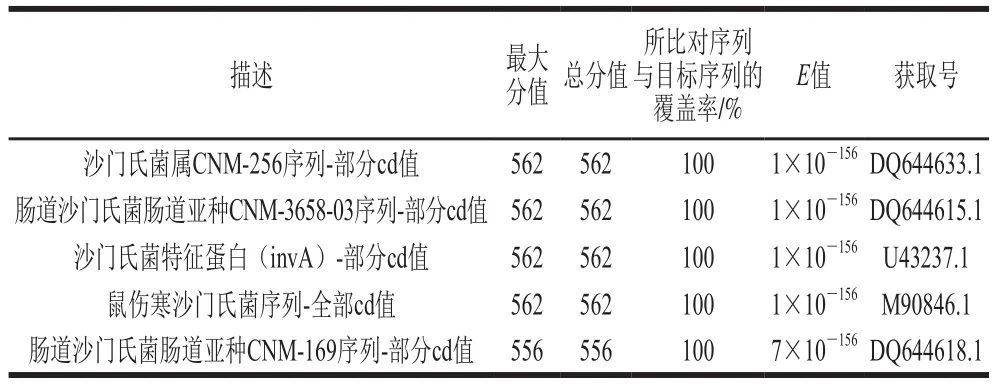
表3 沙门氏菌回收凝胶产物与NCBI数据库的BLAST比对结果Table 3 Results of BLAST alignment between recovered products and NCBI database
2.4 沙门氏菌HDA法测定检出限
由图4可知,泳道7的条带清晰、明亮,得到发酵乳中沙门氏菌HDA法检测的灵敏度为2.6×102CFU/g,满足基层及生产过程中的检测需求。
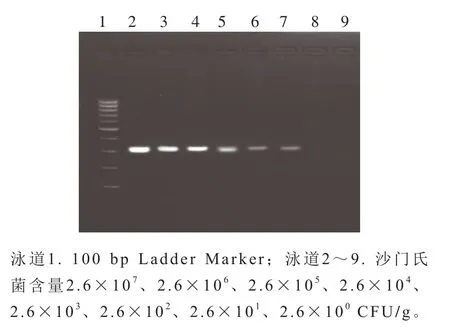
图4 HDA法检测沙门氏菌灵敏度电泳图Fig. 4 Electrophoretogram showing sensitivity of HDA for Salmonella
2.5 实际样品检测结果
对购置的200 批次发酵乳样品同时用HDA法和GB 4789.4—2016方法进行检测。结果表明:HDA法检测出阳性样品3 批次,阴性样品197 批次;国标方法检测出阳性样品1 批次,阴性样品199 批次。证实该检验方法真实可靠,具有可推广性。
3 结 论
HDA法与国标方法相比较,检出结果更加精确、耗时短、操作简便;与其他扩增方法相比较,HDA法对设备要求不高,仅需要满足条件的金属浴和恒温水浴振荡培养设备即可,普通实验室均具备该条件,对于生产环节中现场采样也较易实现;其次,HDA法相比于其他恒温扩增检测技术,在引物设计上采用了与普通PCR相同的方法[12],降低了假阳性率[11,19]。结合本研究检测结果,该方法在生产企业过程控制、基层检测部门都有良好的适用性,符合我国检测技术发展规律,前景广阔。
本研究通过HDA法,建立快速、精准、可推广的检测发酵乳中沙门氏菌的方法,该方法由沙门氏菌invA基因序列为目的基因,设计沙门氏菌特异性引物,进行电泳检测,同时保持相对固定体系含量,优化反应体系中UvrD解旋酶、T4 gp32添加量。最终确定体系(50 μL)中UvrD解旋酶的添加量为0.10 μg,T4 gp32添加量为5.0 μg,该条件下沙门氏菌检测特异性良好,且得到与设计片段长度一致的扩增产物,检出限为2.6×102CFU/g。通过HDA方法直接检测发酵乳中沙门氏菌有其一定的优势,设备简单、特异性强、反应灵敏,适用于乳制品加工各环节沙门氏菌的检测,为监管部门提供了一种新的方法。
