miR-98-3p对食管癌KYSE-30细胞增殖和凋亡的影响及机制*
2021-08-06孔岳锋喻汉华刘沛武
孔岳锋, 喻汉华, 刘沛武
1长江大学第二临床医学院放射科,荆州 434020 2武汉市第四医院,华中科技大学同济医学院附属普爱医院放射科,武汉 430032
微小RNAs(miRNAs)是一类被证实与包括食管癌在内的多种肿瘤的发生、发展密切相关的内源性非编码小分子RNA,与靶基因3′UTR区特异性结合从而调控mRNA的表达是其主要作用机制[1-2]。研究表明,miR-98-3p在肺癌、肝癌等多种肿瘤组织或细胞中低表达,并在肿瘤细胞的增殖、凋亡和侵袭等过程中发挥负性调控作用,但其在食管癌细胞中的作用机制尚不明确[3-4]。本研究首先检测了食管癌组织及细胞系中miR-98-3p的表达水平,其次以KYSE-30为细胞模型研究miR-98-3p对食管癌细胞增殖和凋亡能力的影响,最后进行靶基因验证并探讨其作用机制,以期为食管癌的治疗提供一个新的靶标。
1 材料与方法
1.1 食管癌标本
收集2016年1月~2017年12月在武汉市第四医院暨华中科技大学同济医学院附属普爱医院经病理确诊的35例食管鳞状细胞癌患者的组织标本,其中男性21例、女性14例,平均年龄(56.34±9.42)岁,所有患者均由病理确诊,术前未进行放化疗。手术切取瘤体区域及癌旁组织,并迅速置于液氮罐中临时存储,随后转移至-80℃冰箱保存。本研究符合作者所在单位人体试验伦理委员会所制定的伦理学标准(伦理审批号:PH20150903),且所有患者均签署知情同意书。
1.2 主要试剂和仪器
人食管癌细胞系(TE-1、Eca-109、KYSE-30)、人食管上皮细胞系HEEC均购自中国科学院上海细胞库;miR-98-3p模拟物(miR-98-3p mimics)、miR-98-3p抑制物(miR-98-3p inhibitors)及阴性对照物miR-NC均由上海吉玛生物科技公司设计及合成;DMEM培养液和胎牛血清均购自美国Gibco公司;miRNA反转录、qRT-PCR试剂盒购自宝生物工程(大连)有限公司;LipofectamineTM2000购自美国Invitrogen公司;CCK-8细胞增殖检测试剂盒、Annexin Ⅴ-FITC/PI双染凋亡试剂盒均购自上海碧云天生物技术公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;兔抗人β-catenin、兔抗人Cyclin D1、兔抗人Bax、兔抗人β-actin多克隆抗体以及HRP标记的山羊抗兔IgG均购自美国Abcam公司;ECL化学发光试剂盒购自美国GE公司;酶标仪购自Thermo公司;实时荧光定量PCR仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.3 细胞培养及转染
所有细胞均使用10%胎牛血清的DMEM培养液,在37℃、含5%CO2的细胞培养箱中进行培养。收集对数生长期的KYSE-30细胞,按照1×106/孔的数量接种至6孔板,待细胞融合度为60%左右时采用LipofectamineTM2000转染试剂分别将miR-98-3p mimics、miR-98-3p inhibitors及miR-NC转染到细胞中,8 h后更换新鲜培养液,48 h后收集细胞用于后续实验。
1.4 qRT-PCR检测
TRIzol法提取食管癌组织或细胞总RNA。miR-98-3p特异性引物进行反转录获得相应cDNA,随后进行荧光定量PCR测定,反应条件为:94℃ 5 min;95℃ 15 s,58℃ 30 s,72℃ 20 s,共35个循环;72℃ 5 min。以U6基因为内参,通过2-ΔΔCt法计算相对表达量。
1.5 细胞增殖能力检测
利用CCK-8比色法测定细胞的增殖能力。将转染miR-98-3p mimics、miR-98-3p inhibitors和miR-NC的KYSE-30细胞接种到96孔培养板上,分别在0、24、48、72 h加入10 μL的CCK-8试剂,继续培养2 h后利用酶标仪检测各组样品在450 nm波长下的吸光度(A)值。细胞增殖倍数=各时间点细胞A值/0 h细胞A值。
1.6 细胞凋亡率检测
采用Annexin Ⅴ-FITC/PI细胞凋亡试剂盒测定细胞凋亡率。收集转染miR-98-3p mimics、miR-98-3p inhibitors和miR-NC的KYSE-30细胞,预冷PBS清洗2次后离心去上清。按照说明书首先加入100 μL的结合缓冲液重悬细胞,随后加入5 μL的Annexin-FITC和10 μL的PI轻摇混匀,避光孵育10 min,加入400 μL的结合缓冲液混匀后通过流式细胞仪进行检测。
1.7 靶点预测及双荧光素酶报告基因检测
采用miRDB软件预测miR-98-3p与β-catenin 3′UTR区的结合位点序列,并分别构建β-catenin 3′UTR野生型(WT)和突变型(MUT)的双荧光素酶报告载体质粒。用LipofectamineTM2000试剂将miR-98-3p mimic和β-catenin野生质粒或突变质粒共转染KYSE-30细胞,同时转染海肾质粒作为内参对照。利用双荧光素酶报告基因试剂盒检测各组的荧光素酶的相对活性(相对活性=每组萤火虫荧光素酶检测值/海肾荧光素酶检测值)。
1.8 Western blot法检测蛋白表达
收集转染后的各组细胞,RIPA蛋白裂解液裂解细胞并提取总蛋白,采用BCA法测定蛋白浓度。取50 μg总蛋白行SDS-PAGE凝胶电泳,常规湿法转PVDF膜,经洗涤封闭后加入1∶1000稀释的β-catenin、Bcl-2、Bax及β-actin一抗孵育过夜,随后加入HRP标记的二抗室温孵育2 h,PBS洗涤后ECL进行显色,Bio-Rad凝胶成像系统曝光并对图像进行分析。
1.9 统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料采用均数±标准差表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-98-3p在食管癌组织及细胞中表达降低
qRT-PCR实验结果表明:与癌旁组织相比,miR-98-3p在食管癌组织中的表达明显降低(P<0.05)(图1A);与HEEC细胞相比,食管癌细胞TE-1、Eca-109和KYSE-30中miR-98-3p的表达量显著降低(P<0.05)(图1B)。

A:食管癌组织及相应癌旁组织中miR-98-3p的表达水平,与癌旁组织比较,**P<0.01;B:食管癌细胞中miR-98-3p的表达水平,与HEEC细胞比较,**P<0.01图1 miR-98-3p在食管癌组织及细胞系中的表达Fig.1 The expression level of miR-98-3p in esophageal cancer tissues and cell lines
选取miR-98-3p表达量最低的KYSE-30细胞进行后续实验分析。
2.2 miR-98-3p对食管癌KYSE-30细胞增殖的影响
CCK-8实验结果表明:与对照组miR-NC组比较,转染miR-98-3p mimics的KYSE-30细胞在培养48 h和72 h后细胞增殖能力显著降低,而转染miR-98-3p inhibitors的KYSE-30细胞在24、48和72 h细胞增殖能力显著升高,见图2。
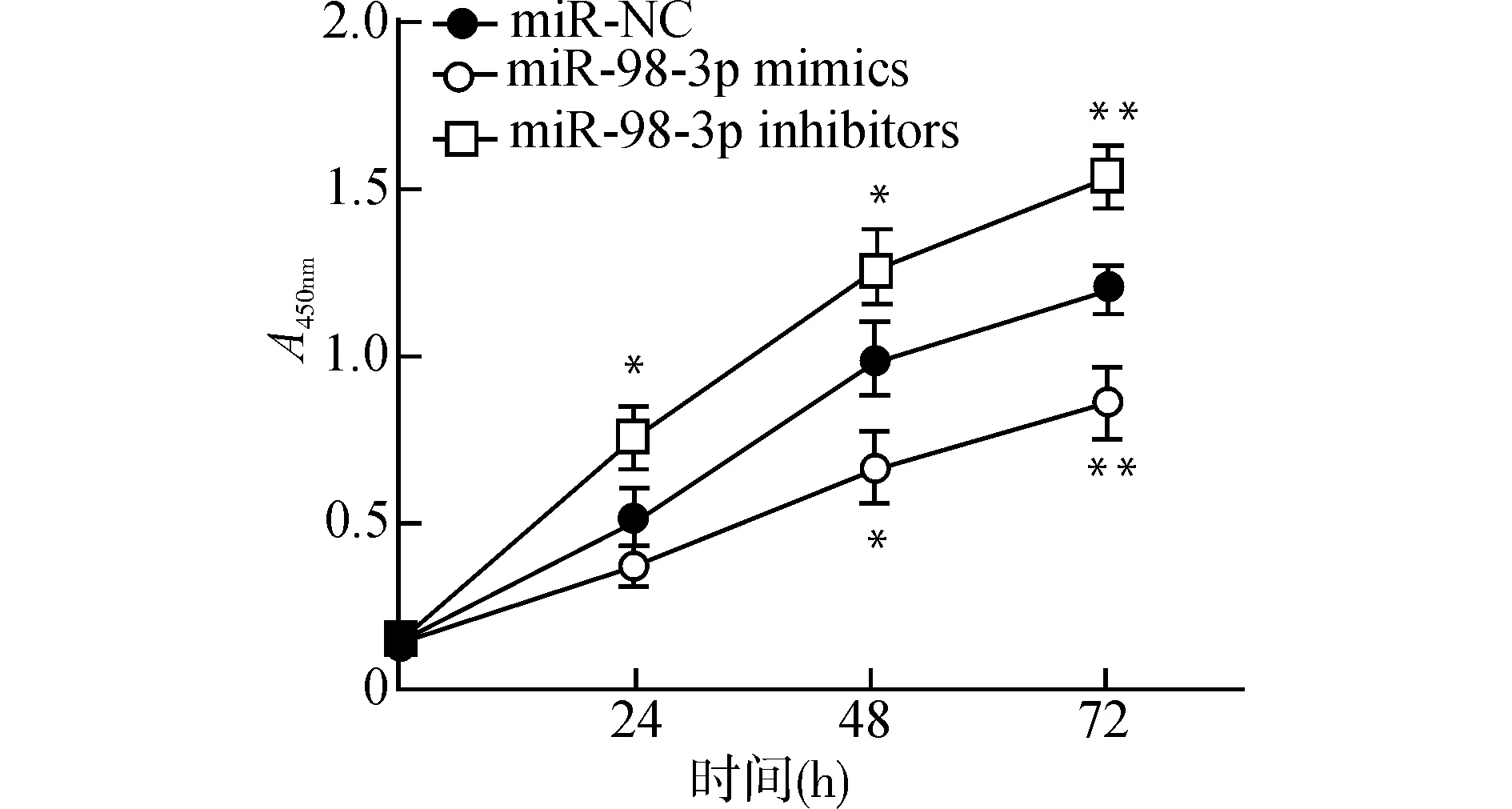
与miR-NC组比较,*P<0.05 **P<0.01图2 miR-98-3p对食管癌细胞KYSE-30增殖的影响Fig.2 Effect of miR-98-3p on the proliferation of KYSE-30 cells
2.3 miR-98-3p对食管癌KYSE-30细胞凋亡的影响
流式细胞仪检测结果表明:与对照组miR-NC比较,转染miR-98-3p mimics的KYSE-30细胞凋亡率显著升高,而转染miR-98-3p inhibitors的KYSE-30细胞显著降低(图3)。
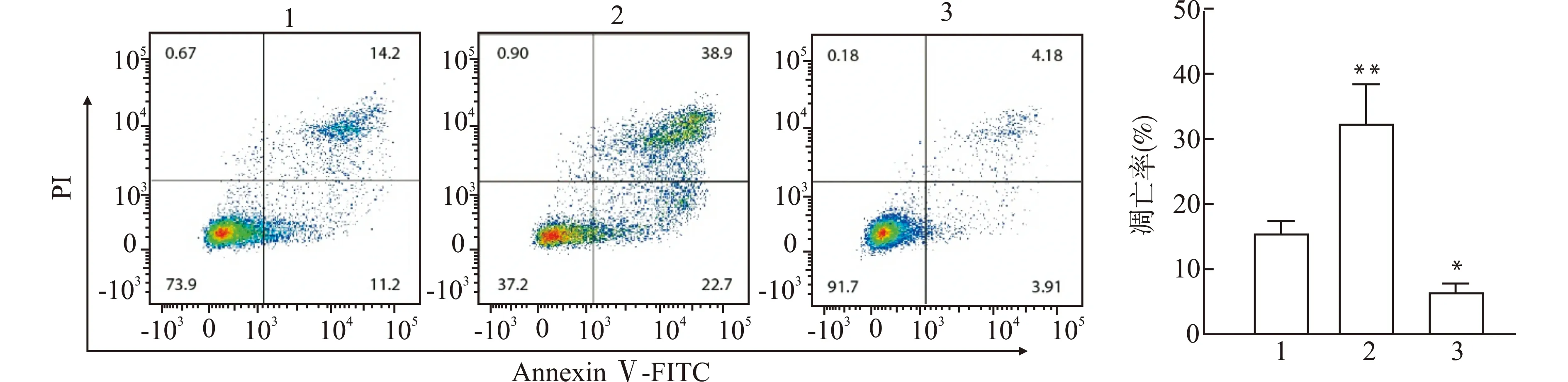
1:miR-NC;2:miR-98-3p mimics;3:miR-98-3p inhibitors;与miR-NC比较,*P<0.05 **P<0.01图3 miR-98-3p对食管癌KYSE-30细胞凋亡的影响Fig.3 Effect of miR-98-3p on the apoptosis of KYSE-30 cells
2.4 miR-98-3p靶向调控β-catenin基因
生物信息学预测miR-98-3p可以靶向结合β-catenin的3′UTR区域(图4A)。双荧光素酶报告基因检测显示:miR-98-3p mimics与β-catenin 3′UTR-WT(野生型)共转染组的荧光强度显著低于miR-NC与β-catenin 3′UTR-WT共转染组(P<0.05),而miR-98-3p mimics与β-catenin 3′UTR-MUT(突变型)共转染组的荧光强度和miR-NC与β-catenin 3′UTR-MUT共转染组之间差异无统计学意义(P>0.05),见图4B。
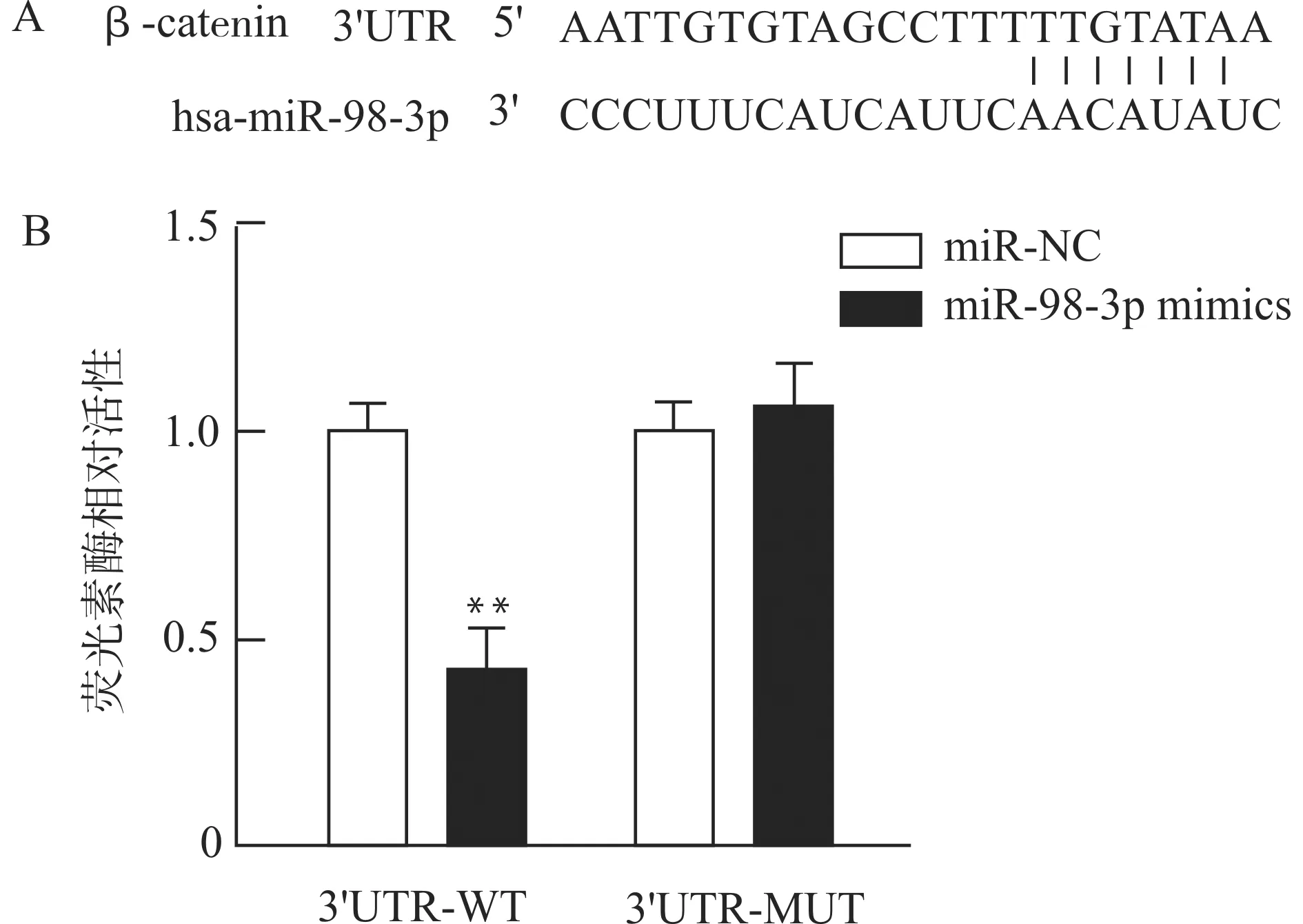
A:miR-98-3p与β-catenin 3′UTR结合位点预测;B:双荧光素酶报告基因检测结果,与miR-NC比较,**P<0.01图4 miR-98-3p靶基因验证Fig.4 Detection of target gene of miR-98-3p
2.5 miR-98-3p对β-catenin下游通路中蛋白表达水平的影响
Western blot结果显示:转染miR-98-3p mimics后KYSE-30中β-catenin和Cyclin D1蛋白水平显著降低,Bax蛋白表达显著升高,而转染miR-98-3p inhibitors起到相反的作用(图5),推测miR-98-3p可能通过靶向抑制β-catenin从而调控下游Cyclin D1和Bax蛋白水平。
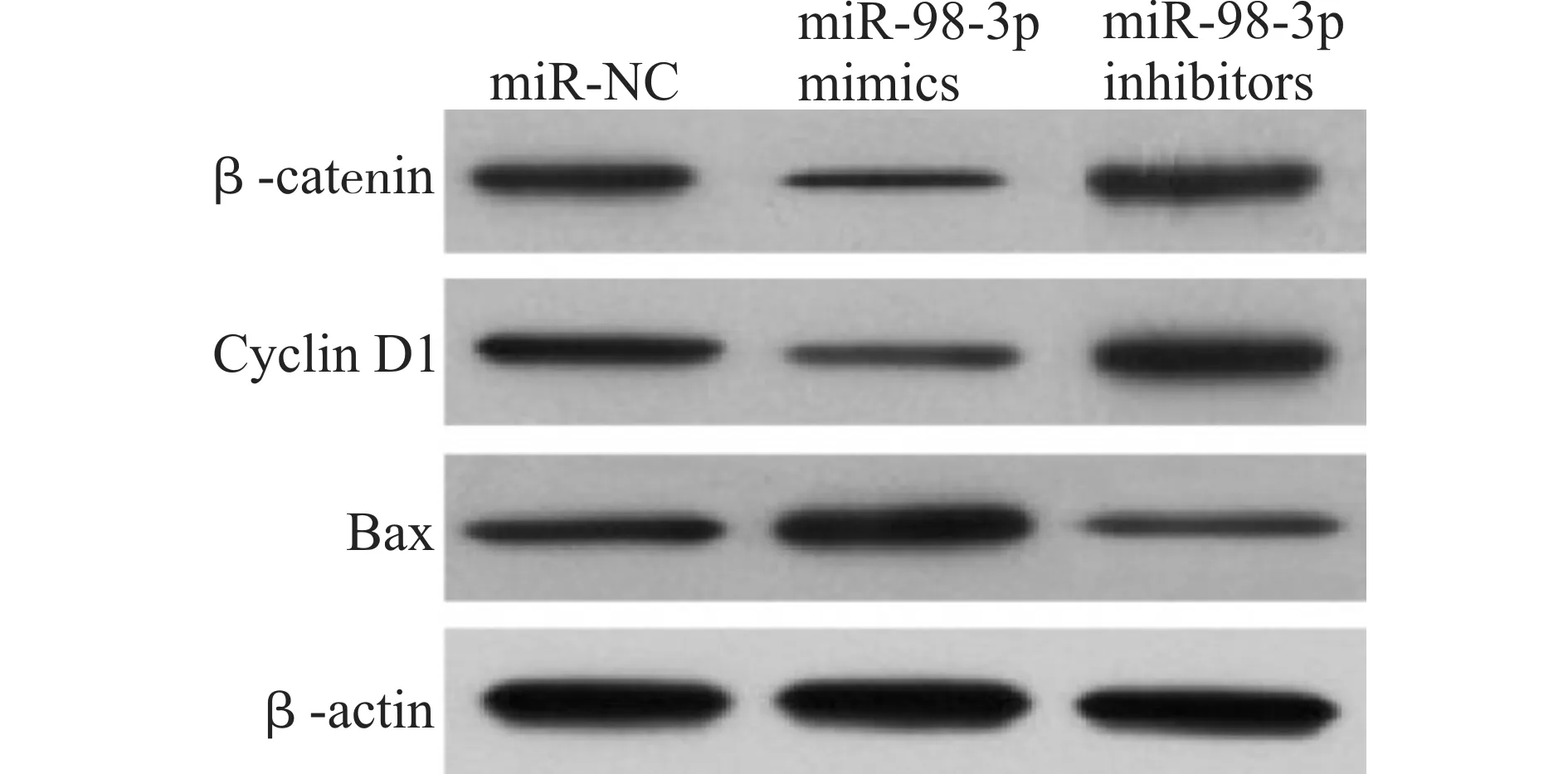
图5 miR-98-3p对食管癌KYSE-30细胞中β-catenin、Cyclin D1和Bax表达的影响Fig.5 Effect of miR-98-3p on the expression of β-catenin,Cyclin D1 and Bax in KYSE-30 cells
3 讨论
食管癌是第6大恶性肿瘤性疾病,每年全球食管癌新发病例约45.6万例,导致的死亡人数超过40万人[5]。我国每年食管癌新发病例约占全球病例总数的50%,是继肺癌、胃癌和肝癌之后的第4大恶性肿瘤疾病[6]。尽管诊断方法和治疗策略的完善大大提高了食管癌患者的生存期,但5年生存率依旧不到10%,中位生存期仅为1.5年[7]。因此,加强食管癌发病机制的研究,有针对性进行靶向预防和治疗是目前食管癌研究的一个趋势。
miRNA是一类由18~25碱基组成的非编码RNA,通过碱基互补配对方式与靶基因3′UTR区结合,从而降解靶基因mRNA或抑制其蛋白翻译[1]。研究表明,大约50%的miRNA位于与肿瘤相关的基因组区域,并在肿瘤的发生发展中起着癌基因或抑癌基因的作用[2]。目前,已经确定多种miRNA分子不仅在食管癌细胞的增殖、凋亡、迁移、转移及血管生成过程中起到关键的调控作用,而且还可以作为食管癌进展和预后的有效标志物[8]。miR-98-3p属于let-7/miR-98家族的重要成员,在多种肿瘤组织中低表达[9]。miR-98-3p通过调控LIN28A、p53、Ang-1、FGF-1等凋亡或迁移相关基因,参与了肺癌和肝癌细胞的增殖、分化、侵袭、转移等过程[3-4]。此外,miR-98-3p也和肝癌细胞的多重耐药性密切相关[10],并且可以作为肺癌诊断的重要标志物[11]。本研究发现miR-98-3p在食管癌组织及细胞中表达均降低,并且在食管癌KYSE-30细胞中主要发挥抑癌基因的作用,其作用机制可能和靶向调控β-catenin相关。
研究表明,β-catenin在细胞内主要有两方面的功能:一是通过与细胞膜上的钙粘蛋白相互作用,参与细胞与细胞或细胞与基质间的粘附[12];另一作用是作为经典Wnt信号通路中的关键分子,通过调控Cyclin D1、Bax、Survivin等基因的表达,从而调控细胞的增殖、凋亡[13]。正常食管鳞状上皮仅细胞膜有β-catenin表达,胞质及胞核中很少表达或不表达,而癌变的食管上皮细胞胞质中β-catenin表达升高,同时伴有在胞膜部位的表达减少或缺失[14]。研究发现,β-catenin不仅参与食管癌细胞的增殖及凋亡,并且β-catenin的表达程度与肿瘤恶性程度及患者预后生存期密切相关[15]。在本研究中,通过生物信息学及双荧光素酶报告基因实验发现miR-98-3p在KYSE-30细胞内可以靶向调控β-catenin,因此我们猜测miR-98-3p对食管癌细胞的抑制作用可能是通过调控β-catenin来实现的,随后通过检测Wnt通路中和增殖、凋亡相关的靶蛋白水平进行了验证。
综上所述,miR-98-3p可能通过靶向调控β-catenin的表达,从而影响下游效应分子Cyclin D1和Bax表达水平,进而抑制食管癌KYSE-30细胞的增殖和促进细胞凋亡。本研究的不足之处是缺少动物实验数据,也缺少对临床病例的随访调查,这需要在后续的研究中继续完善。
