基于上转换纳米材料与磁分离的荧光免疫分析方法检测食品中酪胺
2021-07-28张万利
张 彪,黄 娜,张万利,王 硕,生 威,
(1.天津科技大学食品科学与工程学院,食品营养与安全国家重点实验室,天津 300457;2.南开大学医学院,天津 300072)
酪胺又称对羟基苯乙胺,是酪氨酸在酪氨酸脱羧酶作用下产生的一元胺,作为常见的小分子生物胺,主要存在于肉及其制品、水产品以及发酵制品中[1-3]。研究表明适量的酪胺可促进新陈代谢,维持正常生理特征,但过量的酪胺可引起偏头痛、心力衰竭、血压飙升、哮喘和荨麻疹等健康问题[4-6],因此酪胺含量的检测有可能成为评价肉类水产品新鲜度和发酵产品质量的一个新指标[7-9]。
目前国内外酪胺的检测方法主要为薄层色谱法[10]、离子交换色谱法[11]、毛细管电泳法[12]、高效液相色谱法[13-15]、气相色谱-质谱法[16]、电化学传感器法[17]和酶联免疫吸附剂测定法[18],上述仪器方法可以灵敏、准确地检测酪胺的含量,但样品的前处理复杂,衍生化物质稳定性差[19],设备成本高昂,且需专业技术人才操作,而电化学传感器法同仪器检测方法的重现性和稳定性较差[20]。基于抗原-抗体特异性识别的酪胺免疫分析方法,主要为传统的酶联免疫吸附剂测定法,但该方法稳定性较差、检测时间较长、灵敏度低[18,21]。因此有必要开发样品前处理简单、操作便捷、检测快速、灵敏度高、方法重现性和稳定性好的酪胺检测新方法。
本实验用纯化酪胺多克隆抗体标记上转换纳米材料(upconversion nanoparticles,UCNPs)制备信号探针,酪胺包被原偶联磁性聚苯乙烯微球制备捕获探针,在最优的实验条件下孵育捕获探针与酪胺间接地相竞结合信号探针表面抗体的反应30 min后,利用磁力架将信号探针与捕获探针的免疫复合物分离,多次清洗后,检测免疫复合物的荧光强度,结果表明,荧光强度的差值与酪胺质量浓度呈负相关。本实验运用磁分离技术建立酪胺的荧光免疫分析方法,节约检测时间、提高检测效率,可实现肉及其制品、发酵产品以及海产品中酪胺快速检测。
1 材料与方法
1.1 材料与试剂
猪肉、培根、金鲳鱼、奶酪、米酒、酱油 市购。
三氯乙酸(纯度为99.0%) 天津市江天化工技术股份有限公司;酪胺、组胺、苯乙胺、色胺、章鱼胺、5-羟色胺、精胺、亚精胺、酪氨酸、四水合乙酸钇、乙酸铥、四水合乙酸镱、聚苯烯酸、卵清白蛋白(ovalbumin,OVA)、牛血清蛋白(bovine serum albumin,BSA)、二甘醇、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、吗啉乙磺酸(4-morpholineethanesulfonic acid,MES)、二甲基亚砜(dimethyl sulfoxide,DMSO)、乙基-3-[3-(二甲基氨基)丙基]卡二亚胺(N-ethyl-N’-(3-diethylaminopropyl)-carbodiimide,EDC)、聚丙烯酸(polyacrylic acid,PAA,分析纯) 美国Sigma-Aldrich公司;氟化铵、氢氧化钠、十八烯酸(纯度均不小于90%)、羟乙基哌嗪乙硫磺酸(N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid,HEPES)、乙腈、乙酸铵(均为色谱纯) 天津国药集团化学试剂有限公司;磁性聚苯乙烯微球(magnetic polystyrene microspheres,MPMs) 天津倍思乐色谱技术开发中心。所有分离用有机溶剂均为分析纯。
1.2 仪器与设备
F-2500荧光分光光度计(配有980 nm外部激发器)日本Hitachi公司;高效液相色谱仪(配有可变波长紫外检测器) 日本岛津公司;纯水仪 美国Millipore公司;WONDASIL C18SUPERB色谱柱(250.0 mm×4.6 mm,5 µm) 岛津技迩(上海)商贸有限公司。
1.3 方法
1.3.1 NaYF4Yb,Tm UCNPs与信号探针制备
参考Sheng Wei等[22]合成UCNPs的方法并进行修改以制备UCNPs。取38.0 mg四水合乙酸镱、304.3 mg四水合乙酸钇、3.5 mg乙酸铥溶解于17.5 mL十八烯酸和6.0 mL油酸混合物中。搅拌加热到160 ℃,维持30 min,再降温到40 ℃,逐滴加入含148.0 mg氟化铵和100.0 mg氢氧化钠的10 mL甲醇维持30 min,温度升至90 ℃并维持约40 min除去甲醇,再升至110 ℃并维持约30 min除去溶液中的O2,加热到310 ℃并维持60 min,冷却至室温后离心,乙醇清洗后在60 ℃烘干得油溶性UCNPs。油溶性UCNPs经配体交换法获得水溶性UCNPs。配体交换法需称取1.5 g PAA,加入到含30 mL二甘醇三颈烧瓶中,在氩气的保护下,加热反应溶液使烧瓶内温度升高至110 ℃,并保持剧烈搅拌反应1 h;称取90.0 mg油溶性UCNPs溶解于6.0 mL甲苯中,将此混合溶液快速加入到反应液中,同时在110 ℃保持1 h后,继续升高反应体系的温度至240 ℃保持1 h,反应完毕后自然冷却至室温,离心收集沉淀产物。随后用超纯水离心洗涤沉淀物3 次后,放置干燥箱中干燥,得到水溶性聚丙烯酸上转换材料(polyacrylic acid-upconversion nanoparticles,PAA-UCNPs)。
制备酪胺的免疫原需将20.0 mg BSA溶解于4 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 mol/L,pH 7.4),将含4.2 mg酪胺的100 µL DMSO溶液逐滴加入上述溶液,再逐渐加入13 µL体积分数25%的戊二醛溶液,4 ℃搅拌反应过夜。反应溶液经透析袋于4 ℃透析3 d,获得酪胺免疫原,放置-20 ℃备用。
抗体在本实验的前期制备[23]。选2 只雄性新西兰大耳白兔(8~10 周龄、体质量2.5~3 kg),首次免疫采用背部多点皮下注射和腿部肌肉注射免疫,采用多点皮下注射免疫的方式重复加强免疫5 次。初次免疫时,每只兔子的免疫剂量为1 mg免疫原(以BSA的量计算);加强免疫时,每只兔子的免疫剂量为0.5 mg免疫原(以BSA的量计算)。从第3次免疫开始,每次免疫后隔1 周进行耳缘静脉取血以测定抗体性能。最后一次免疫7 d后,股动脉取全血,4 ℃冰箱静置过夜,4 ℃、10 000 r/min离心10 min获得抗体血清,纯化后分装-20 ℃冻存备用。
参考Sheng Wei等[22]制备信号探针的方法并进行修改。将5.0 mg水溶性UCNPs、5.0 mg NHS和10.0 mg EDC溶解于2.0 mL MES溶液(0.01 mol/L、pH 5.5),30 ℃搅拌3 h活化UCNPs的羧基位点,以4 ℃、4 000 r/min离心10 min,沉淀超纯水清洗3 次除去多余的NHS和EDC。活化后的UCNPs复溶到2.0 mL HEPES溶液(0.01 mol/L、pH 7.2),加入适量体积的酪胺抗体进行偶联。于4 ℃、4 000 r/min离心10 min获得UCNPs与抗体的偶联复合物,再用HEPES溶液清洗3 次后,复溶到2.0 mL质量分数10% BSAHEPES溶液,于30 ℃持续反应1 h以封闭UCNPs表面多余位点。于4 ℃、4 000 r/min离心10 min清洗后复溶,获得1.0 mL UCNPs与酪胺抗体的偶联复合物,即信号探针。
1.3.2 酪胺包被原与捕获探针制备
参照Sheng Wei等[23]方法制得酪胺包被原。20.0 mg OVA溶解于4.0 mL PBS(0.01 mol/L,pH 7.4),将含3.7 mg酪胺的100 µL DMSO溶液逐滴加入上述溶液,再逐渐加入13 µL体积分数25%的戊二醛溶液,4 ℃搅拌反应过夜。反应溶液经透析袋于4 ℃透析3 d,获得酪胺包被原,置于-20 ℃备用。
5.0 mg MPMs溶解于1.0 mL PBS(0.01 mol/L,pH 7.4),加入10.0 mg EDC和5.0 mg NHS,在30 ℃活化表面羧基1 h。用PBS清洗3 次以除去经外部磁力活化后MPMs的杂质。MPMs用1.0 mL PBS复溶,并加入一定量制备好的酪胺包被原,且在30 ℃孵育4 h。经外部磁力分离获得酪胺包被原与MPMs的复合物,再复溶到体积分数为20%的BSA-PBS以封闭MPMs表面未反应的羧基,静置1 h。经外部磁力分离清洗后获得酪胺的感应探针,复溶到5.0 mL PBS备用。
1.3.3 荧光免疫分析方法
基于酪胺与感应探针上包被原互相间接竞争结合信号探针表面的抗体后,磁分离感应探针与信号探针的偶联物,用分光光度计测定偶联物中UCNPs的荧光强度,通过公式计算酪胺在不同质量浓度下的荧光强度差,并以酪胺质量浓度为横坐标,荧光强度差值为纵坐标,建立酪胺的荧光免疫分析方法标准曲线。配制50 μL质量浓度分别为0.00、0.02、0.05、0.10、1.00、10.00、20.00、50.00、100.00、200.00、500.00 μg/L的酪胺标准品溶液,依次加入50 μL感应探针和50 μL信号探针于2.0 mL离心管,加入PBS(0.01 mol/L、pH 7.4)并定容到400 μL,摇床240 r/min匀速转动反应30 min。磁分离后弃上清液,清洗感应探针与信号探针的偶联物,复溶后通过下式计算荧光强度差值:
ΔI=I0-I1
式中:ΔI为荧光强度差值;I0为体系无酪胺的荧光强度;I1为不同质量浓度酪胺对应的荧光强度。
1.3.4 荧光免疫分析方法的特异性验证
为考察本方法的特异性,检测酪氨酸、亚精胺、亚精胺、组胺、组氨酸、章鱼胺、色胺、苯乙胺和5-羟色胺等生物胺和酪胺结构类似物,通过比较不同待测物产生的荧光强度差值与酪胺产生的荧光强度差值,评价该方法的特异性。
1.3.5 样品处理
高效液相色谱检测样品的处理方法参考GB/T 5009.208—2016《食品中生物胺含量的测定》[24],荧光免疫分析处理样品参考Sheng Wei等[23]方法。5.0 g含猪肉、培根、金鲳鱼和奶酪的样本与20.0 mL体积分数3%的三氯乙酸溶液混合,于4 ℃、600 r/min高速涡旋5 min后,以4 ℃、10 000 r/min离心10 min。上清液加入20.0 mL正己烷后,高速涡流5 min去除脂肪。收集下层溶液,1 mol/L NaOH溶液调节pH值至中性后,用PBS溶液适当稀释待测。酱油、米酒调至中性后,用PBS稀释待测。
1.3.6 色谱条件
色谱柱:C18柱(250.0 mm×4.6 mm,5.0 µm);紫外检测波长:254 nm;柱温:35 ℃;流速:0.8 mL/min;进样量:20 µL;流动相A:体积分数0.1%的乙酸-乙酸铵溶液;流动相B:乙腈。梯度洗脱程序如表1所示。
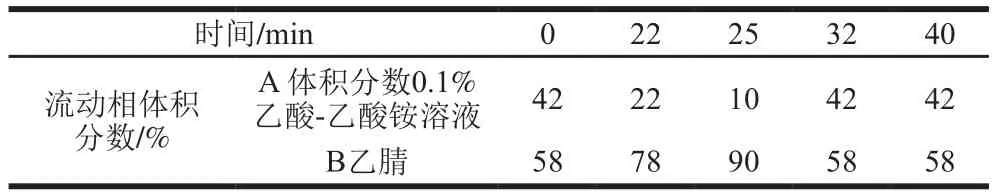
表1 梯度洗脱程序Table 1 Gradient elution program
2 结果与分析
2.1 UCNPs表征
油溶性与水溶性UCNPs的透射电镜、粒径分布、傅里叶红外光谱与荧光光谱表征结果如图1所示。图1a和图1b表明,油溶性与水溶性UCNPs均呈球形且分布均匀。油溶性UCNPs的粒径分布约在23.5~32.5 nm范围内,平均粒径为28.3 nm;水溶性UCNPs的粒径分布在24.5~33.5 nm范围内,平均粒径为29.6 nm(图1c、d)。如图1e所示,3 437、3 450 cm-1均对应羟基的伸缩振动,油溶性UCNPs的傅里叶红外光谱在2 928 cm-1出现峰值对应甲基的伸缩振动,水溶性UCNPs的傅里叶红外光谱在1 730 cm-1出现峰值,对应羰基在2 928 cm-1峰值消失,分析原因为油溶性UCNPs经配体交换后,水溶性UCNPs表面成功修饰羧基[25-26]。图1f表明,所合成的UCNPs在980 nm激发波长下,能发射出单一的483 nm荧光,其可作为荧光检测信号。
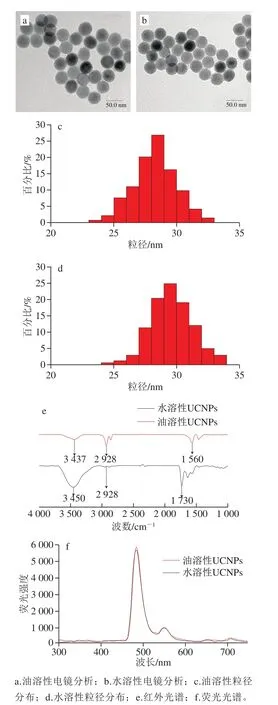
图1 UCNPs材料表征Fig.1 Characterization of UCNPs
2.2 信号探针与感应探针制备条件的优化
信号探针与感应探针的制备条件直接影响荧光免疫分析方法的灵敏度和准确性[26]。如图2a所示,固定50 µL质量浓度为5.0 mg/mL已活化的水溶性UCNPs,当抗体添加量小于12 µg,抗体添加量增加时,水溶性UCNPs表面偶联抗体量也逐渐增加;当抗体添加量大于等于12 µg,偶联量基本不变,但偶联率呈现整体下降的趋势,因此选择添加12 µg酪胺抗体制备信号探针,固定50 µL 5.0 mg/mL已活化的MPMs,并添加不同质量的包被原,结果如图2b所示,因此选择添加70 µg酪胺包被原制备感应探针。
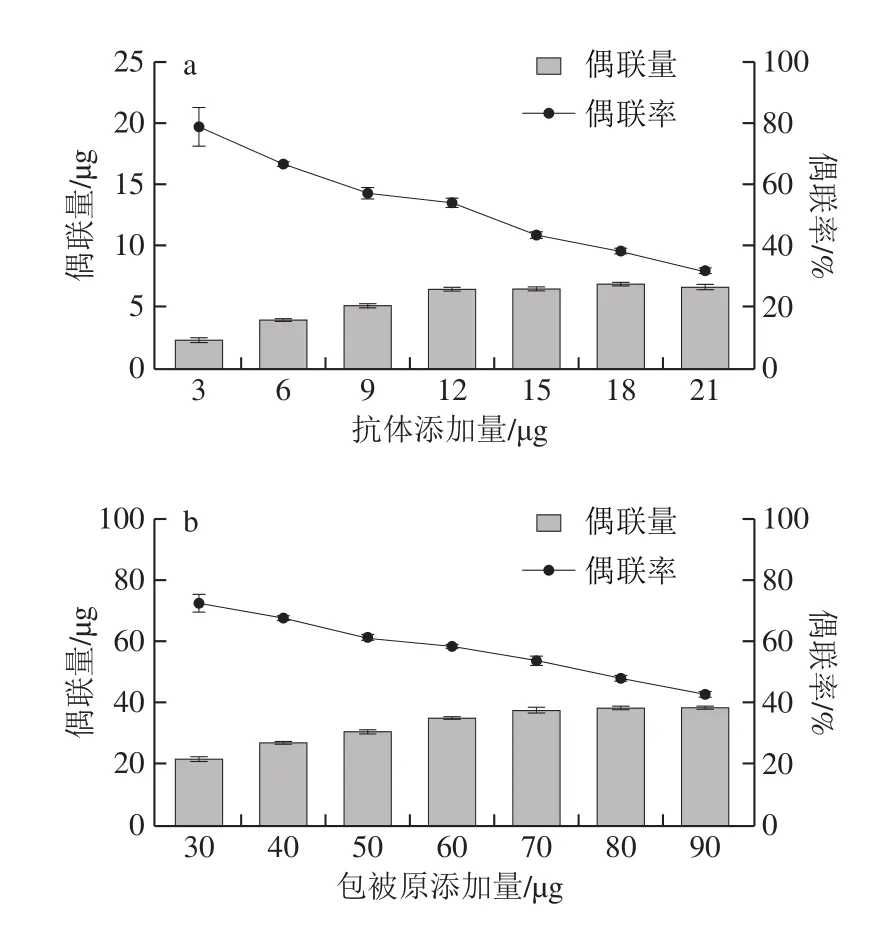
图2 抗体(a)、包被原(b)添加量的优化Fig.2 Optimization of preparation conditions of antibody (a) and coated antigen (b) mass added
2.3 信号探针添加量与孵育时间的优化
信号探针与感应探针的比例直接影响荧光免疫分析方法的灵敏度和准确性,而孵育时间决定了该方法的检测速度[27]。如图3a所示,当固定感应探针的添加体积为40 µL,且信号探针的添加量增加时,反应体系的荧光强度也随之增加;信号探针添加体积为70 µL时,荧光强度达到最大;信号探针添加体积大于70 µL,荧光强度增加不显著,因此选择70 µL为信号探针的添加量。如图3b所示,荧光强度随着孵育时间延长而增大,后趋于稳定;孵育时间为30 min时,荧光强度达到最大值;孵育时间大于30 min时,荧光强度基本不变,为了能够快速检测,孵育时间应为30 min。

图3 信号探针添加量(a)与孵育时间(b)的优化Fig.3 Optimization of signal probe dosage (a) and incubation time (b)
2.4 荧光免疫分析方法的建立
利用建立的荧光免疫分析方法检测酪胺,结果如图4所示,未添加酪胺检测时,体系的荧光强度为I0,不同质量浓度的酪胺对应不同的荧光强度I,随着酪胺质量浓度增加,检测体系的荧光强度逐渐降低。以酪胺的质量浓度(µg/L)为横坐标,荧光强度差值为纵坐标,建立酪胺的荧光免疫分析方法标准曲线。标准曲线的线性方程为y=382.818 9lgx+649.831 8(R2=0.998 6),检测限按照3 倍信噪比原则计算[28],建立的方法检测线性范围为0.1~100.0 µg/L,方法检测限为0.05 µg/L。
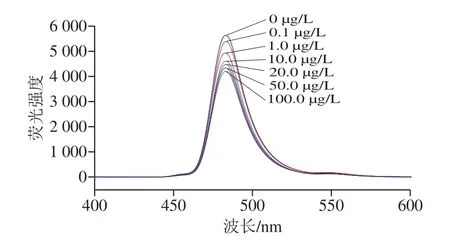
图4 不同酪胺质量浓度的荧光强度Fig.4 Fluorescence intensity of tyramine at different concentrations
2.5 荧光免疫分析方法的特异性
为评价荧光免疫分析方法的特异性,对质量浓度10 µg/L的酪胺及其同质量浓度的结构类似物、同类物进行检测,并根据空白荧光强度计算相应的荧光强度差值[29],结果如图5所示,酪胺荧光差值响应高,亚精胺、精胺、组胺、酪氨酸、组氨酸、章鱼胺、色胺、苯乙胺、5-羟色胺等类似物的响应值从200逐渐降低至0,经荧光免疫分析方法检测,荧光差值响应低,说明建立的荧光免疫分析方法能特异性检测酪胺,其他生物胺和酪胺的结构类似物均不会影响酪胺的检测。
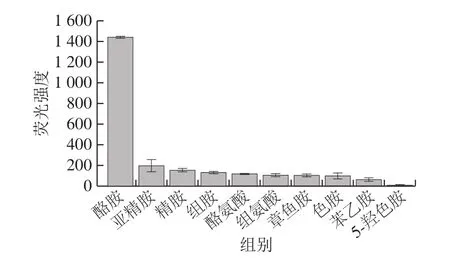
图5 荧光免疫分析方法特异性分析Fig.5 Specificity analysis of fluorescence immunoassay
2.6 实际样品检测
为了进一步评价酪胺的荧光免疫分析方法检测的准确性和实际应用性[28-29],实验进行样品检测和酪胺加标回收实验,结果如表2所示,未添加的样品中均检测出酪胺,而且荧光免疫分析方法的检测结果与高效液相色谱法的检测结果有很好的一致性。酪胺荧光免疫分析方法中,酪胺的添加回收率在86.44%~101.62%范围内,且变异系数小于10%;高效液相色谱法的酪胺添加回收率在87.40%~104.86%范围内,且变异系数小于10%。以上2 种方法的检测结果在酪胺的本底值与添加量的2 种条件下均呈现一致性,因此本实验建立的荧光免疫分析方法能够应用于肉及其制品、水产品以及发酵制品中酪胺的检测。

表2 高效液相色谱法和荧光免疫分析方法检测实际样品中酪胺的结果(n= 3)Table 2 Comparison of results of HPLC and fluorescence immunoassay for tyramine in food samples (n= 3)
3 结 论
本实验合成了在980 nm激发波长下具有483 nm特征发射峰的UCNPs作为信号标记物,利用抗原-抗体的特异性识别作用和磁性微球的快速磁分离作用,建立快速、高特异性检测食品中酪胺的荧光免疫分析方法,同时与传统的酶联免疫吸附剂测定法相比,灵敏度更高、操作更简单;与高效液相色谱方法相比,样品前处理步骤不需要衍生化步骤,因此缩短了检测时间。真实样品中酪胺含量的测定结果与液相色谱检测结果具有很好的一致性,说明本方法具有很好的实际应用性。本实验建立的荧光免疫分析方法可作为肉及肉制品、发酵产品以及水产品中酪胺的检测工具。由于UCNPs的优良光学特性,其作为信号标记物可运用于食品中小分子危害物的高灵敏检测方法中,因此有良好的应用前景。
