人工智能对肺磨玻璃结节检出及定性诊断价值研究
2021-07-24赵正凯周建收李建林程绍玲
赵正凯,梁 勇,周建收,李建林,李 娅, 程绍玲
(1. 成都市第三人民医院 放射科,四川 成都 610031;2. 大连医科大学附属第二医院 放射科,辽宁 大连 116027)
肺癌的发病率和死亡率较高,是对人类健康和生命威胁最大的恶性肿瘤之一[1]。既往研究发现早期肺癌可表现为磨玻璃结节(ground glass nodule,GGN)[2],因此在大量胸部影像中检出并正确诊断GGN是当前医患共同的迫切需求。近年来越来越广泛应用的高分辨胸部CT 筛查使GGN的检出率显著提高,可实现肺癌早诊早治,降低死亡率,但影像科医师的工作负担日益加重。基于深度学习的人工智能(artificial intelligence, AI)已应用于高分辨胸部CT,其对GGN的快速检出和定性,可帮助医师减少工作量,但AI的准确性目前研究较少。本研究旨在探讨基于深度学习的AI在胸部CT磨玻璃结节检测及良恶性诊断中的应用价值。
1 资料与方法
1.1 研究对象
收集2018年6月至2020年6月于成都市第三人民医院术前行胸部高分辨CT检查,并行胸腔镜手术切除肺GGN的患者共123例,共切除154枚GGN。其中男性35例,女性88例,年龄27~81岁,平均年龄(57.8±11.3)岁。
排除标准:(1)严重运动伪影;(2)间质性肺病、纤维化;(3)肺炎;(4)肺水肿。
1.2 CT扫描方法
采用Philips Brilliance iCT 256 层螺旋 CT,管电压120 kV,管电流39 mAs,螺距0.8,层厚8 mm,使用标准算法重建1.5 mm层厚轴位图像。采用西门子16排CT扫描仪,管电压120 kV,管电流自动调整,螺距1.2,层厚10 mm,使用标准算法重建1.5 mm层厚轴位图像。Philips Brilliance iCT 256 层螺旋 CT扫描75例共切除94枚GGN;西门子16排CT扫描48例共切除60枚GGN。
1.3 肺结节检测及标准认定
基于深度学习模型的AI软件由图玛深维医疗公司提供,将123例胸部高分辨CT薄层图像传输至AI工作站,软件系统自动识别、标记肺GGN及良恶性诊断,GGN标记的恶性概率<50%认定AI诊断为良性可能,恶性概率≥50%则认定AI诊断为可疑恶性。
影像医师组GGN的检测及定性诊断先由高年资住院医师对高分辨薄层胸部CT图像进行检测,并根据GGN的大小、密度、形态及与周围血管支气管的关系诊断GGN为良性可能或可疑恶性,随后经副主任医师审核后完成。另两名高级职称影像科医师结合人工智能并参考已审核的影像报告在胸部CT横轴位图像进行GGN检测及认定,两人意见不一致时结合多平面重建并讨论获得一致性结果作为真GGN检出的金标准。手术病理结果作为GGN定性诊断的金标准。分别记录人工智能软件和影像医师检测的每个磨玻璃结节的大小及良恶性;GGN的大小分为<5 mm和≥5 mm。
1.4 统计学方法
所有数据采用SPSS 21.0 统计学软件处理。分别计算影像医师、人工智能对GGN检测的灵敏度、阳性预测值及假阳性率;采用McNemar检验比较影像医师和人工智能对GGN检出的能力。计算AI、影像医师及AI联合影像医师诊断恶性GGN的敏感度、特异度、阳性预测值及阴性预测值。P<0.05为差异有统计学意义。
2 结 果
2.1 AI和影像医师对GGN检出的灵敏度、阳性预测值及假阳性结节个数
123例患者高分辨胸部CT中两名高年资影像科医师结合人工智能总共检出289枚真GGN,AI和影像医师检出真磨玻璃结节情况比较见表1。AI和影像医师检测的灵敏度分别为(94.8% vs. 85.1%),阳性预测值分别为(94.2% vs. 100%)。对于≥5 mm的219枚GGN,AI和影像医师检测的灵敏度分别为(96.8% vs. 94.5%),阳性预测值分别为(95.1% vs. 100%)。典型病例图像见图1~4。
AI的假阳性结节个数为17个,假阳性率为每例胸部CT 0.14个GGN;其中8例表现为少许炎症;4例表现为小叶中央结构;3例表现为血管分叉、聚集、迂曲伪影;2例表现为条索影的容积效应。影像医师无假阳性磨玻璃结节检出。
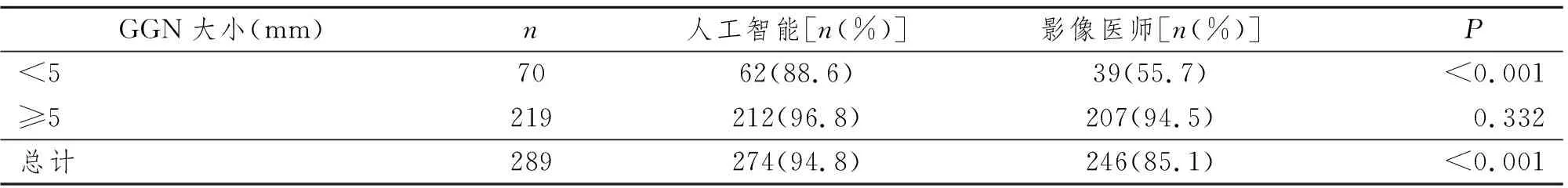
表1 AI和影像医师检出真磨玻璃结节情况比较
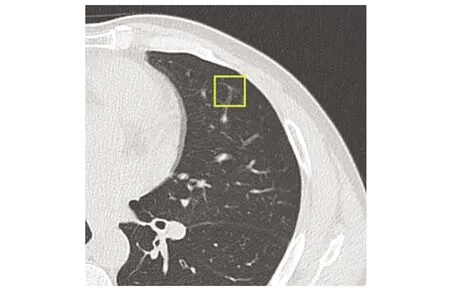
图1 男,54岁,左肺上叶小血管分叉并呼吸运动伪影,AI假阳性Fig.1 Male, 54 years old. The left upper lobe showed small blood vessels bifurcation and respiratory motion artifacts, false positive case by AI

图2 男,78岁;左肺上叶多支血管聚集,并见临近气管结构,AI假阳性Fig.2 Male, 78 years old. The left lung upper lobe showed gathering of multiple blood vessels and adjacent trachea structure, false positive case by AI
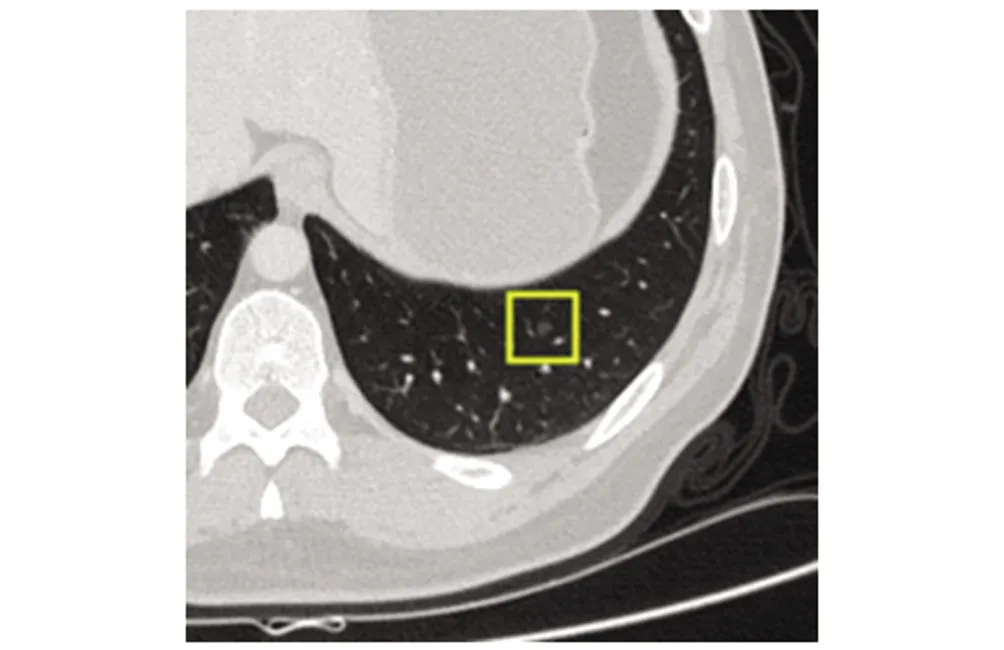
图3 男,45岁,左肺下叶磨玻璃结节,直径约4 mm;影像医师漏诊,AI实现检测Fig.3 Male, 45 years old. The ground glass nodule of the left lower lobe was about 4mm in diameter, which was missed by radiologist and detected by AI

图4 男,55岁;右肺上叶多支气管、血管旁结节,直径约7 mm,影像医师漏诊,AI实现检测Fig.4 Male, 55 years old. Multibronchi and paravascular nodule in the right upper lobe, about 7 mm in diameter, was missed by radiologist and detected by AI
2.2 病理结果及两种诊断方法对GGN定性诊断效能
123例患者经手术后共切除154枚磨玻璃结节,AI与影像医师均全部检出;包括浸润性腺癌42枚、微浸润性腺癌25枚、原位腺癌46枚、不典型腺瘤样增生23枚、良性磨玻璃结节18枚。计算AI、影像医师及AI联合影像医师诊断恶性GGN的效能情况见表2。
3 讨 论
本研究结果显示AI检测GGN的敏感度较高,且AI假阳性率很低。AI对恶性GGN诊断效能较弱,但AI诊断恶性GGN的敏感度高于影像医师,AI联合影像医师诊断恶性肺结节效能高于AI或影像医师单独诊断。
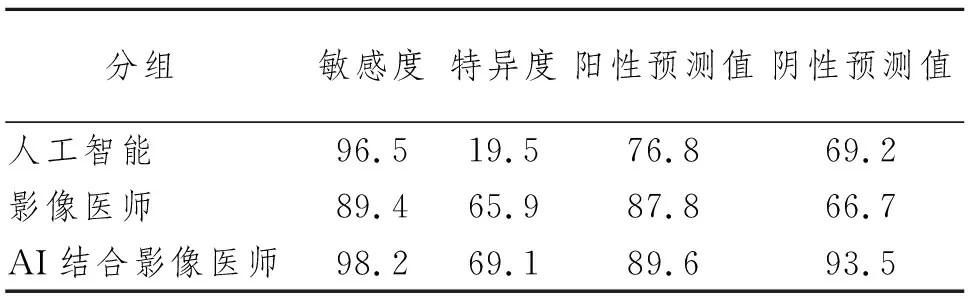
表2 AI、影像医师及AI联合影像医师诊断恶性GGN效能情况(%)
本研究中AI和影像医师对于≥5 mm的GGN检出敏感度均较高,特别是对于经手术切除的154枚GGN,AI和影像医师均全部检出,说明AI和影像医师对于较大的具有可疑恶性征象的GGN检出率较为相近;而对于<5 mm的GGN,AI检出的敏感度明显高于影像医师,分析其原因为人工智能经过大量的数据处理和学习,能自动对图像进行特征提取,获取其三维信息,并对GGN进行识别、定性;其次影像医师对于微小GGN的稍高密度影肉眼不敏感容易遗漏,不能长时间集中注意力不可避免的漏诊。本研究结果显示AI对恶性GGN诊断效能较弱,其原因为AI的特异度很低,即对良性GGN的诊断能力很差,可能因AI训练时良性GGN病例数不够,学习效果不佳,导致很多GGN误判为恶性;但是AI诊断恶性GGN的敏感度高于影像医师,影像医师对于正确诊断良性GGN方面优于AI,所以AI联合影像医师诊断可以提高GGN的总体诊断效能。
敏感度高的检测或诊断方法适用于若发生漏诊则会导致严重后果,或者用于筛查发病率低的人群[3]。蔡雅倩等[4]研究显示AI和住院医师检出GGN的敏感度分别为93.98%、65.20%,与本研究AI检出GGN的敏感度94.8%相似,但本研究医师检出GGN的敏感度更高为85.1%,原因可能为分组不一致,本研究的医师组为住院医师检测GGN后并由高年资医师审核。本研究AI假阳性率为每例胸部CT 0.14个结节,假阳性GGN主要表现为少许炎症、小叶中央结构、血管分叉聚集及迂曲伪影,以往少有文献报道。李甜等[5]研究显示AI和医师诊断恶性GGN的敏感度分别为91.5%、87.2%,特异度分别为57.1%、85.7%;其敏感度稍低于本研究结果,特异度较明显高于本研究,原因可能为深度学习模型的算法不同及样本量不同。本研究AI诊断GGN的特异度很低,如果仅参考AI检测结果进行随访甚至手术治疗,会浪费医疗资源、可能造成患者恐慌和焦虑,对这些结节进一步分析是否需要临床干预是医师所面临的问题;故AI对于良性GGN的诊断训练也应该加强。
GGN在高分辨胸部CT上表现为局灶性云雾状稍高密度影,又可以看到穿行其内的血管和支气管影,混合型GGN内可见局灶结节状软组织密度影。GGN的病理结果可能为局灶炎症、局灶性纤维化等良性病变,也可能为不典型腺瘤样增生、原位腺癌、微浸润性腺癌或浸润性腺癌[6];既往研究表明,持续存在的GGN具有很高的恶性风险[7];但是不典型腺瘤样增生、原位腺癌和微浸润性腺癌等浸润前病变术后5年生存率可接近100%[8-9],因此早诊断、早治疗显得尤为重要。本研究使用的AI软件基于卷积神经网络,可自动选择最佳三维图像特征,获得更多的肺结节特征,得到更高的检出率和更准确的定性诊断能力。蔡雅倩等[4]的研究表明AI联合医师诊断与医师单独诊断1例胸部CT所需平均时间分别为3.6 min、7.1 min,说明AI可以加快医师的诊断速度。虽然有很多关于人工智能取代影像科医生的推测,但目前人工智能在放射学中的大多数应用是作为影像科医生的助手[10]。近年来人工智能技术在医学影像领域的应用越来越广泛[11-13],其快速的检测、诊断速度和长时间高精度工作的优势[14-15],可以有效缓解影像医师阅片诊断的压力,将时间用于和患者沟通、与临床医师会诊等。本研究证实AI联合影像医师诊断GGN的效能高于AI或影像医师单独诊断,一方面AI对于GGN的检出和恶性结节诊断具有很高的敏感度避免结节漏诊,另一方面影像医师可以利用多平面重建等观察结节的大小、形态、边缘、密度、与支气管和血管的关系进行综合判断[16],故我们建议影像医师诊断工作中可参考AI的诊断结果。
本研究的局限性:(1)回顾性的收集肺GGN手术病例,存在一定的选择性偏倚;(2)由于原位癌、微浸润性腺癌可发展为浸润性腺癌,故本研究将病理结果为原位癌、微浸润性腺癌的GGN纳入恶性组中,可能存在一定的分组偏倚。
综上所述,AI检测GGN的敏感度较高,且AI假阳性率很低。AI诊断恶性肺结节的敏感度高于影像医师,AI联合影像医师诊断GGN的效能高于AI或影像医师单独诊断;因此,建议AI联合影像医师共同检出和诊断GGN。
