小鼠Cdc25B突变型S15A荧光表达载体的构建及鉴定
2021-07-15冯少青
冯少青,孟 峻
(1内蒙古医科大学附属医院临床检验诊断学教研室,呼和浩特 010059;2内蒙古医科大学附属医院检验科;*通讯作者,E-mail:nmfrank@163.com)
Cdc25B属于细胞分裂周期25(cell division cycle 25,Cdc25)磷酸酶家族,它可以通过激活细胞周期依赖性蛋白激酶(CDKs)来驱动细胞周期,并且可以参与细胞周期检查点的调控,其活性与其亚细胞定位和磷酸化状态有直接关系[1,2]。在哺乳动物细胞周期调控过程中,Cdc25B主要在有丝分裂G2-M过渡阶段激活CDK1-cyclin B而发挥作用[3]。Cdc25B已被证实是调节细胞周期进程的关键因子,它作为一种Thr/Tyr双特异性的保守性磷酸酶,对无活性的前有丝分裂促进因子磷酸酶发挥双重特异性作用,使之被修饰为具有活性的去磷酸化形式,进而恢复有丝分裂[4]。Cdc25B也被证实参与中心体复制和调控微管成核[5],并且是红细胞前体细胞周期的关键调节因子,作为靶基因参与红细胞的生成和分化[6]。
细胞周期失调是人类癌症的一个共同特征,它至少会导致癌症发展的两个特征,即不受控制的细胞增殖和基因组不稳定[7,8]。而Cdc25B在细胞周期调控中发挥重要作用,并且Cdc25B的过表达已在多种人类癌症中被观察到,并与较差的临床预后相关[9],这表明对Cdc25B的研究有助于更好地了解癌症的作用机制及发现新的癌症治疗靶点。Cdc25B的过表达是一个复杂的过程,其中S15A可能是造成其磷酸化的关键位点。此研究旨在构建Cdc25B的突变型Cdc25B(S15A)的荧光质粒,为进一步研究Cdc25B及其突变体在小鼠受精卵G2/M期的作用做准备。
1 材料与方法
1.1 仪器与软件
超净工作台(SW-OJ-2F,Airtech公司);超速离心机(Sigma公司);基因扩增仪(9600型,HEMA);电泳仪(JY600E,君意生物科技公司);CmSuite8(加拿大Corel公司);Sequencher(广州赢森生物科技有限公司)。
1.2 材料与试剂
pcDNA3.1-3xflag-Cdc25B(S15A)载体由本课题组合成;限制性内切酶(Thermo Scientific公司);微量琼脂糖凝胶DNA回收试剂盒(B518131-0100,上海生工);质粒小提试剂盒(B518191-0050,上海生工);PrimeSTAR Max Premix(2X)(R045A,TaKaRa公司);TaKaRa Taq(R001B,TaKaRa公司);ClonExpress Ⅱ One Step Cloning Kit连接酶(C113-2,诺唯赞公司);真核表达载体pcDNA3.1(+)、Stbl3感受态细胞(广州辉骏生物科技有限公司)。
1.3 实验方法
1.3.1 引物设计 结合实验需求,利用CmSuite8软件设计荧光基因EGFP和突变基因Cdc25B(S15A)的引物扩增序列(见表1),为进一步实验做准备。此引物由鸿讯生物合成。
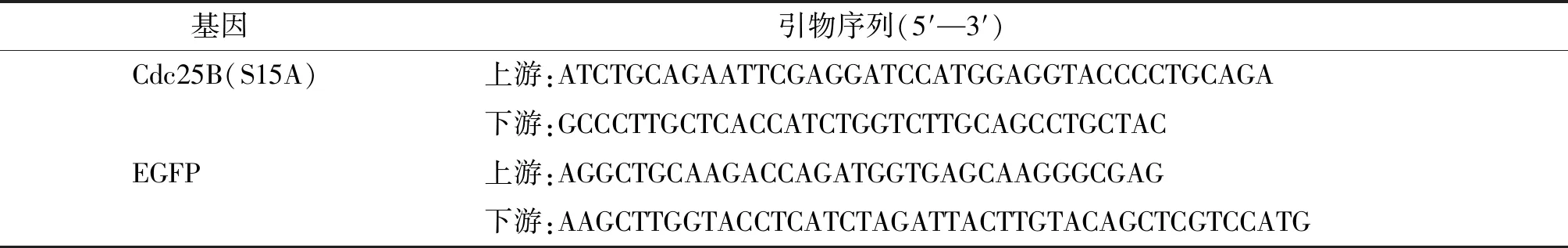
表1 PCR引物序列Table 1 Primer sequences for PCR
1.3.2 扩增EGFP目的片段 以含目的基因的质粒为模板,使用Prime STAR高保真酶,按照TaKaRa Taq试剂盒说明书的操作步骤进行PCR反应,扩增荧光标签EGFP,反应体系为:含EGFP的质粒模板50 ng;EGFP的上、下游引物各1 μl;Prime STAR Max(2×)10 μl,继续加入ddH2O定容总体积到20 μl。PCR反应的条件为:96 ℃预变性5 min,96 ℃变性20 s;60 ℃退火30 s;72 ℃ 1 min;72 ℃延伸3 min,进行30个循环,在16 ℃下保存扩增的EGFP片段。PCR成功扩增目的片段后,取扩增产物在1%琼脂糖凝胶电泳上扩增验证,电泳产物通过与DNA marker比对,判断是否扩增成功。
PCR产物回收:PCR产物经1%凝胶电泳后,在紫外灯下回收DNA目的片段,用手术刀小心地切取含目的基因片段的凝胶条带,放入1.5 ml EP管中,即得到EGFP荧光基因片段(具体步骤参照微量琼脂糖凝胶DNA回收试剂盒所附说明书)。
1.3.3 载体双酶切 向无菌的0.2 ml EP反应管中依次加入pcDNA3.1-3xflag-Cdc25B(S15A)载体5 μg;10×Buffer 5 μl;XbaⅠ和BamH Ⅰ各1.5 μl,继续注入ddH2O补充总体积到50 μl,于37 ℃下进行酶切反应60 min。载体酶切后,进行1%琼脂糖凝胶电泳检测。
酶切产物的回收:酶切产物经1%凝胶电泳后,在紫外灯照下,用手术刀仔细切取琼脂糖凝胶中所需的载体条带至1.5 ml干净的EP管中,按照微量琼脂糖凝胶DNA回收试剂盒所附实验步骤回收线性化的载体条带。
1.3.4 目的片段与载体连接 使用ClonExpress Ⅱ One Step Cloning Kit连接酶,连接目的基因EGFP片段与pcDNA3.1-3xflag-Cdc25B(S15A)酶切载体,向0.2 ml EP管中加入以下反应物:EGFP和酶切载体各100 ng;ClonExpress Ⅱ One Step Cloning Kit连接酶2 μl;5×ClonExpress Ⅱ Buffer 4 μl,继续加ddH2O使总体积达到20 μl,在37 ℃下进行连接反应30 min后,冰浴5 min,即得到连接产物,所得连接产物用于后续步骤。
1.3.5 感受态细胞的转化 于冰浴中解冻混匀Stbl3感受态细胞,用移液枪从中吸取100 μl至干净的EP反应管中,再吸取10 μl连接产物加入管中,将两者轻轻转动混匀,将管放入冰水中冰浴30 min,之后立即移入42 ℃水箱中水浴热休克60 s,快速将反应管转移至冰浴中2-3 min后将管取出,加入300 μl的LB培养基后混匀菌液,在37 ℃、200 r/min的振荡培养箱中振荡培养1 h,于超净工作台中,将菌液均匀涂布于含有Amp抗生素(100 μg/ml)的LB平板上,室温下平放至液体吸收,倒置平板于37 ℃的生化培养箱内培养过夜。
1.3.6 阳性克隆菌落的PCR鉴定及测序 于干净的EP管中配制菌检PCR混合液,向管中加入菌落1 μl;上、下游引物各1 μl(引物序列见表1);TaKaRa Taq Max 10 μl;加ddH2O 7 μl定容至20 μl。配好混合液后分别加到无菌的八连管内,于超净工作台内,选取8个单独的菌落,做好标记,用干净的小枪头,轻轻碰下平板内菌落的一边,把粘有菌的枪头,转移到有混合液的管内,轻轻摇动枪头,使菌能分散到液体中,之后弃掉枪头。进行PCR扩增反应:94 ℃预变性5 min;94 ℃变性30 s;60 ℃退火30 s;72 ℃1min;72 ℃延伸3 min,进行25个循环,保存于16 ℃。扩增完成后,往PCR管中加入2 μl 10×loading Buffer,取10 μl样品点样到1%琼脂糖凝胶中做凝胶电泳检测,并加入5 μl Marker做参照,对照Marker大小,选取正确的菌落摇菌以备测序。将菌落PCR鉴定得到的阳性克隆,送测序公司进行质粒DNA序列检测,测序完成后,利用Sequencher软件比对测序结果。
1.3.7 质粒的提取及酶切鉴定 经测序验证正确的阳性克隆,安排质粒小提,具体步骤见试剂盒说明书。配置反应液:向反应体系中加入10×Buffer 5 μl;荧光质粒pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP 2 μg;BamH Ⅰ和XbaⅠ各1 μl;继续加入ddH2O将反应总体积补充到20 μl,在37 ℃下进行酶切反应20 min。取5 μl Marker和25 μl的酶切质粒样品,经1%琼脂糖凝胶电泳检测。
1.3.8 细胞培养和转染 于37 ℃ 5% CO2的二氧化碳培养箱中培养DMEM培养液(含10 μg/ml链霉素,100 U/ml青霉素,10%胎牛血清)中培养HEK293细胞,待细胞密度达到80%以后将HEK293细胞转染至LipofectamineTM2000试剂盒,具体步骤参照说明书。放置24 h后,HEK293细胞可转染5 μg pc-DNA3.1-3xflag-Cdc25B(S15A)-EGFP DNA。
1.3.9 Western blot法检测pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP在细胞中的表达 于48 h后收集转染细胞中目的细胞并提取蛋白,利用BCA试剂盒检测蛋白浓度。取50-80 μg的蛋白样品,再按照比例加入上样缓冲液,沸水浴10 min,冷却、离心后在12%的分离胶中进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),在110 V 90 min下利用湿转法将其电转至PVDF膜。接着在TBST溶解的5%的脱脂奶粉和磷酸盐缓冲液下室温封闭1 h,4 ℃孵育一抗[单克隆抗体(1 ∶1 000),兔来源的Anti-Cdc25B单克隆抗体(1 ∶200)以及兔来源的抗β-actin]过夜,次日用TBST洗涤4遍(每次8 min),然后室温计时2 h孵育HRP标记的二抗(鼠抗兔的单抗IgG 1 ∶5 000),最后检测PVDF膜上蛋白的表达情况。
2 结果
2.1 荧光表达载体pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP的构建及鉴定
EGFP目的片段与pcDNA3.1-3xflag-Cdc25B(S15A)载体连接,经测序公司进行质粒DNA序列检测,结果显示目的基因插入正确,部分测序结果见图1。将构建好的荧光质粒pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP用XbaⅠ和BamH Ⅰ限制性内切酶鉴定,据琼脂糖凝胶电泳检测结果显示,观察到的条带位置与预期位置一致(见图2)。目的基因EGFP条带约位于3 300 bp,pCDNA3.1-3xflag-Cdc25b(S15A)载体条带约位于7 000 bp,与预期相符,进一步证明基因插入正确位置,成功获得pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP荧光表达载体,可用于体外转录。

图1 pcDNA3.1-3xflag-Cdc25b(S15A)-EGFP测序结果Figure 1 Sequencing results of pcDNA3.1-3xflag-Cdc25b(S15A)-EGFP
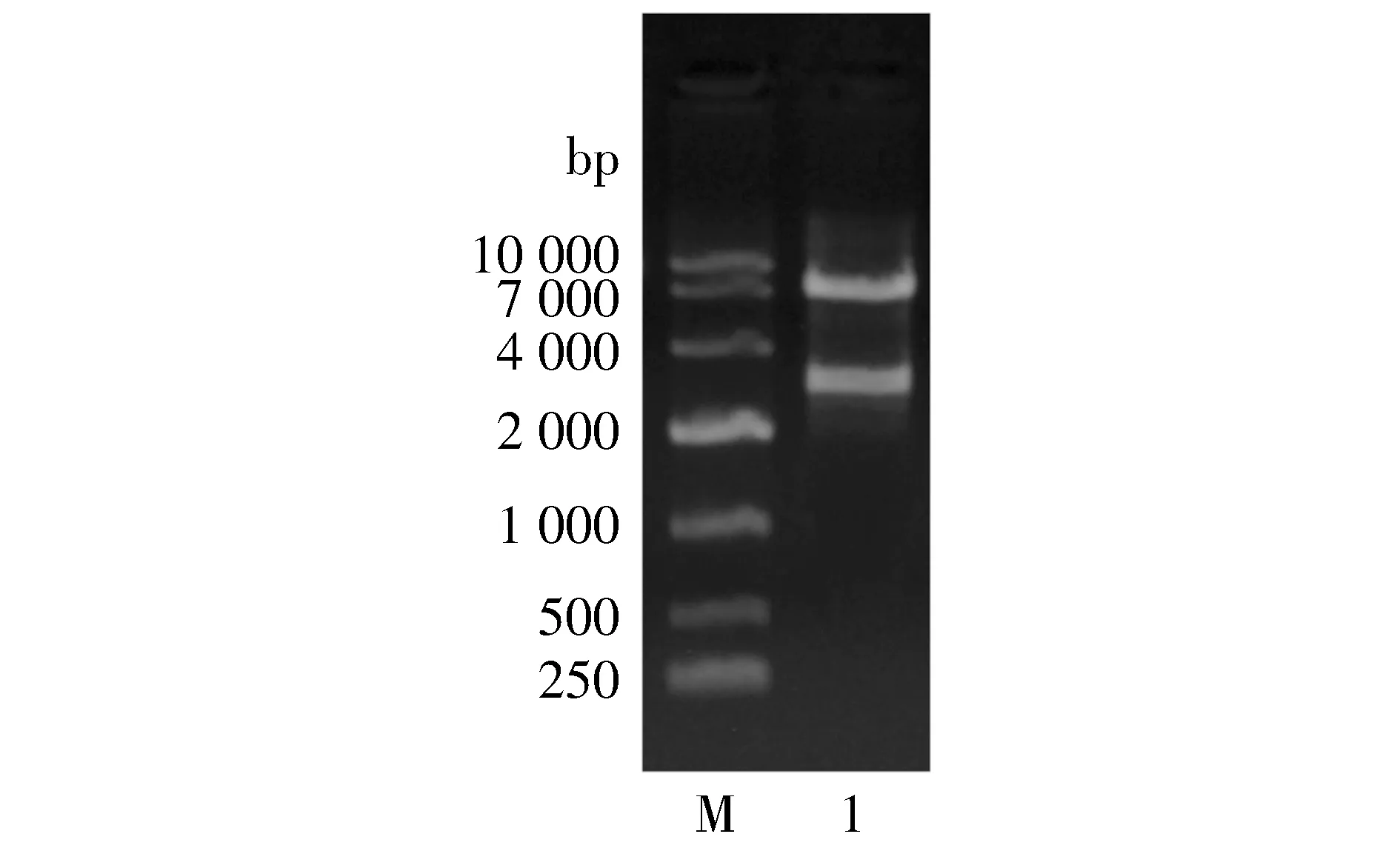
M.DL10000 DNA Marker;1.pcDNA3.1-3xflag-Cdc25b(S15A)-EGFP质粒DNA双酶切(BamH Ⅰ和Xba Ⅰ)产物图2 pcDNA3.1-3xflag-Cdc25b(S15A)双酶切结果Figure 2 Double digestion result of pcDNA3.1-3xflag-Cdc25b(S15A)
2.2 荧光表达载体pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP在HEK293细胞中的表达
通过脂质体法将扩增好的荧光质粒pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP转染至HEK293细胞中,利用Western blot法检测到,在转染了荧光质粒pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP的HEK293感受态细胞中,荧光标签-EGFP成功表达(见图3)。证明Cdc25B突变型S15A的荧光表达载体pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP成功构建并能够正确表达。

1.未转染组;2.空载体组;3.转染3xflag-Cdc25b(S15A)-EGFP组图3 3xflag-Cdc25b(S15A)-EGFP的HEK293细胞中的表达Figure 3 Expression of 3xflag-Cdc25b(S15A)-EGFP in HEK293 cells
3 讨论
Cdc25B是一个高度保守的双特异性磷酸酶,通过靶向CDK1(Cdc2)的Thr14和Tyr15来激活整个CDK1-Cyclin B复合物,从而驱动有丝分裂G2/M期的转变[10]。Cdc25B的N端与C端间具有两种特异性序列,分别是核定位序列和核输出序列,它们负责调控细胞周期进程中Cdc25B在胞浆、胞核之间的穿梭,Cdc25B在细胞减数分裂启动之前由细胞质进入细胞核,减数分裂启动后由细胞核重新回到细胞质[11]。Cdc25B的N端参与调控微管动力学和有丝分裂进程,C端最后20个残基具有很强的柔韧性,部分可以阻断活性位点并与蛋白核心建立瞬态接触[12,13]。此外,Cdc25B可受PKA的磷酸化或去磷酸化,调节其靶点CDK1的状态,从而调控细胞周期的进程[14]。
Cdc25B磷酸酶在一些人类癌症中高表达,包括卵巢癌、肝癌、肾癌、乳腺癌和食管鳞癌等[15-19],它参与调节细胞周期检查点,并成为新抗癌药物开发的可能靶点,然而,Cdc25B活性的测定方法和靶向Cdc25B的药物筛选方法仍存在一些问题。目前测定Cdc25B磷酸酶活性常用的方法是使用对硝基苯磷酸盐或邻甲基荧光素磷酸盐作为底物,但是由于这些底物是非特异性的,Cdc25B的活性经常被不准确地表达[20]。因此,Cairns等[21]开发了一种基于Western blotting的非放射性同位素测定方法,用CDK1适当地测量Cdc25B活性。在筛选抗癌药物时,为了避免出现假阳性或假阴性的结果,利用有效的方法检测Cdc25B的活性是必不可少的。
本课题组前期利用RNA干涉沉默Cdc25B基因后发现卵母细胞减数分裂发生阻滞,受精卵的G1期延长;但是显微注射Cdc25B mRNA后受精卵的卵裂率明显提高[22]。这些研究显示了Cdc25B在细胞周期进程中的重要作用,但其作用机制尚不明确,有待进一步研究。本实验化学合成Cdc25B突变基因S15A的荧光质粒,成功构建了荧光表达载体pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP。利用脂质体法将构建好的pcDNA3.1-3xflag-Cdc25B(S15A)-EGFP载体转染至Stbl3感受态细胞,通过Western blot法检测到Cdc25B突变基因S15A的荧光质粒成功表达。实验中合成的S15A荧光质粒有益于接下来对Cdc25B基因的研究,有助于更合理的设计Cdc25B的配体。课题研究成果应用于农牧业,可以提高动物的繁殖数量;应用于人类生殖辅助,可以提高体外受精成功概率,缩短体外受精时间,尽早植入人体;应用于肿瘤治疗,可以使肿瘤生长延缓G2期,提高肿瘤患者生存率。查阅文献发现,目前国内外对Cdc25B的了解尚不全面,因此需更深入地探究Cdc25B在细胞中的作用机制。
