显微镜辅助下精准切除术在裸鼠非局部晚期结肠癌中的应用
2021-07-15杨宇慎赵雪峰
文 丹,杨宇慎,汪 准,赵雪峰
(1大连大学附属新华医院普外科,大连 116021;2大连大学附属新华医院肛肠三科;*通讯作者,E-mail:zoserbong@163.com)
结直肠癌(colorectal cancer, CRC)是一种全球性的恶性疾病,每年约有140万新发病例,其中早期CRC的发病率正在逐年上升[1]。早期CRC被定义为可完全切除,且无邻近器官、淋巴结或远处部位受累的疾病[2]。但有相关研究指出,约16%的局限性黏膜下浸润性CRC可能早已存在淋巴结转移[3],这与患者术后复发和转移息息相关。Goodwin等[4]指出CRC患者术后3年内的复发率高达80%,其中约5%-35%的Ⅰ-Ⅲ期患者死于术后复发和转移。因此,早期的筛查和诊断、明确的分期、精准的治疗均影响着患者的预后。由于精准医疗理念的逐渐深化,针对早期恶性肿瘤的精准切除取得了一定的进展,如以前哨淋巴结活检(SLNB)为指导的精准切除在早期乳腺癌中的成功实施,这一理念也已被应用于胃癌、直肠癌等消化道肿瘤的治疗。为了进一步评估精准切除在早期结直肠癌(CRC)中的实用性,建立相应的实验动物模型或许是一个有效的方式。
近年来,越来越多的动物模型被应用于各种恶性肿瘤的机制阐述、药物疗效评估和新药开发等方面的研究。但是,因为实验鼠科动物的生理解剖局限,如肠管小、肠壁薄等,行肠切除手术难度较大,所以目前对CRC的手术模型仍停留在模型建立的初级阶段,且罕有报道。同时,随着生物医学研究的成像工具如MRI、Micro PET-CT和IVIS(invivoimage system)等的出现,实验动物模型的真实性和可信度也备受关注。在实验动物活体状态下通过非侵入性手段对体内标记的细胞或分子的变化进行实时检测和定量剖析,从而使肿瘤或疾病的发生发展过程直观化和图像化[5,6]。这不仅改变了过去以解剖为主要评价手段的形势,减少了人力、物力上的消耗,还为动物模型提供了更具说服力和可信度的直观化证据。事实上,已经有许多用荧光素酶标记的转移性肿瘤模型被报道[7-9]。因此本文中,我们尝试建立一种裸鼠非局部晚期结肠癌(non-local advanced colon cancer, NLACC)精准切除模型来模拟临床早期CRC的外科治疗情况,并通过组织病理学检测和影像学分析初步评估显微镜辅助下区段切除术(microscopic assisted limited colectomy, MALC)对NLACC裸鼠的疗效,从而验证MALC模型的技术可行性和肿瘤学安全性。
1 材料和方法
1.1 材料
CT-26-Fluc鼠源性结直肠癌细胞由大连大学附属新华医院实验中心提供;BALB/c品系裸鼠共20只,7周龄雌鼠,体质量18-20 g,由大连大学附属新华医院中心实验室代为购买。SMZ-B2/T2体视显微镜和异氟烷吸入麻醉药及动物麻醉系统均由大连大学附属新华医院中心实验室提供。
1.2 方法
1.2.1 细胞培养 CT-26-Fluc鼠源性结直肠癌细胞接种于100 mm培养皿中,并在37 ℃、5%CO2、含10%胎牛血清的RPMI-1640培养基内传代培养。每2-3 d更换一次培养液。培养细胞密度达80%-90%,用PBS润洗2次,经胰酶(0.25% Trypsin-0.53 mmol/L EDTA)消化后,1 500 r/min离心5 min。然后用无血清的培养基洗涤3次后再使细胞重悬。显微镜下计数,用无血清培养基调整细胞浓度至4×107/ml,均制备成1 ml细胞悬液。冰浴中保存,备用(30 min内完成接种)。
1.2.2 实验动物 参与模型的实验裸鼠共20只。所有实验裸鼠被安置在专用鼠类塑料笼上,不超过4只/笼;并在控制温度(21±2)°C、湿度(50±10)%和照明(12-12 h光暗循环)的条件下生长。试验开始前均保持1周的驯化期。所有小鼠的操作和治疗都是按照《实验动物管理和使用指南》中规定的程序进行的。该实验方案已获得大连大学附属新华医院伦理委员会批准。在研究结束时,所有裸鼠在全身麻醉下处死。
1.2.3 动物模型设计 制模前1周仔细了解BALB/c裸鼠生活习性,禁止一切刺激性操作。首先,建立稳定的原发性结肠癌裸鼠模型(NALCC模型);通过1周的观察期后,将这些模型随机分成两组,分别为MALC组和假手术组,每组10只;术后观察期为3周。观察期结束后所有实验裸鼠均被安乐死,并做组织病理学检查。
1.2.3.1 非局部晚期结肠癌(NALCC)模型的建立 实验裸鼠用异氟烷吸入麻醉,取下腹部正中切口约5-10 mm进入腹腔;用31G针将含2×106个CT-26-Fluc的细胞悬液约50 μl水平接种到20只BALB/c裸鼠的结肠壁黏膜下层和肌层之间。全程在SMZ-B2/T2体视显微镜下操作。注射部位位于距盲肠根部约30 mm的结肠(相当于人升结肠段)。针插入深度约为0.5 mm。注射完成后,逐层缝合关闭腹腔。
1.2.3.2 分组及其处理 NALCC模型建立后随机分为MALC组和假手术组,每组10只。1周后,MALC组施行显微镜辅助下以肿瘤为中心+周围水肿肠管切除的区段切除手术,切除范围为距肿瘤两侧缘约1 cm的肠段。收集切除肠段行术后病理检查,明确病变性质。之后行结肠两断端端-端吻合。结肠吻合完成后,反复确认吻合口血供、有无梗阻、出血、渗漏等。确认完毕后,逐层关腹。操作全程在显微镜辅助下完成,所用机械均为微创手术机械,如眼科无损伤镊、鼠类专用钛夹、肠钳或血管钳以及10-0血管缝线等。而假手术组施行显微镜辅助下单纯开关腹手术(MAOCS),不做肠切除。手术过程中注意维持裸鼠体温。
1.2.4 解剖裸鼠和观察指标 常规记录实验模型生存情况。手术3周后,在全麻状态下处死所有模型。解剖过程中记录血性腹水、腹膜、淋巴结及腹腔内脏器转移情况,注意结肠吻合口或原位瘤组织生长情况。同时,还需注意胸腔及颅内等腹腔外组织有无转移,凡可疑病灶均需及时取材送检。
1.2.5 生物发光图像 全麻和腹部皮肤消毒同上,利用无菌注射器将D-荧光素钾盐注入裸鼠腹腔内,约3 mg/只。IVIS活体成像系统和图像软件在6 min内即可对裸鼠体内肿瘤细胞生物发光信号进行收集和量化剖析,系统还可识别和测量感兴趣区域(region of interest value, ROI值)内的肿瘤大小和肿瘤细胞数量。
1.2.6 组织病理学检测 对所有从手术和尸检中获得的标本进行病理学检测。将标本固定、脱水、透明和浸蜡后用石蜡包埋,按4 μm厚度切片;再用苏木精-伊红染色(HE染色)后显微镜下观察检测。
1.3 统计学分析
2 结果
2.1 两组建模情况
BALB/c裸鼠NLACC模型成功率为100%(20/20),模型制作过程顺利,无1例死亡。术后结肠原位肿瘤组织病理学检测符合NLACC病理过程(见图1)。两组手术成功率和存活率均为100%。两组在术中无1例死亡,且MALC组术后3周无1例出现肠梗阻、穿孔、出血、吻合口漏或死亡等情况,提示MALC在技术上是可行的。
2.2 影像学检测分析
用IVIS系统定期检测两组模型术前和术后肿瘤的生物学信号(ROI值)。两组术前影像学检测提示NLACC模型的成瘤率为100%。影像学检测结果提示,术后MALC组的ROI值较假手术组显著下降,且较本组术前的ROI值明显降低;而假手术组术后ROI值较术前显著上升,且其敏感区域内的荧光面积呈进行性增大趋势,差异均具有统计学意义(F=1 319.537,P<0.01),提示MALC对裸鼠NLACC可达到近似根治性切除(R0)的疗效,且术后3周内无复发和转移(见图2)。
2.3 组织形态学和病理学检查分析
手术3周后,在全麻下处死所有实验裸鼠,并行组织病理学检测。其中,MALC组裸鼠腹腔内未见复发和转移病灶,且结肠吻合口愈合良好,无吻合口狭窄、近端肠管扩张和肠壁淤血等肠梗阻表现。病检显示吻合口符合瘢痕性愈合过程,肠壁未见肿瘤细胞浸润(见图3A-D)。而假手术组裸鼠的结肠原位瘤明显突出于结肠肠壁,肠壁水肿、淤血明显,所有裸鼠均呈现肠梗阻表现,病理学检测提示肠壁结构破坏严重,肿瘤细胞已浸及肠壁全层(见图3E-H);此外,假手术组裸鼠的腹腔内还可见散在的转移性病灶,其中有4例出现血性腹水,1例出现淋巴结转移,但未见肝转移和腹膜种植转移(见表1);血性腹水和淋巴结病检均可见肿瘤细胞。由此可见,MALC不仅可到达临床R0切除,且无吻合口狭窄、肠梗阻等手术并发症,术后复发及转移率也十分低。
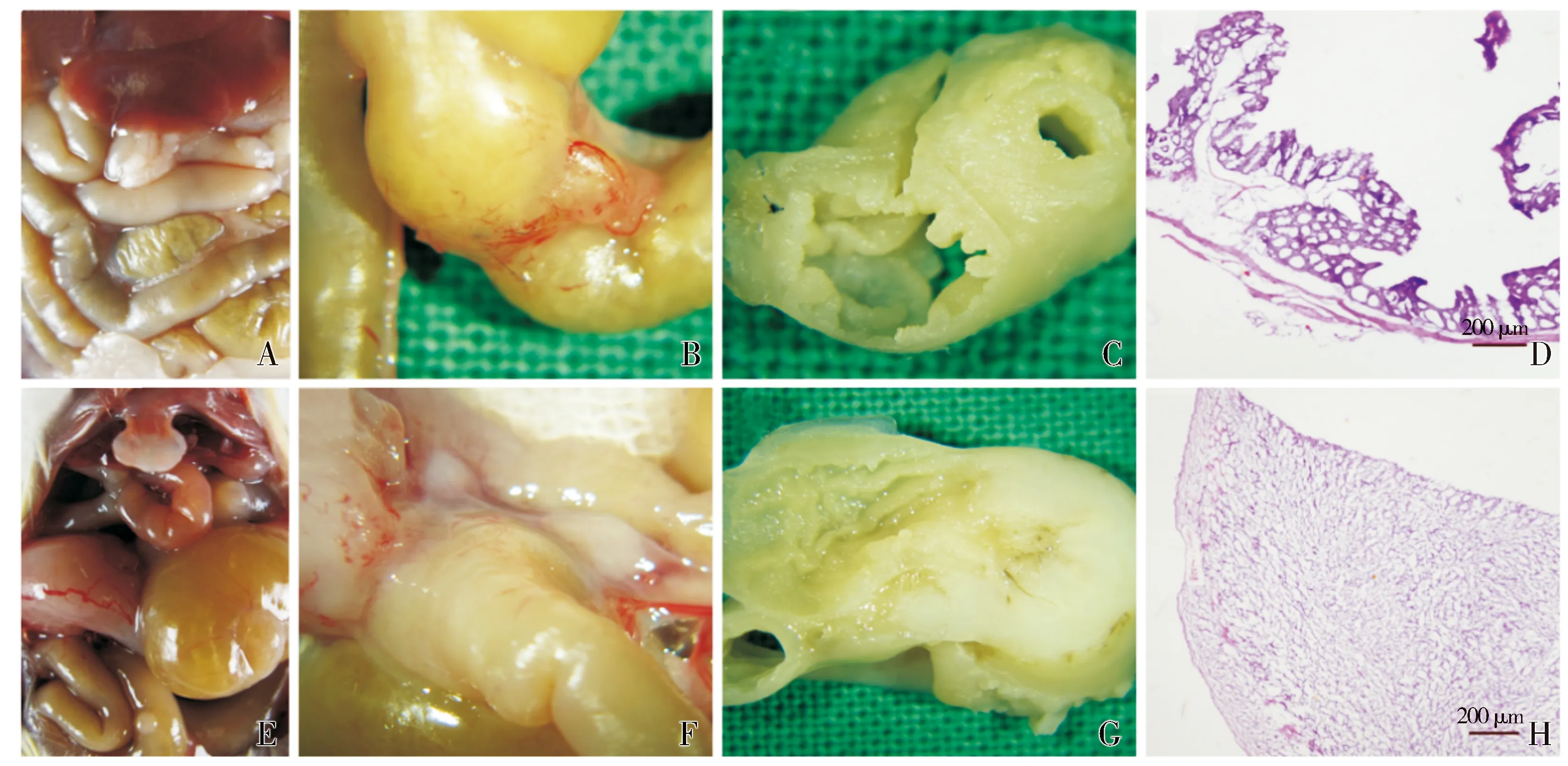
A-C.MALC组裸鼠的解剖,无腹水、复发、转移和肠梗阻;E-G.假手术组裸鼠的解剖,存在血性腹水、局部浸润和肠梗阻等情况;D,H.分别为MALC组吻合口肠壁的HE染色(可见正常上皮细胞)和假手术组梗阻肠壁的HE染色(可见癌细胞浸润)图3 两组裸鼠的组织标本大体观和镜下观差异Figure 3 Macroscopic and microscopic appearance of tumor tissues after microscope-assisted surgery

表1 两组结肠癌手术模型的组织病理学检测结果Table 1 Comparison of histopathological results between two groups
3 讨论
随着精准医学理念的不断深化,前哨淋巴结导航手术(SNNS)[10]已被成功应用于早期乳腺癌[11,12]和早期胃癌[13]等疾病的精准外科治疗。事实上,精准切除手术也已应用于较早期CRC的治疗,如内镜下黏膜切除术(EMR)、肿瘤的局部切除+前哨淋巴结清扫等。然而,目前这种精准化和缩小化的手术在结直肠癌临床应用中仍存在一些争议。因此,本研究通过构建理想的动物模型充分模拟结直肠癌病理学变化和其临床治疗情况,从而验证精准切除在裸鼠NLACC治疗中的可行性和安全性。
为制作精准切除模型,首要步骤就是理想的NLACC模型的制作。换句话说,我们应该选用与人结肠癌具有相似病理特征,并能充分模拟其临床治疗情形的动物模型。本实验中,我们通过原位细胞微注射(OCMI)程序在BALB/c裸鼠结肠壁的黏膜下层注射结直肠癌细胞株形成了NLACC模型。通过无菌微吸管(31G)将高浓度的结肠癌细胞直接原位注射在黏膜下层沉积,黏膜下层靠近黏膜层,即人类结肠癌起始部位[14,15]。进入到结肠局部微环境中的肿瘤细胞,一旦建立了正确的相互作用,就可以自由迁移,到达黏膜下丰富的淋巴管和血管,从而通过血流扩散至邻居器官或组织。这非常适合于需要在短时间内形成肿瘤的研究[16],也有助于提高肿瘤摄取率和传播率。本实验结果证实,裸鼠NLACC模型1周内的成瘤率为100%,且术后结肠原位肿瘤组织病理学检测符合NLACC病理过程(见图1)。因此,我们认为本研究建立的NLACC模型是一种能近似模拟人NLACC的有效模型。
此外,这类模型对于研究转移级联的后续过程也特别有效,包括淋巴或血源性转移和器官移植转移[17]。与转基因或基因敲除小鼠相比,我们的NLACC模型不仅可在短期内形成肿瘤,而且更易发生侵袭和转移。根据影像学检测,我们的NLACC模型制作后2 d即可检测到肿瘤信号,5 d即可显示出明显的肿瘤轮廓,且肿瘤大小随时间延长呈进行性增长趋势。而转基因小鼠形成肿瘤前需较长的潜伏期(1.5-2年),而且是在小肠中而不是大肠,同时常显示出与人类不同的继发性基因突变[18]。而相比于肿瘤碎片结肠浆膜包埋方法(SOI),OCMI表现了不同的传播能力的差异。虽然SOI能较早地发生转移,但它只在肝脏或肝脏引流淋巴管中产生肿瘤灶[19,20],却不能诱导向肺或结肠引流的淋巴管传播。相反,OCMI程序允许肿瘤细胞浸润肠壁的淋巴管,然后经肠系膜淋巴结-血流扩散-腹膜或远处器官内形成转移灶,如在人类结肠癌中观察到的那样[21]。并且,SOI模型因种植部位的限制,无法近似模拟早期结肠癌。本实验中未发现肝转移和其他远处器官转移,这考虑与细胞株本身的转移能力和观察期长短有关。已有研究表明,使用人结直肠癌细胞株的OCMI模型,可见较多的肝转移和其他转移[16]。因此,我们认为本研究建立的NLACC模型可近似地模拟临床早期结肠癌的病理学变化过程。不仅如此,在建模中,采用了全麻、全程显微镜下操作、成角注射和局部加压等细节上的处理以及前期的大量预实验,也大大提高了模型的可信度和准确性。
近年来,虽然动物模型种类越来越多,但目前还没有关于结直肠癌动物手术模型的报道。因此,我们在模拟临床早期结肠癌病理过程的基础上建立了一种裸鼠NLACC的精准切除模型,即MALC模型。实验的设计理念来源于早期结肠癌的肿瘤局部切除+前哨淋巴结清扫和早期直肠癌的全系膜切除术的精准切除概念的更新[22,23]。由于啮齿动物自身的局限性,难以用肉眼或放大镜进行精确的根治性手术,我们选择了以肿瘤为中心的局部切除和周围水肿肠管切除的区段性切除手术。根据本实验结果,MALC组模型施行MALC手术,假手术组施行MAOCS手术,虽然两种手术刺激强度不同,但是两组模型在术后3周内均无1例死亡,考虑手术刺激强度对结果影响较小;不仅如此,MALC模型术后无肠穿孔或梗阻、出血、感染和吻合口漏等并发症的出现,且其术后无复发和转移。病理学和影像学检测均显示相同结果。这提示MALC精准切除手术不仅具有可操作性和有效性,其在肿瘤学行为上也具有安全性和可靠性。临床研究数据表明,仍有部分局限性黏膜下浸润性结肠癌可能存在淋巴结转移,而且一些新的无症状的肿瘤也存在持续的风险,如晚期腺瘤和早期错时结肠癌[24],而这些往往因漏诊而失去最佳治疗时机,本研究建立的模型或许可以为此提供研究基础。此外,为了提高模型的可靠性,我们还做了很多其他的工作。首先,全麻的选择有利于手术的顺利实施。其次,显微镜放大倍数可达4-40倍,可保证手术视野的清晰度。接下来,针对小鼠的特殊手术器械和精细缝线也为实施精准手术提供了有利条件。同时,为了掌握显微镜下肠吻合技术,我们从断开橡胶手套的连续缝合到显微镜下实验小鼠肠管的熟练吻合进行了大量的初步实验。因此,我们相信我们的MALC模型在技术层面上是可行的,在肿瘤学行为上也十分安全可靠的。
综上所述,针对裸鼠非局部晚期结肠癌的精准切除手术MALC不仅能达到根治性切除疗效,其术后并发症发生率和肿瘤复发率均较低。换句话说,本研究建立的MALC模型不仅在技术上具有可行性,而且其在肿瘤学行为上具有安全性和可靠性。同时,我们认为MALC模型可以被视为是一种可量化和可靠的非局部晚期结肠癌精准手术模型,可用于评价新基因治疗、化疗和放疗的相关研究。这是动物模型研究的新尝试和突破。我们欢迎其他研究人员复制我们的模型,并利用它们开发新的治疗策略。
