光学相干断层成像指导钙化病变介入治疗策略
2021-07-13曹成富马玉良李琪赵红刘健卢明瑜宋俊贤王伟民
曹成富 马玉良 李琪 赵红 刘健 卢明瑜 宋俊贤 王伟民
冠状动脉钙化病变是动脉粥样硬化中普遍存在的炎症和修复过程的一部分,是动脉粥样硬化的特异性表现。钙化病变尤其是严重钙化病变明显增加了介入治疗的难度和风险,被称为“导管室的恶梦”。目前临床常见的识别和评估冠状动脉钙化病变的影像学手段包括冠状动脉CT血管造影(coronary computed tomographic angiography,CTA)、冠状动脉造影(coronary angiography,CAG)、血管内超声(intravenous ultrasound,IVUS)以及光学相干断层成像(optical coherence tomography,OCT)等,早期、准确地识别、评估钙化病变,对评估钙化病变严重程度,选择适当的介入治疗技术,提高手术成功率,减少手术相关并发症,改善患者近期/远期预后具有重要意义。本文将系统综述OCT在指导钙化病变介入治疗中的作用。
1 钙化病变的流行病学
冠状动脉钙化随年龄增加而增加,流行病学资料显示,在40~49岁人群中的发生率约为50%,60~69岁人群中的发生率约为80%[1]。在一项纳入13项研究7978例介入治疗患者的荟萃分析中显示,约有29%的患者合并有中重度钙化病变[2]。在包括ACUITY研究和HORIZONS-AMI研究的6855例患者中,中重度钙化病变的检出率为32%[3]。中重度钙化病变常见于高龄、肾功能不全、糖尿病、既往行冠状动脉旁路移植术的患者。
2 钙化病变对介入治疗的影响
严重钙化病变可引起器械通过困难,明显增加冠状动脉夹层和穿孔的发生风险。钙化斑块是引起支架膨胀不全的最主要原因,明显增加支架内再狭窄和支架内血栓形成的发生风险[4]。一项包括6855例患者的研究发现,与冠状动脉造影无明显钙化的患者相比,中重度钙化患者全因死亡(4.6%比2.8%,P=0.0002)、心原性死亡(3.1%比1.8%,P=0.001)、支架内血栓形成(2.7%比1.7%,P=0.008)、靶病变血运重建(8.2%比6.0%,P=0.02)的发生率明显增加[3]。
3 OCT实现钙化病变的精准评估
CAG是临床工作中评价冠状动脉钙化病变最常用的检测方法,其诊断钙化病变的特异度高达89%,但是敏感度不高[5]。一项纳入1155处病变的研究中,CAG仅能发现38%的钙化病变,而IVUS/OCT可发现73%的钙化病变[6]。另一项研究显示,只有当OCT发现钙化病变的最大钙化弧度>101°,钙化长度>4 mm,钙化厚度>0.57 mm时,才能在CAG中被发现[7]。腔内影像学手段在识别钙化病变上比CAG有更高的敏感性和特异性,并且能够更加准确地评估钙化病变的容积。
OCT采用近红外光纤成像,根据测量红外光线的回波延迟时间和强度,来描述冠状动脉病变的特点,具有成像速度快和分辨率高的优势,其空间分辨率可高达10~20 μm,是IVUS的10倍左右,对评价冠状动脉斑块具有重要价值,其诊断钙化病变的敏感度为96%,特异度为97%[8]。钙化斑块在OCT图像上具有低背反射和低衰减的特性,通常表现为边缘锐利的低信号或不均匀区域。根据形态的不同可分为浅表钙化、深层钙化、环形钙化、点状钙化和结节样钙化等(图1)。OCT成像根据钙化斑块的范围、深度等特征,将其分为以下四种类型:(1)环形钙化,指钙化斑块角度>270°;(2)点状钙化,指钙化角度<90°,长度<10 mm的钙化;(3)深层钙化,指钙化斑块距离管腔超过100 μm;(4)浅表钙化,指钙化斑块距离管腔65~100 μm。
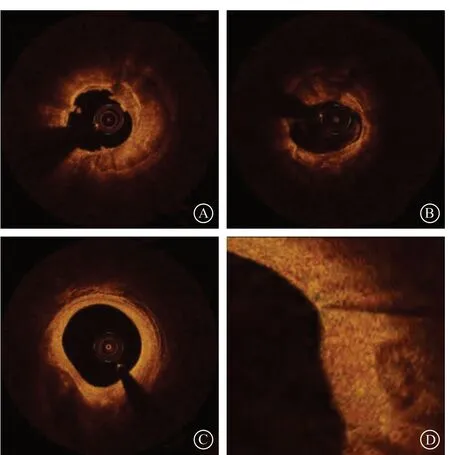
图1 不同钙化病变光学相干断层成像影像 A. 环形钙化;B. 偏心钙化;C.深层钙化;D. 点状钙化
在急性冠状动脉综合征中,钙化病变所致可以占到10%[9]。目前引起急性冠状动脉综合征的钙化病变大致上分为以下三类:(1)爆发样钙化结节,表现为大量簇状的小钙化结节突出管腔,导致纤维帽破裂,血栓形成;(2)钙化性突起,指突出于管腔的块状钙化突起,没有簇状的小钙化结节存在;(3)表层钙化片,位于表层的片状钙化斑块,通常无明显的簇状结节和块状突起,表面覆盖非常薄的纤维帽,其纤维帽是撕裂或不连续的(图2)。
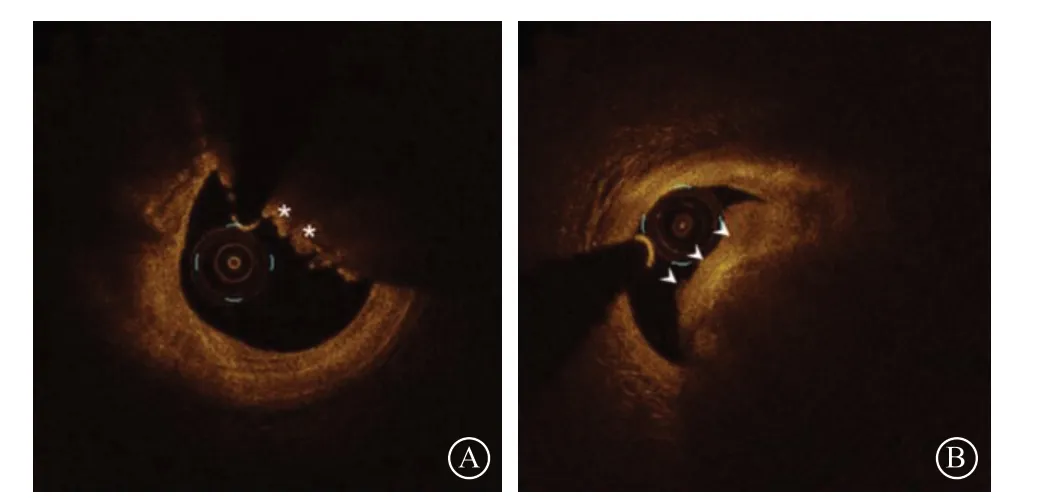
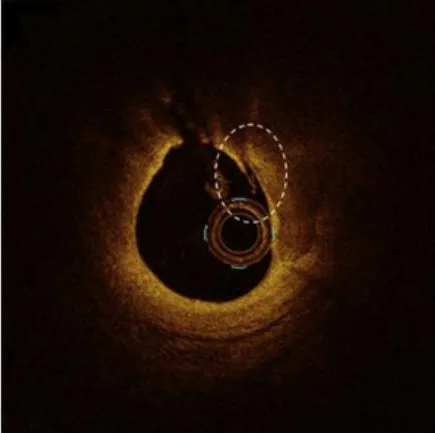
图2 急性冠状动脉综合征钙化病变的光学相干断层成像图 A. 爆发样钙化结节;B. 钙化性突起;C. 表层钙化片
与IVUS相比,OCT评估钙化病变的优势在于能够评估钙化病变的厚度,这对指导选择恰当的预处理策略有重要意义。但由于近红外光穿透能力较弱,当钙化斑块厚度较厚时(超过1.2~1.6 mm),OCT近红外光的衰减影响光穿透斑块的能力,有时会观测不到钙化斑块后缘的钙化轮廓。或当钙化斑块混有脂质成分时,由于脂质成分富含红细胞成分,也会影响光线对钙化斑块的穿透,从而影响OCT对钙化斑块厚度的评估能力(图3)。
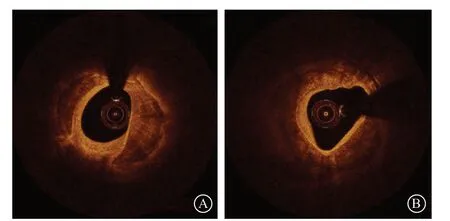
图3 OCT对钙化厚度的测量 A. OCT可精准测量钙化厚度;B. 7点~10点方向钙化厚度超过OCT评估能力
4 OCT指导钙化病变预处理策略
单纯的深层钙化大多对介入治疗的影响不大,可按常规操作,一般无需旋磨等特殊处理。钙化角度小于180°的浅表钙化一般也不需要旋磨治疗,但由于钙化侧血管顺应性的下降,在进行球囊预扩张时容易导致对侧血管壁严重的夹层(图4)。有研究显示,对于钙化角度小于180°的中度钙化病变,如果最大钙化厚度超过0.88 mm,仍可导致明显支架膨胀不全(支架膨胀率<80%),并且经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后支架可呈现为“D”字形(图5)[10],对于此类偏心钙化病变,只要PCI术后能够获得足够的支架内最小面积,一般不强求采用非顺应性球囊进行高压力扩张,球囊高压扩张有导致血管破裂的风险[11]。随着冠状动脉血管内碎石术的推广及应用,今后针对此类严重偏心钙化病变,可先行冠状动脉血管内碎石术对钙化病变进行消蚀,有助于改善介入术后的支架形态及支架膨胀率[12]。
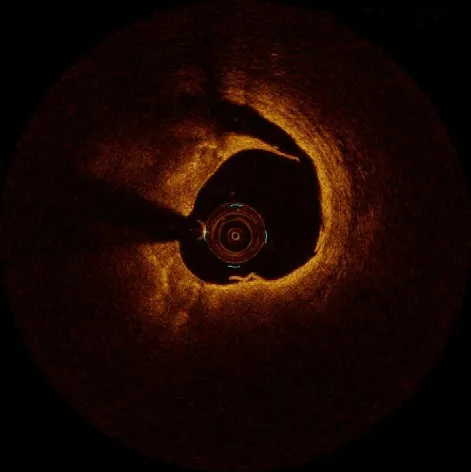
图4 偏心钙化球囊扩张后血管夹层
OCT发现的钙化角度>180°的浅表钙化,特别是环形钙化病变,会影响器械的通过和支架膨胀,影响手术成功率及患者远期预后,此时需要对病变进行充分的预处理。对于OCT发现的厚度小于0.3 mm的环形钙化病变,一般不需要进行旋磨治疗,单纯应用非顺应性球囊、切割球囊或棘突球囊等高压扩张即可出现钙化环断裂[13]。另有研究表明,对于OCT显示钙化厚度为0.4~0.5 mm的环形钙化,单纯应用棘突球囊也能实现钙化环的断裂(图6)[14]。但对于较厚的环形钙化病变,建议主动行冠状动脉斑块旋磨术进行充分预处理。
需要强调的是,不能单纯通过OCT测量的最大钙化厚度来选择不同的预处理策略,严重环形钙化病变能否实现钙化环的断裂,除上述钙化厚度外,还受到最大钙化角度、钙化病变长度等影响。Fujino等[15]对128例钙化病变患者在PCI术前后进行OCT检查,结果显示,术前OCT检查如果最大钙化角度>180°、病变长度>5 mm、最大钙化厚度>0.5 mm,则存在较高的支架膨胀不全风险,并得到OCT钙化积分系统:当最大钙化角度>180°时为2分,≤180°时为0分;钙化厚度>0.5 mm时为1分,≤0.5 mm时为0分;钙化长度>5 mm时为1分,≤5 mm时为0分。该研究表明,当该钙化积分为4分时,支架平均膨胀率只有69%。
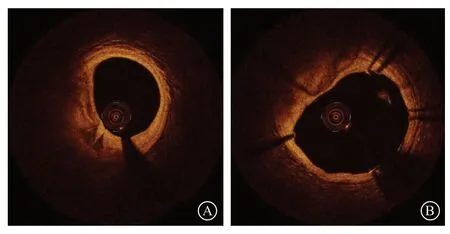
图5 偏心钙化支架术后“D”字形 A. 光学相干断层成像示偏心钙化斑块;B. 支架置入术后呈“D”字形
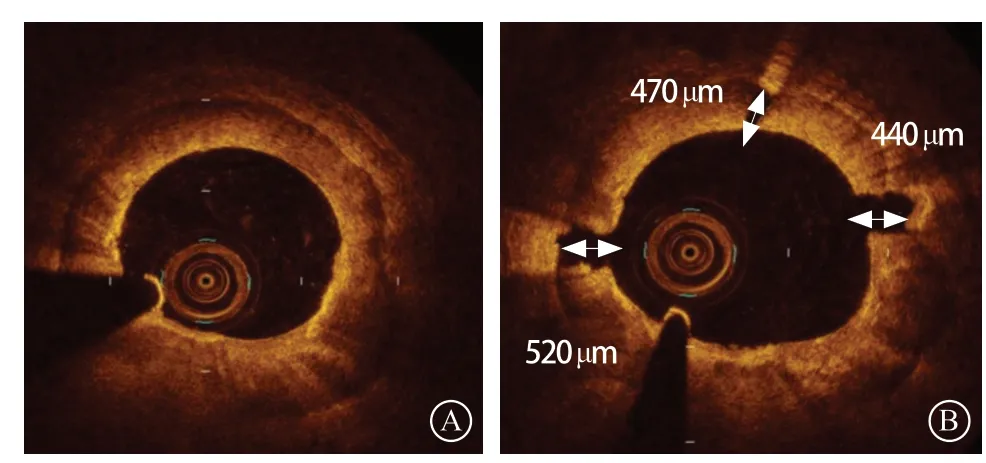
图6 钙化厚度为0.4~0.5 mm,棘突球囊扩张后出现钙化环断裂 A. 光学相干断层成像示环形钙化病变,钙化厚度为0.4~0.5 mm;B. 棘突球囊扩张后出现钙化环断裂
5 OCT指导钙化病变旋磨治疗
5. 1 启动旋磨治疗的时机
基于Fujino等[15]的研究结果,2020年美国心血管造影和介入学会共识指出,对于CAG显示中重度钙化病变,或者球囊不能扩张的病变,推荐常规使用腔内影像学检查进行评价。当OCT提示钙化病变最大钙化角度>180°,最大钙化厚度>0.5 mm,钙化长度>5 mm时,建议行冠状动脉斑块旋磨术对病变进行充分预处理[16]。
此外,对于钙化结节等特殊类型的钙化病变,由于其突出管腔且形状不规则,可能会导致器械通过困难、球囊破裂、支架脱载、支架膨胀不全、支架置入后不规则、甚至血管破裂等严重并发症发生。因此,结合本中心的经验,如果OCT发现有介入治疗适应证的钙化结节,建议直接行冠状动脉斑块旋磨术进行预处理,避免反复操作导致并发症发生。
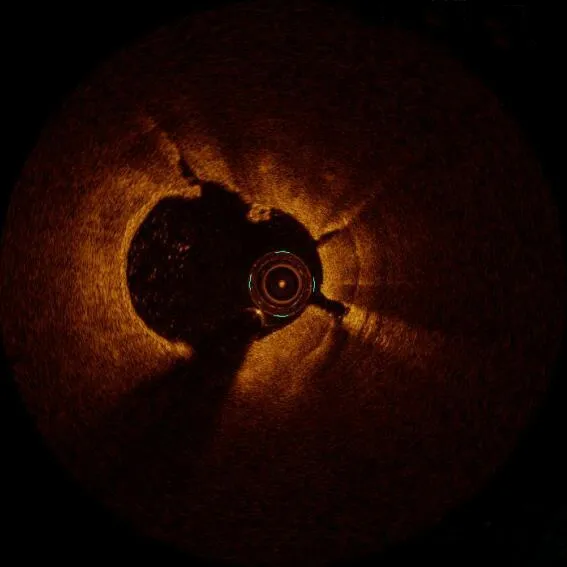
图7 钙化环断裂
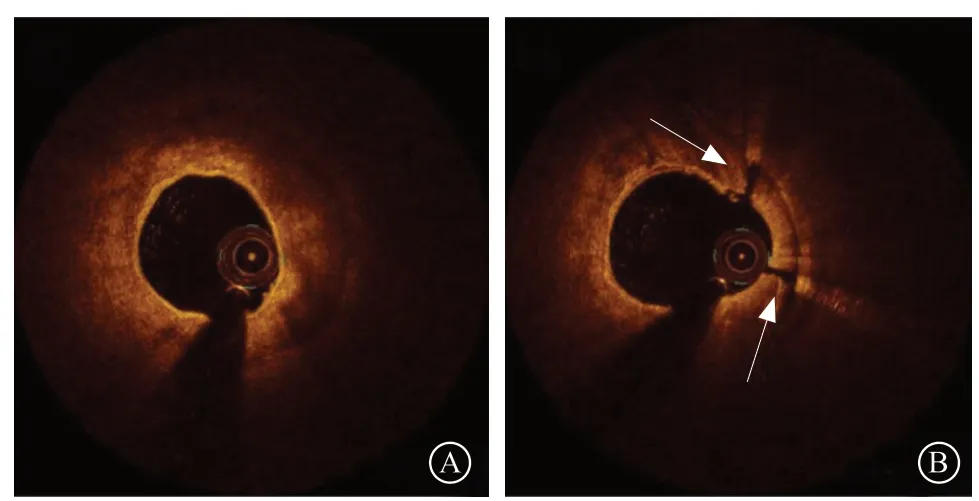
图8 旋磨后出现钙化环断裂,但球囊不能充分膨胀 A. 光学相干断层成像显示环形钙化病变;B. 旋磨后出现钙化环断裂(箭头所示);C.球囊不能充分膨胀
5. 2 评价旋磨治疗效果
建议在旋磨操作结束后常规行OCT检查评估旋磨效果,可出现两种情况。(1)OCT发现钙化环断裂(图7):冠状动脉斑块旋磨术后能否出现钙化环断裂是影响支架膨胀的关键因素。有研究显示,出现钙化环断裂的患者,支架膨胀率要显著高于没有出现钙化环断裂的患者[(0.88±0.17)比(0.78±0.18),P=0.03][17]。因此,在旋磨后OCT显示出现钙化环断裂可以作为终止旋磨操作的适应证之一,但最终需要球囊是否能够充分扩张病变来验证。也有少部分极严重钙化病变患者,尽管出现钙化环断裂,但球囊仍不能充分膨胀(图8),需进一步通过升级旋磨头、准分子激光冠状动脉斑块销蚀术等方法来充分销蚀钙化斑块。(2)OCT未发现钙化环的断裂:目前冠状动脉斑块旋磨术的理念是斑块修饰[5],旋磨头/参考血管直径的比值为0.4~0.6,因此1.5 mm旋磨头可适用于多数患者。这也导致了很多患者在旋磨术后并不能出现钙化环断裂。但这并不意味着一定要升级旋磨头进行再次旋磨操作。在钙化病变经过旋磨修饰后,当钙化角度和厚度达到特定值时,再行球囊扩张往往可出现钙化环断裂。一项纳入36例严重钙化病变的研究显示,在进行冠状动脉斑块旋磨术后,如果最大钙化角度>227°、最大钙化厚度<0.67 mm,可预测球囊扩张后出现钙化环断裂[18]。另有研究显示冠状动脉斑块旋磨术联合切割球囊比旋磨后联合非顺应性球囊能使更厚的钙化环发生断裂,切割球囊是能够出现钙化环断裂,并最终获得更好的支架膨胀率(旋磨联合切割球囊78.9%,旋磨联合非顺应性球囊66.7%,P<0.01)的独立预测因素[19]。
本中心在临床实践中积累了大量OCT指导钙化病变介入治疗的经验,基于上述循证医学证据及本中心的经验,制定了OCT指导钙化病变介入治疗流程图(图9)。对于旋磨术后无钙化环断裂的患者,如果OCT评估最大钙化厚度<0.6 mm,可以首先尝试非顺应性球囊扩张;如果OCT评估最大钙化厚度为0.6~0.8 mm,可尝试应用非顺应性球囊、棘突球囊、切割球囊进行扩张;经过上述操作,绝大多数患者均可出现钙化环断裂并最终顺利置入支架。对于OCT评估钙化厚度仍>0.8 mm的患者,可尝试非顺应性球囊、棘突球囊、切割球囊等进行扩张,但较多患者仍然存在“狗骨头形”球囊影像,且有可能导致血管夹层等并发症,影响后续操作。因此,建议对于初次旋磨后钙化厚度>0.8 mm的患者,首先考虑升级旋磨头再次进行旋磨。
6 OCT评价钙化病变介入术后效果
钙化病变是导致支架膨胀不全的最重要原因,进而导致支架内再狭窄或支架内血栓形成。OCT可精准评估支架置入后的效果。Kobayashi等[20]研究显示,OCT指导的旋磨治疗效果优于IVUS指导的旋磨治疗。该研究纳入了209例需进行旋磨治疗的冠状动脉严重钙化病变患者,分为OCT指导组(88例)和IVUS指导组(121例),结果显示OCT指导组的即刻支架膨胀率显著高于IVUS组[(83±15)%比(72±16)%,P=0.004],随访1年后由于缺血驱动的靶病变血运重建率OCT组也更低(6.8%比11.6%,P=0.25)。本中心对比OCT与IVUS指导的冠状动脉斑块旋磨术结果同样显示,OCT指导组比IVUS指导组可以获得更高的支架膨胀率[(82±8)%比(75±10)%,P=0.002][21]。一系列的研究说明OCT在旋磨后可以更清楚地判断钙化病变修饰情况,进而选择不同的治疗策略,从而能获得较好的支架膨胀率。
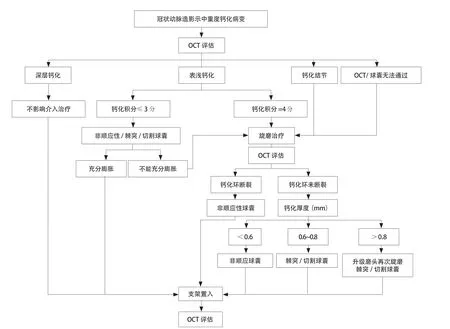
图9 OCT指导钙化病变介入治疗流程图
综上所述,OCT可实现对钙化病变解剖及形态特点的精准评估,对于指导钙化病变的介入治疗策略、评估旋磨治疗效果、评价支架置入术后效果等方面具有重要意义,实现钙化病变介入治疗的全程优化。我们建议对于冠状动脉造影中重度钙化病变,常规应用OCT进行评估,参照图9所示OCT指导钙化病变介入治疗流程图,以达到最佳的介入治疗效果。
