房间隔缺损大小二维经胸超声心动图、二维及三维CT血管造影测量对比研究
2021-07-13宋会军刘琼金敬琳宋宜萤李世国闫朝武徐亮万俊义徐仲英
宋会军 刘琼 金敬琳 宋宜萤 李世国 闫朝武 徐亮 万俊义 徐仲英
介入封堵已成为继发孔型房间隔缺损(atrial septal defect, ASD)的主要治疗方法。近年来,标准的操作方案在国内已被逐渐简化,不但球囊测量技术被弃置,经食管超声心动图(transesophageal echocardiography,TEE)也少有使用[1]。在阜外医院结构性心脏病中心,二维经胸超声心动图(two -dimensional transthoracic echocardiography, 2D-TTE)已成为ASD介入治疗的主要评估及监测工具,必要时辅之以CT血管造影(CT angiography,CTA)检查。相关研究表明,术前三维CT横断序列辅助测量(three dimensional CT axial sequence assisted measurement, 3D-CTAS)与传统球囊测量相比差异无统计学意义,但因临床上测量方法各异,且通常将ASD长径作为其直径, 因而2D-TTE及2D-CTA测量与3D-CTAS测量值之间并未显示极强的相关性[2]。本研究以封堵术后封堵器腰部直径CT测量值(postoperative occluder-waist dimension measured on CT, DCT-POD)为参考标准,通过比较二维和三维测量的术前ASD横径(a)、上下径(b)及等效圆直径(efficient diameter,ED),进一步阐明各测量方法的精确性、相关性及偏倚,有利于理解2D-TTE及2D-CTA测量偏倚产生的可能原因,更精准地选择封堵器型号。
1 对象与方法
1. 1 研究对象
回顾性研究自2015年1月至2019年12月在阜外医院成功行ASD封堵术的成年患者,包括:(1)单发继发孔型ASD;(2)不合并房间隔瘤;(3)患者术前在本院除行常规检查外,均行心电门控CTA检查;(4)成功封堵术后第2天,除常规复查心电图、TTE及X线胸片外,均行心电门控CTA检查。
1. 2 术前心脏CTA检查
本研究患者主要以西门子双源CT(Somatom Definition Flash. Simens Healthcare, Erlangen,Germany)行心电门控下对比剂增强扫描,扫描层厚为0.75 mm。心脏CT数据的冠状动脉及ASD三维重建、二维和三维测量均应用阜外医院PACS系统所装配的GE工作站(Adw 4.6)完成。(1)ASD的2D-CTA测量:将35%RR间期的CTA数据导入三维重建系统,在横断面序列测定ASD的横径最大值2D-CTAa,在矢状面序列测定ASD在上下方向的最大径2D-CTAb,作为ASD的二维测量值。(2)ASD的3D-CTAS测量:将35%RR间期的CT数据导入三维重建系统,采用CTAS技术进行三维测量[3]。进入三维重组界面,在横断面自头足方向滚动断层图像,将ASD最早出现的位点定为起始点,继续滚动观察ASD,将缺损最低点定为测量终点,系统将自动生成沿ASD上下方向最大值3D-CTASb;同时在横断面上选择测量ASD最大值3D-CTASa(与2D-CTAa相等)。(3)ASD ED的计算:由于ASD通常为椭圆形,故需通过转换公式推算出ED,作为ASD直径,ED=短径+2×(长径–短径)/3[4]。
1. 3 介入治疗术中TTE监测及介入封堵方法
(1)介入治疗术中TTE监测及二维测量:使用荷兰PHILIPS iE33型彩色多普勒超声诊断系统,超声心动图检查应用2~4 MHz探头,在常规检查切面及观察项目的基础上,重点观察剑下四腔心切面及剑下心房两腔切面,前者主要测量ASD在横断面上(或前后径)的最大值2D-TTEa,后者用以测定ASD上下方向的最大值2D-TTEb。
(2)介入封堵手术操作:ASD封堵手术操作方法参考既往文献[5]。结合术前CTA及术中TTE所测得的ASD大小选择相应型号的封堵器,以TTE指导封堵器置入、释放及疗效评价。使用的ASD封堵器分别为深圳先健科技公司20枚、华医圣杰公司17枚及上海形状记忆合金材料有限公司35枚。
1. 4 术后CTA复查及测量
成功封堵后,患者于术后第2天除常规行TTE、心电图及胸部X线复查外,再次行心电门控CTA对比剂增强扫描。扫描及三维重建方案同上述,以35% RR间期重建图像,并以3D-CTAS技术测量封堵器腰部直径,其横径及上下径分别表示为DCT-PODa及DCT-PODb,因二者基本相等,故以DCT-POD代换DCT-PODa,以之作为参考值,并据此将研究对象分为两组:A组: DCTPOD<20 mm;B组: DCT-POD≥20 mm。
1. 5 统计学分析
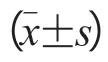
2 结果
2. 1 患者基本情况
共有132例ASD患者术前、术后均行心电门控CTA检查,最终共对72例(男27例,女45例,平均年龄46岁,18~72岁)不合并房间隔瘤的单发继发孔型ASD患者进行研究,其中A组22例(男10例,女12例,平均年龄57岁,范围33~72岁),B组50例(男18例,女32例,平均年龄46岁,范围18~66岁)。上述患者中37例ASD后下缘长度≤3 mm;15例为采用带孔封堵器治疗的合并重度肺动脉高压患者,20例为ASD合并冠心病同时行介入治疗的患者。
2. 2 患者数据比较
对于ASD直径,ED-TTE、ED-CTA和EDCTAS与DCT-POD均有良好的相关性(r=0.93、r=0.97及r=0.98),ED-TTE和ED-CTA均明显小于DCT-POD[(–5.09±3.45)mm,P<0.05;(–1.74±2.26)mm,P<0.05],ED-CTAS与DCT-POD相比则差异无统计学意义[(–0.13±1.89)mm,P=0.56]。横径a:2D-TTE与3D-CTAS测量值在A组中[(–1.83±2.37)mm,P<0.001]及B组中[(–2.64±4.69)mm,P<0.001]的差异均有统计学意义,但其差值在两组间差异无统计学意义(P=0.611)。上下径b:2D-TTE与3D-CTAS测量值在A组中[(–2.23±2.30)mm,P<0.001]及B组中[(–7.31±5.22)mm,P<0.001]的差异均有统计学意义,且其差值在两组间差异有统计学意义(P<0.001);A组2D-CTA与3D-CTAS测量值的差异无统计学意义[(–0.28±1.34)mm,P=0.341],B组则差异有统计学意义[(–2.64±4.36)mm,P<0.001],且其差值在两组间差异有统计学意义(P<0.001)。绘制ED-TTE、ED-CTA及ED-CTAS与参考标准DCT-POD之间的散点图,以及两组2D-TTEb及2D-CTAb与3D-CTASb之间的相关性散点图(图1~图3)。
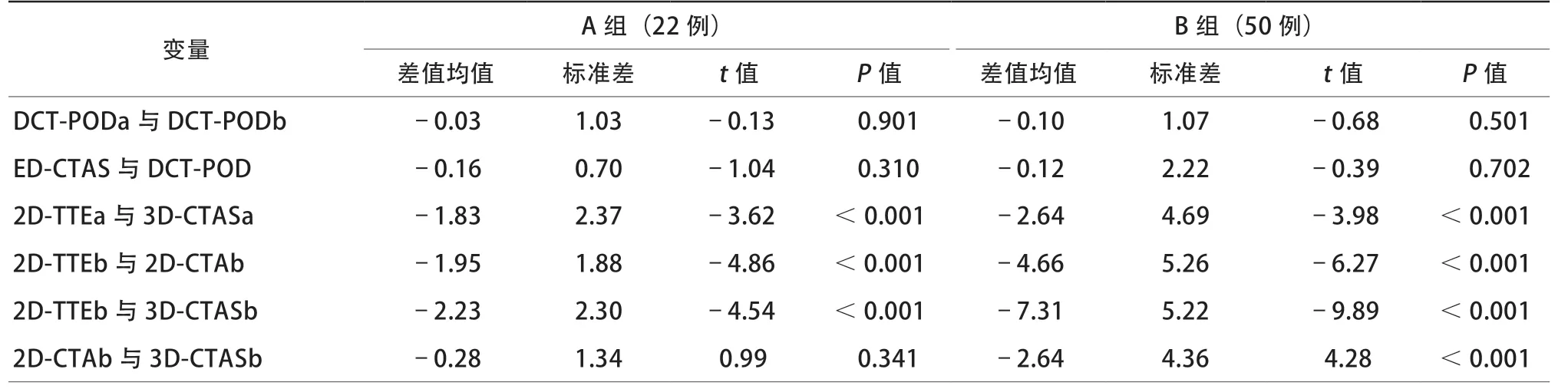
表1 不同测量方法的测量值比较(mm)
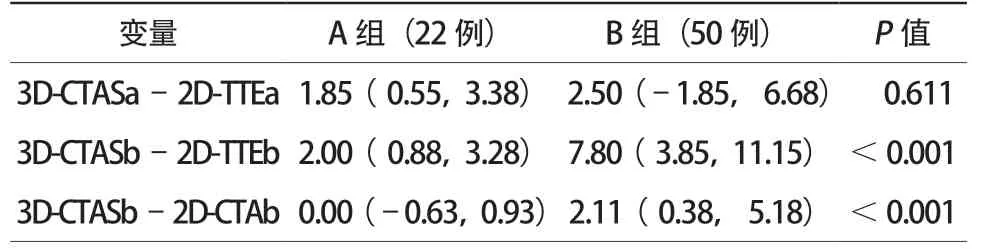
表2 不同测量方法的测量值差值在两组间比较[mm,M(Q1,Q3)]
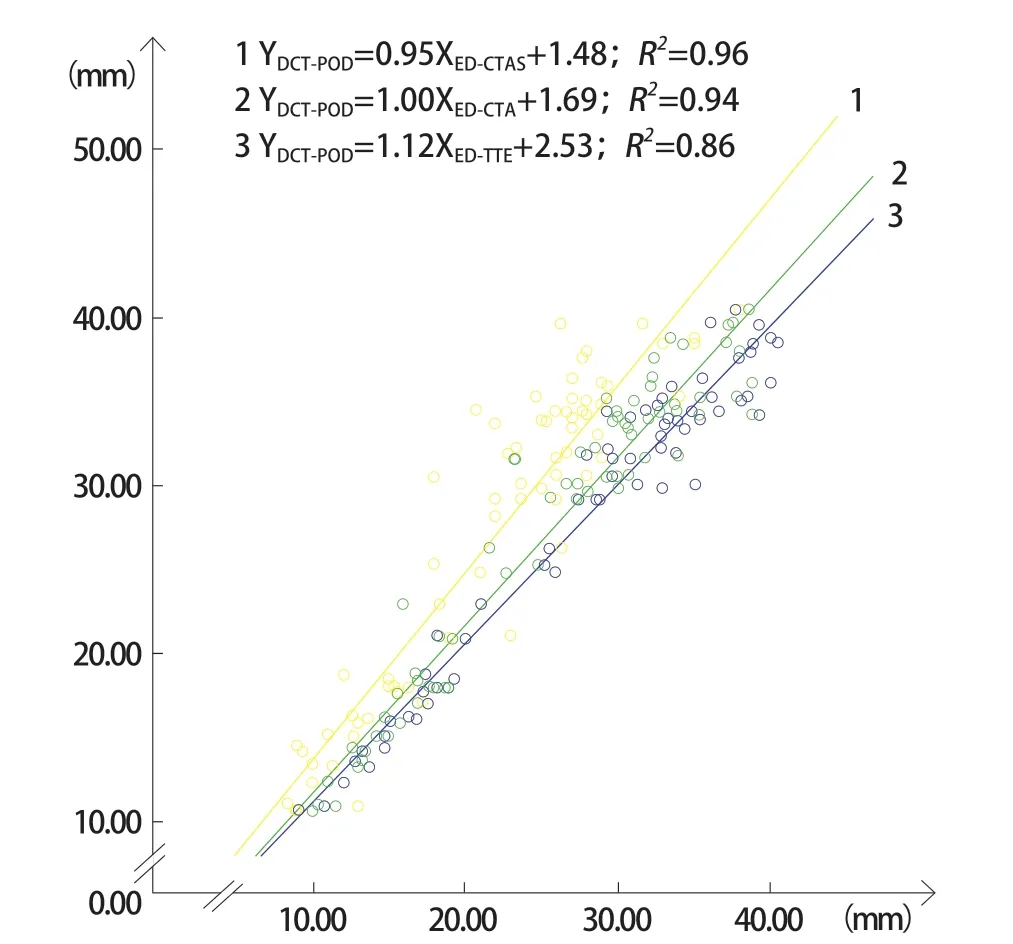
图1 直线及方程1表示ED-CTAS与DCT-POD散点图拟合曲线及回归方程。直线及方程2表示ED-CTA与DCT-POD散点图拟合曲线及回归方程。直线及方程3表示ED-TTE与DCT-POD散点图拟合曲线及回归方程。显示EDCTAS与DCT-POD测量值基本相等,而ED-CTA及ED-TTE测量值均明显小于ED-CTAS测量值,且随缺损增大,ED-TTE及ED-CTA与ED-CTAS之间偏倚增大
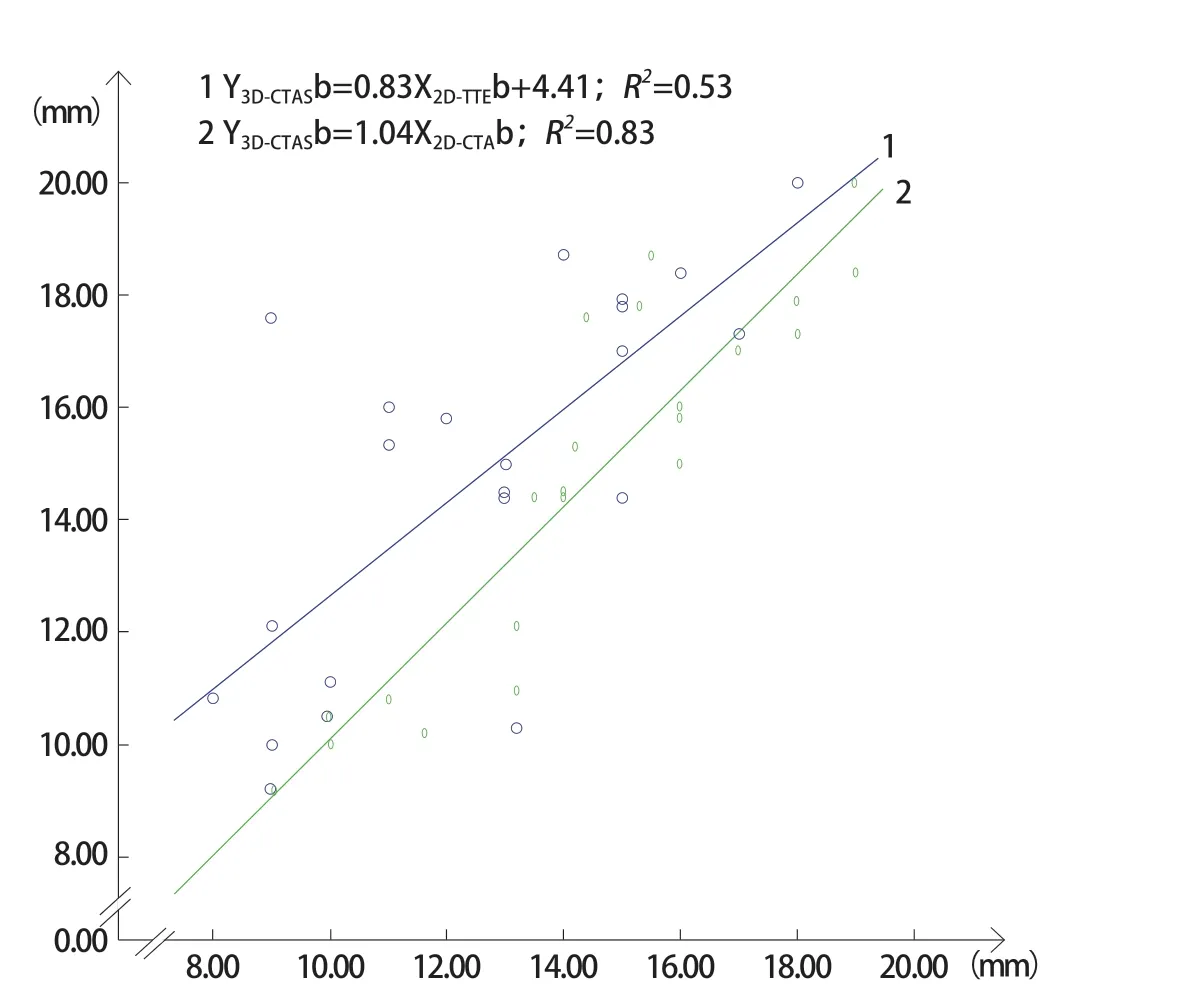
图2 直线及方程1表示A组3D-CTAS测量的房间隔缺损上下径及2D-TTE测得的上下径散点图拟合曲线及回归方程。直线及方程2表示A组3D-CTAS测量的房间隔缺损上下径及2D-CTA测量的上下径散点图拟合曲线及回归方程。显示A组房间隔缺损上下径3D-CTAS测量值与2D-CTA测量值没有显著区别,明显大于2D-TTE测量值
2. 3 A组与B组患者中病例报告
对A组50岁女性ASD患者,分别应用2D-TTE、3D-CTAS及2D-CTA测量的ASD上下径,见图4~6。对B组23岁合并重度肺动脉高压女性ASD患者,分别应用2D-TTE、3D-CTAS及2D-CTA测量的ASD上下径,见图7~9。
3 讨论
本研究首先通过将2D-TTE、2D-CTA及3D-CTAS测得的ASD直径与参考标准DCT-POD对比,不但证明了3D-CTAS测量和DCT-POD没有显著性差异,可以作为测量ASD大小参考标准,也证明了2D测量与3D-CTAS测量间存在明显的偏倚。因此,将3D-CTAS测得的ASD横径和上下径转化为ASD测量的间接参考标准,进一步研究2D-TTE及2D-CTA与3D-CTAS所测横径及上下径间的相关性及偏倚,能更好地理解其回归关系,在临床工作中能更准确地选择封堵器,减少严重并发症的发生[6],具有重要临床意义。
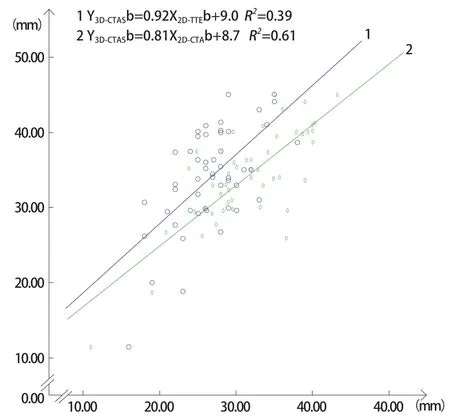
图3 直线及方程1表示B组3D-CTAS测量的房间隔缺损上下径及2D-TTE测得的上下径散点图拟合曲线及回归方程。直线及方程2表示B组3D-CTAS测量的房间隔缺损上下径及2D-CTA测量的上下径散点图拟合曲线及回归方程。显示B组房间隔缺损上下径3D-CTAS测量值明显大于2D-CTA及2D-TTE测量值
本研究表明,与3D-CTAS相比,2D-CTA测量值较小,有明显的偏倚;进一步比较两组患者2D-CTA与3D-CTAS测量值差值,亦有显著性差异。由于二者测量横径的方法相同,因而偏倚是上下径测量结果不同造成的,其中主要原因在于CTAS技术在横断序列辅助下,能准确确定ASD的最高点及最低点,因而能切实测定ASD上下径长度。2D-CTA在矢状面上测量的ASD上下径,更接近于三角形的一条直角边,而3D-CTAS测量的上下径本质上是直角三角形的斜边,因而测量结果通常大于2D-CTA测量值。此外,房间隔本身是个不规则的结构,ASD越大,在同一平面上的可能性越小。因而对于A组患者,缺损多处于同一平面,形状亦相对规则,因而2D-CTA与3D-CTAS测得的上下径长度相近,差异无统计学意义; 反之,B组患者很少处于同一平面,形状亦相对不规则,二者测出的结果有显著性差异。
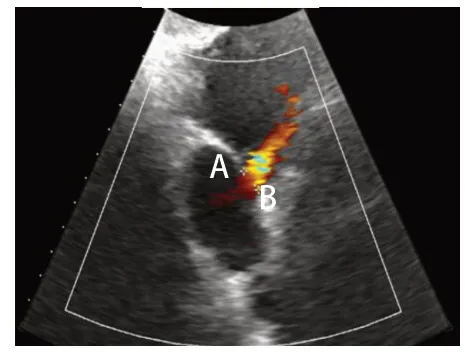
图4 二维经胸超声心动图于心房双腔心切面示房间隔缺损上下径9.19 mm(AB之间)
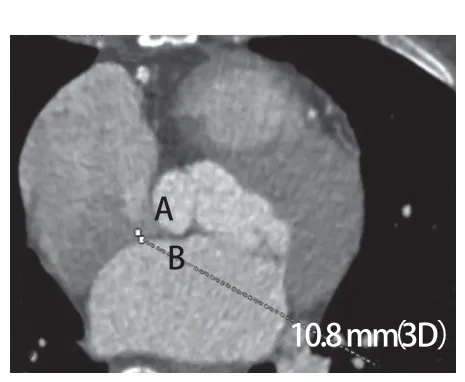
图5 三维CT横断序列辅助测量显示房间隔缺损最高点A在最低点B所在平面的投影,系统在确定B点后自动生成AB之间的距离(10.8 mm)
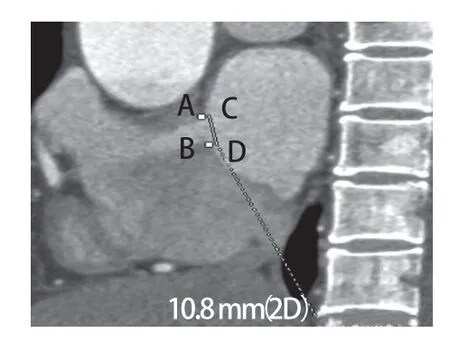
图6 二维CT血管造影显示房间隔缺损在矢状面上二维测量的结果(线段CD,10.8 mm),以及A、B两点在矢状面上的投影位置,显示A点与C点距离较近,B点与D点基本重合
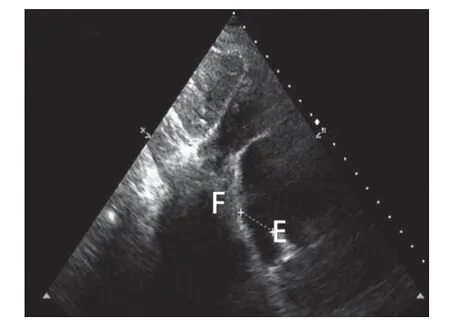
图7 二维经胸超声心动图于心房双腔心切面示房间隔缺损上下径22.4 mm(FE之间)
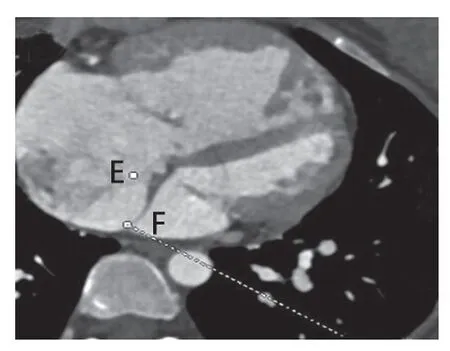
图8 三维CT横断序列辅助测量显示房间隔缺损最高点E在最低点F所在平面的投影,系统在确定F点后自动生成E、F之间的距离(36.3 mm)
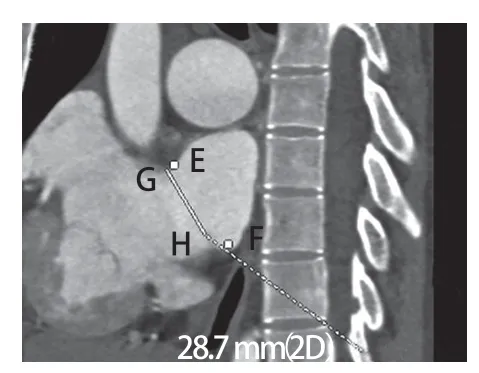
图9 二维CT血管造影显示房间隔缺损在矢状面上二维测量的结果(线段GH,28.7 mm),以及三维CT横断序列辅助测量E、F两点在矢状面上的投影位置,显示E点与G点距离较近,F点与H点距离较远
本研究亦显示,与3D-CTAS相比,2D-TTE测量值更小,偏倚更显著,且小于2D-CTA测量值。无论是横径还是上下径,2D-TTE测量值均明显小于2D-CTA,分组对比结果显示,无论是在A组还是在B组,2D-TTE测量值均小于2D-CTA测量值,且差异有统计学意义;究其原因,考虑与CT成像的部分容积效应有关。部分容积效应是指在不同组织交界区CT测量值与实际值出现偏差的现象,容积效应使得ASD的软边融入CT值较高的对比剂中,使ASD的薄边或软边被消融掉,与金标准测量封堵器腰部将缺损软边挤向周边原理一样,CT测量的ASD直径亦与参考标准相近;而测量差值在两组比较,差异无统计学意义,则更支持与部分容积效应有关。在B组缺损上下径测量方面,2D-TTE与3D-CTAS相比,差异更显著,考虑除了部分容积效应之外,还与上述造成2D-CTA与3D-CTAS测量差值的原因有关。既往研究表明,CT观察较大ASD后下缘优于2D-TTE及TEE,本研究进一步深化了这一结论[7]。
应注意的是,3D-CTAS测量方法能准确地判定缺损的边缘点,不仅决定了其在测量缺损大小方面优于其他方法[8],还提供了鉴别下腔静脉窦型ASD与后下缘短缺的继发孔型ASD的新手段[9]。尽管二者的鉴别诊断方法及前者是否适合介入封堵仍存争议[10],但能否准确测量缺损大小无疑是手术能否成功的重要因素。此外,应充分利用CT观察解剖结构的优势,排除冠心病、肺静脉异位引流及其他可能合并的心脏畸形和肺部病变[11],实现CT一站式评估ASD的价值[12]。需要特别强调的是,由于3D-CTAS与2D-TTE的测量差异是系统性的偏倚,因而依据其选择封堵器亦应参考球囊测量选择封堵器方法,而非沿袭2D-TTE的选择封堵器经验。
本研究存在一定局限性。首先,观察病例总数相对有限,特别是A组入选病例较少。其次,由于检查结果的操作者依赖性,患者在术前多次2D-TTE检查均有一定差别,本研究采用的缺损大小为术中封堵前最后一次的2D-TTE测量结果。再次,巨大ASD所带来的一系列显著的病理改变,包括右心房室增大、瓣膜反流及肺窗改变,也可能影响2D-TTE对ASD的评估。此外,本研究群体为中老年患者,儿童患者通常声窗较好,单纯针对ASD的CTA检查较少,本研究仅供参考。
总之,3D-CTAS测量ASD大小与参考标准没有明显差异,其优于2D-TTE及2D-CTA的关键是能准确测量ASD上下径并消除其薄弱边缘。
