BAG-1在中耳胆脂瘤中的表达及意义*
2021-07-13马亦飞丁家秀鲜志芃何星辰顾萍喻国冻
马亦飞 丁家秀 鲜志芃 何星辰 顾萍 喻国冻
中耳胆脂瘤是一种角化复层鳞状上皮来源的囊样病变,不同厚度的上皮组织堆积在基质周围,过度角化与杂乱无章的角蛋白纤维层堆积,形成了炎症反应包裹的囊性肿物[1]。中耳胆脂瘤具有破坏邻近骨质的特征,并可能引起严重的颅内外并发症,如迷路炎、面瘫、乙状窦血栓性静脉炎等[2,3],可能危及生命。因此,多年来其发病机制一直备受关注,但目前尚未明确,分子生物学机制主要有上皮细胞过度增殖、骨质破坏吸收及胆脂瘤上皮细胞凋亡的观点[4]。骨质破坏主要有破骨细胞活化,压力坏死,酸裂解,酶介导以及炎症介质等理论观点[5],近年来的研究趋向于胆脂瘤上皮凋亡被抑制[6],提示胆脂瘤细胞与正常表皮角化细胞的内在区别可能是它们具有侵袭性并不断扩张造成骨质破坏以及易复发的根源[5]。Bcl-2结合抗凋亡基因(BCL-2-associated athanogene 1,BAG-1)作为一种细胞凋亡相关蛋白,在肝癌、肺癌、乳腺癌、食管癌等多种恶性肿瘤中都有高表达,与预后、治疗效果密切相关[7,8]。但在良性病变中研究较少。本研究采用免疫组化染色的方法,检测BAG-1在中耳胆脂瘤中的表达并研究其与胆脂瘤骨质破坏的关联性,从细胞凋亡与骨质破坏角度探讨中耳胆脂瘤的发病机制。
1 资料与方法
1.1临床资料 标本取自2019年5月~2020年1月贵州医科大学附属医院耳鼻咽喉科头颈外科34例后天性中耳胆脂瘤患者,均经手术治疗,术中证实胆脂瘤发病部位为上鼓室,术后经病理证实。所有患者均知情同意参与研究。其中,男15例,女19例;年龄13~50岁,平均30.47岁;左耳19例,右耳15例;耳流脓史0.6~18年,1例出现骨膜下脓肿并发症。根据术中所见参照Saleh等[9]对听小骨破坏程度分级的建议分4级:O0级听小骨完整;O1级砧骨被腐蚀、听骨链中断;O2级砧骨及镫骨弓均破坏;O3级锤骨柄与砧骨缺如、镫骨弓破坏。本组O0级5例,O1级8例,O2级12例,O3级9例。选取同期行清创缝合术的12例耳外伤患者作为对照组,所取标本部位均为外耳道软骨段皮肤,均为外耳道软骨段撕裂伤后再缝合需修剪掉的皮肤,对患者自身病情及愈后无影响,所有患者均知情同意且后期妥善处理。本研究通过医院伦理委员会批准。
1.2实验方法 将标本常规固定,石蜡包埋,4 μm厚连续切片,常规HE染色。常温下免疫组化染色,采用SP法,主要步骤:①二甲苯脱蜡,酒精梯度水化。双蒸水洗3次,每次3分钟。②抗原修复,用0.01 mol/L,pH7.25~7.45的柠檬酸钠液,微波炉解冻15分钟,双蒸水冲洗3次,每次3分钟,洗后孵育10分钟。③PBS冲洗3次,每次3分钟,滴加BAG-1多克隆抗体浓度比为1∶100,4 ℃温度下过夜。④PBS再冲洗3次,每次3分钟,加二抗50 μl,常温下孵育25分钟,再次冲洗3次,每次3分钟。⑤显色剂显色5分钟后冲洗。⑥苏木素复染约50秒,盐酸酒精分化,PBS返染1分钟,脱水,二甲苯透明,用中性树胶封片。⑦用已知阳性片作为阳性对照,PBS缓冲液作为阴性对照。
1.3阳性结果判定 BAG-1在中耳胆脂瘤上皮和外耳道正常上皮中阳性表达为细胞出现棕黄色或棕褐色染色,阴性表达为细胞不着色,或呈浅黄染色。
1.4图文分析 采用BioMias2001高清病理图文分析系统,分别对34例胆脂瘤上皮的组织切片和12例外耳道正常皮肤的组织切片的染色表达结果行定量分析。随机选取每张切片的不重叠区域的5处阳性细胞,在200倍光镜下,分别测每处阳性部位的平均光密度,最后取平均值作为每张组织切片的测量结果。

2 结果
2.1正常外耳道皮肤和中耳胆脂瘤上皮中BAG-1的表达对比 BAG-1在正常外耳道皮肤中弱阳性表达,主要在细胞核内,散在分布于外耳道上皮表皮层,基本不显色,量稀疏(图1)。BAG-1在胆脂瘤上皮中阳性表达,显色为棕黄色或棕褐色,数量较多,颗粒状,主要分布在胆脂瘤上皮组织的基底层、棘细胞层以及颗粒层。BAG-1在胆脂瘤上皮听小骨破坏O0级、O1级中主要在细胞核表达,在O2级、O3级中在细胞核及胞浆内均表达,其阳性细胞数及着色强度随级别升高而表达增加(图2~5)。BAG-1在正常外耳道皮肤表达的平均光密度值是58.47±2.37,BAG-1在胆脂瘤上皮表达的平均光密度值是104.31±3.68,后者高于前者,差异有统计学意义(t=72.72,P<0.05)。

图1 BAG-1在正常外耳道皮肤中的表达(SP×200) 图2 BAG-1在听小骨破坏O0级胆脂瘤上皮中的表达(SP×200) 图3 BAG-1在听小骨破坏O1级胆脂瘤上皮中的表达(SP×200) 图4 BAG-1在听小骨破坏O2级胆脂瘤上皮中的表达(SP×200) 图5 BAG-1在听小骨破坏O3级胆脂瘤上皮中的表达(SP×200)
2.2BAG-1在听小骨破坏程度不同级别的胆脂瘤上皮中表达的比较及趋势 BAG-1在听小骨破坏O0、O1、O2、O3级胆脂瘤上皮中表达的平均光密度值分别为99.71±0.60、101.24±2.76、105.55±2.07、107.95±1.79,4级平均光密度值作方差分析两两比较,除O0级与O1级外,其他不同级别之间的差异均具有统计学意义(P<0.05)(表1);4级平均光密度值作方差分析趋势性检验,显示随着听小骨破坏程度增加,胆脂瘤上皮中BAG-1表达呈上升趋势显著,有统计学意义(F=65.928,P<0.001)。
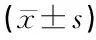
表1 BAG-1在听小骨破坏程度不同级别的胆脂瘤上皮组织中的表达比较
3 讨论
既往研究发现中耳胆脂瘤上皮细胞的凋亡明显高于正常,胆脂瘤上皮细胞的凋亡与细胞增生不存在反向调控,而是处于被抑制的状态,即抗凋亡[10]。细胞凋亡的减少减弱了对细胞增殖的抑制,细胞增殖超过了细胞凋亡,导致胆脂瘤上皮细胞过度增生。Huisman等[11]对活性天冬氨酸半胱氨酸蛋白酶-3的研究证实胆脂瘤上皮细胞凋亡作用微弱;Park等[12]对凋亡抑制蛋白survivin蛋白的研究也证实胆脂瘤上皮细胞抗凋亡这一理论。
BAG-l基因是BAG基因家族的重要组成部分,能与Bcl-2蛋白结合,明显的促进Bcl-2抗凋亡的作用,故称为“Bcl-2结合抗凋亡基因”[13],因其是一种新型的、独立的细胞凋亡相关蛋白,又将其命名为“BAG-1基因表达蛋白”。BAG-1抗凋亡的途径有多种:①与Bcl-2蛋白联合抑制caspases凋亡通路;②结合热激蛋白70(Hsp70)或热激同源蛋白70(Hsc70),不同的BAG-1亚型通过不同调节功能抑制凋亡[14];③结合细胞生长因子(血小板生长因子受体、酪氨酸激酶生长因子受体等)形成复合物,增强其功能而抑制凋亡[15];④活化丝氨酸/苏氨酸激酶(RAF-l激酶),活化后的RAF-1激酶可以激活丝裂原活化蛋白激酶,并能通过细胞外的信号调节激酶信号传导途径促进细胞的生长繁殖;⑤通过与多种生长因子受体结合,进而启动一系列的胞质内的信号传导通路,激活ras/raf/MAPK和多种转录因子,进而调节细胞分化或转化,增强它的功能而抑制凋亡。本研究结果示,BAG-1在胆脂瘤上皮细胞中的表达明显高于正常外耳道上皮(P<0.05),说明胆脂瘤上皮细胞的凋亡被抑制,细胞增殖间接被促进,致胆脂瘤上皮细胞过度增生;BAG-1在胆脂瘤上皮组织中平均光密度值随骨质破坏程度的加重而增加,说明BAG-l在中耳胆脂瘤的表达与骨质破坏存在一定相关性,这可能是由于胆脂瘤上皮细胞凋亡减少,使得周围炎症细胞、破骨细胞相对较多。这种作用主要有两方面:一方面,炎症细胞活化后释放破骨细胞分化因子,与破骨细胞表面的破骨细胞分化因子受体结合,激活破骨细胞使骨吸收[16];另一方面,在多种炎性介质作用下,使细胞核因子κB受体活化因子配基(RANKL)增多或骨保护素减少,进一步激活破骨细胞的骨质破坏作用,导致骨质破坏吸收[17]。这与Takayama等[18]和Townsend等[19]在结肠癌、乳腺癌等肿瘤中BAG-1的表达具有相似性,且认为BAG-l的表达与肿瘤的分期有关,说明胆脂瘤具有类似肿瘤的特点。
综上所述,BAG-1在中耳胆脂瘤组织中高表达,其参与了中耳胆脂瘤上皮细胞的抗凋亡调控,且与骨质破坏之间存在相关性,但两者间具体是通过怎样的机制互相联系及影响的,有待进一步研究。
