浅谈如何从化学试题中提取有效信息
2021-07-13边华然
边华然



【摘要】高中化学教学,重点培养学生获取信息和处理信息的能力。尤其近年来化学考试题题干阅读量越来越大,如何快速、准确的从所给的信息中获取有效信息并进行有效整合是提高解题准确率和效率的主要保障。
【关键词】文字信息 实验装置图形 化工流程
化学试题中的信息主要有三种呈现形式:文字信息、实验装置图形信息和化工流程信息。“获取和解读信息,提取和整合有效信息”是理综考试中化学试题中的核心要求。然而,有时解题时题干信息不是很明确,而是在细微处描述让学生容易忽视,因此,有效信息的提取和整合要全面,要把文字、图形和图表有效结合从而达到快速、准确答题的目的。
一、文字信息的有效提取
文字信息是最基本的信息模式,化学试题中,对题干提示信息,文字性材料中要排除与中心问题无关或产生干扰的信息,由表及里,依据问题中心词去粗取精获取有效信息并进行整合,从而达到快速、准确有效解题的目的。
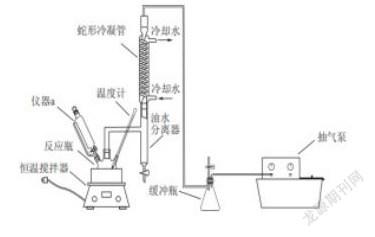
例如:(节选)过氧乙酸(CH3COOOH)是一种常用的消毒剂,易溶于水、易挥发、见光或受热易分解。其制备原理为:△H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。
(1)过氧乙酸保存时应注意___________(填标号)。
A.避光 B.低温 C.密闭 D.隔绝空气
(2)反应体系采用减压的目的是______________________________。
题干信息:“过氧乙酸易溶于水、易挥发、见光或受热易分解”,说明了过氧乙酸的溶解度,沸点低,不稳定的性质,所以保存时,应该低温遮光密封;压强越大,沸点越高;反之,要降低共沸物的沸点,可以减小压强,故第2小题答案为:减压可以降低共沸物的沸点,防止温度过高,过氧乙酸分解;
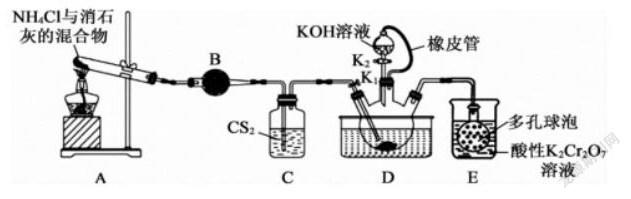
又如:硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室用如下装置进行制取:
已知:①CS2不溶于水,密度比水的大;②NH3不溶于CS2;③三颈烧瓶内盛放有CS2、水和催化剂。回答下列问题:
(1)制备流程中:
①装置C的主要作用是___。三颈烧瓶的下层CS2液体必须浸没导气管口,主要原因是___。
②装置D中发生反应CS2+3NH3NH4SCN+NH4HS,该反应比较缓慢,反应至CS2消失。
已知条件中,因NH3不溶于CS2,故C的作用为观察氨气逸出的速率,从而控制装置A的加热温度(或观察产生气泡的数量,控制加热的温度);已知NH3不溶于CS2,CS2不溶于水,密度比水的大,则导出氨气的导管口应浸没在CS2液面以下,防止发生倒吸、或使氨气和二硫化碳充分接触;
二、实验装置图有效信息的获取与整合
化学是以实验为基础的自然科学,高考中实验题要求考生联系所学过的实验知识与技能,进行知识类比、迁移和重组。从实验装置中获取有效信息,可以帮助学生快速地理清解题思路,正确回答提出的问题。
例如:某小组同学预利用下图所示装置制备SOCl2,双颈瓶中所加试剂为25.4mL SCl2,发生如下反应:Cl2+SO2+SCl2=2SOCl2,
(1)洗气瓶的作用是_______________________。
(2)干燥管中所加试剂是__________ ,其作用是
分析装置图中洗气瓶的结构特点,该装置有干燥气体、混合气体、通过气泡控制通入的气体体积比的作用,玻璃导管的存在也可以平衡体系的压强。冷凝器上方的干燥管有吸收酸性气体和水蒸气的作用,再结合 SCl2和SOCl2遇水分解,故该装置的作用就是防止空气中的水蒸汽进入装置;
又如:科学家利用如图的电化学原理装置将CH4和CO2耦合转化生成乙烯、乙烷、水和一氧化碳,由原理图可知,A电极上CO2→CO、C元素化合价降低、发生还原反应,则A电极为阴极,电解质传导O2-,B电极为阳极,阴极反应式为CO2+2e-=CO+O2-,阳极B上生成一定量的乙烯和乙烷混合气体,
三、工艺流程中有效信息的获取与整合
化学工艺流程题是近年高考中的新题型,它以工业实际生产和化学实验相关的物质制备、分离和提纯为中心,以流程图为信息背景,以物质的性质和转化为考查点。此类题目综合性比较强,难度较大,而从工艺流程中获取有效信息成为解题的关键。
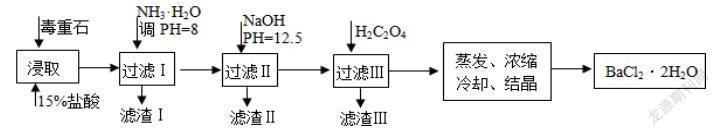
例如:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母) a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
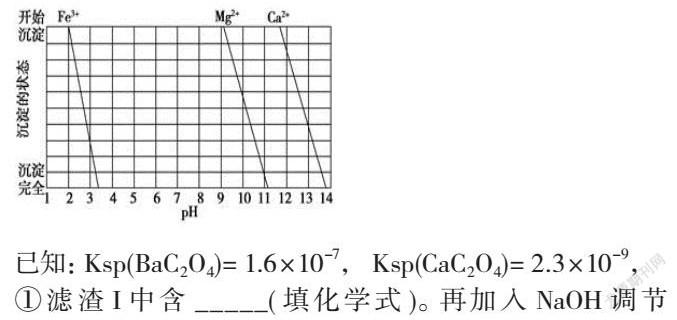
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含 _____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
25℃, H2C2O4的电离平衡常数如下:
H2C2O4 Ka1=5.36×10-2 Ka2=5.35×10-5
①HC2O4-的电离平衡常数表达式 Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
由题干流程可知:加盐酸溶解时,碳酸钡和盐酸反应而溶解变为Ba2+,加入氨水调节pH为8,只能使Fe3+完全沉淀,滤渣1为Fe(OH)3,再加入氢氧化钠调节pH=12.5,只能使Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;加入H2C2O4的目的是得到CaC2O4沉淀,以便除去剩余的Ca2+,最后通过蒸发浓缩、冷却结晶、过滤得到BaCl2·2H2O,
总之,高中阶段要以培养学生综合素质为目标,引导学生树立社会主义核心价值观。化学学科具有其学科的特殊性,其核心素养也是学生综合素质的重要组成部分。通过学习化学,可以提高学生的观察能力和动手能力,促进学生形成科学探究的精神和开拓创新的意识,教师也要通过授课培养学生科学的态度和对社会的責任。古人云:授之以鱼,不如授之以渔,授人以鱼之救一时之急,授人以渔则可解一生之需。老师不仅仅是传授知识,更应传授学生主动获取知识的能力。新课程下提高学生主动获取和处理信息的能力,乃是教学本质的追求,也应该是每一位教师的努力方向。
