UPLC-MS/MS分析紫薯酒发酵前后花色苷种类和含量变化
2021-07-06袁江月孙军杰刘锡铭
袁江月 何 佳 孙军杰 芮 蓬 刘锡铭
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
紫薯属于旋花科一年生草本植物,是薯肉颜色为紫色的甘薯,含有丰富的花青素类色素[1]。花青素是一类广泛存在于植物中的水溶性色素,属于类黄酮化合物,也是植物的主要呈色物质。自然条件下,游离的花青素常与一个或多个葡萄糖、槐糖和阿拉伯糖等通过糖苷键形成花色苷,而花色苷中的糖苷基和羟基还可以与一个或几个分子的香豆酸、阿魏酸、咖啡酸和对羟基苯甲酸等通过酯键形成酰基化的花色苷[2]。因此,紫薯可有效清除人体自由基以起到抗衰老的作用[3]。
张毅等[4]研究发现,不同品种紫薯花色苷含量与组分各不相同且紫薯花色苷均以酰基化的形式存在。朱璐等[5]综合评价了浸提法、微波辅助法和超声波辅助法提取的紫薯花色苷的抗氧化活性。Gras等[6]通过在紫薯花色苷中加入氯原酸和玫瑰酸,以及不同剂量的食品级酚类苹果和迷迭香提取物,研究了分子间共色素的定量和定性影响。
目前,常见的花色苷提取方法主要有溶剂提取法、酸性溶剂萃取法、超临界流体法、微波提取法、酶提取法和微生物发酵提取法等[7]。而酿造紫薯酒是一种能够较好地提取、利用紫薯花色苷的方法,是酸性溶剂萃取法、酶提取法和微生物发酵提取法的有机结合。但花色苷同时存在易氧化、易分解的特点[8],紫薯酒酿造过程中可能会导致花色苷分解。李甜等[9]研究了紫薯酒发酵过程与颜色相关的花色苷含量、褐变指数、聚合色度和总色度变化规律及其相关性等。郭孝萱等[10]研究了黑曲霉、米根霉和米曲霉3种丝状真菌固态发酵对紫薯中花色苷含量的影响。而有关紫薯花色苷种类与含量在紫薯酒酿造过程中的变化尚未见报道。文章拟采用UPLC-MS/MS法测定紫薯酒酿造过程中花色苷含量的变化,并对不同阶段样品中的花色苷进行定性与定量分析,旨在为紫薯花色苷的开发利用提供依据。
1 材料与方法
1.1 材料与试剂
紫薯:群紫1号,市售;
盐酸:分析纯,洛阳昊华化学试剂有限公司;
柠檬酸:分析纯,锦州市向阳化学试剂厂;
酿酒酵母:黄酒专用酵母,安琪酵母股份有限公司;
AB-8大孔吸附树脂:沧州宝恩吸附材料科技有限公司;
无水乙醇:分析纯,天津市德恩化学试剂有限公司;
甲醇、甲酸:色谱纯,天津市德恩化学试剂有限公司;
果胶酶(≥ 40 U/mg)、淀粉酶(约 4×104U/g)、糖化酶(约1×105U/g):北京奥博星生物技术有限责任公司。
1.2 仪器与设备
恒温水浴锅:HH-S4型,北京科伟永兴仪器有限公司;
生化培养箱:SPX-250型,北京市永光明医疗仪器公司;
冷冻离心机:TGL-16M型,上海卢湘仪离心机仪器有限公司;
分光光度计:UV-2100型,尤尼柯(上海)仪器有限公司;
超声清洗仪:KQ-500DE型,昆山市超声仪器有限公司;
旋转蒸发仪:RE52-86A型,上海亚荣生化仪器厂;
电子天平:YP602N型,上海舜宇恒平科学仪器有限公司;
酸度计:PHS-25型,上海仪电科学仪器股份有限公司;
高压蒸汽灭菌锅:YXQ-LS50SII型,上海博讯实业有限公司医疗设备厂;
超高效液相色谱—串联四极杆质谱联用仪:Waters H-Class TQ-S Micro型,沃特世科技(上海)有限公司。
1.3 样品制备
1.3.1 紫薯花色苷浓缩液制备 根据文献[11]修改如下:将100 g生紫薯和经高温蒸煮的100 g熟紫薯(蒸锅中上汽后再蒸煮20 min至完全熟透)分别与酸化乙醇(V1.5 mol/L HCl∶V95%乙醇=15∶85)按m紫薯∶V酸化乙醇=l∶12(g/mL)打浆,60 ℃超声浸提40 min,4层尼龙纱布过滤,4 ℃、10 000 r/min离心20 min,上清液真空旋转蒸发,除去乙醇,经AB-8大孔树脂纯化,蒸馏水冲洗除去糖、无机盐等杂质,用80%乙醇于25 ℃、100 r/min摇床中洗脱1 h,重复3次,真空旋转蒸发得花色苷浓缩液,定容至50 mL。
1.3.2 紫薯酒花色苷浓缩液制备 根据文献[12]修改如下:将熟紫薯清洗去皮并挑选100 g,按m紫薯∶m蒸馏水=1∶1 加水打浆10 min,用柠檬酸调节pH至6.5,加入0.1% 淀粉酶液化,90 ℃水浴90 min;液化后降温至60 ℃,调节pH至4.5,加入0.1%糖化酶糖化,60 ℃水浴80 min;糖化后冷却至室温,调节pH至6.0,将黄酒专用酵母接种至制备好的紫薯浆液中,接种量0.3%,活化水温35~38 ℃,活化15 min后,将水温降至30~32 ℃,于26 ℃发酵7 d。发酵结束后处理同1.3.1。
1.4 指标测定
1.4.1 液相色谱—质谱联用测定条件
(1)色谱条件:根据文献[13]并修改。色谱柱为Waters BEH Cl8柱(2.1 mm×50 mm,1.7 μm),进样体积2 μL,柱温25 ℃,流动相A为0.1%甲酸水溶液;流动B为100%甲醇;梯度洗脱条件:0~10 min,95%~70% A;10~25 min,70%~65% A;25~30 min,10% A;30~32 min,95% A;32~35 min,95% A。流速0.1 mL/min。
(2)质谱条件:根据文献[14]并修改。扫描模式ES+;扫描范围700~1 200(m/z);扫描时间0.5 s;毛细管电压3 000 V;锥孔电压20 V;离子源温度150 ℃;脱溶剂气温度500 ℃,流量1 000 L/h;锥孔反吹气流量50 L/h;二级质谱碰撞能量25 V;离子扫描范围200~1 200(m/z),正离子模式。
1.4.2 花色苷定性及定量方法
(1)定性方法:结合相对保留时间、一级质谱分子离子和二级质谱碎片离子,推测花色苷种类。
(2)定量方法:采用峰面积法。
1.4.3 数据处理 使用MassLynx®软件得到色谱图数据点及各花色苷峰面积积分,使用Origin作图。
2 结果与分析
2.1 花色苷种类
2.1.1 花色苷总离子流图 图1为不同处理阶段紫薯花色苷浓缩液的总离子流图。

A.生紫薯 B.熟紫薯 C.紫薯酒
2.1.2 花色苷的鉴定 通过样品一级质谱确认,蒸煮和发酵前后样品中均含有m/z为893,907,935,949,1 069,1 097,1 111,1 125的花色苷,分别以组分1,2,3,4,5,6,7,8命名,并通过对各组分一级质谱的分子离子和二级质谱的碎片离子进行分析,推断花色苷的种类。
由图3、图4可知,组分1的保留时间为12.25 min,其分子离子m/z893二级质谱有3个碎片离子,分别为m/z287,449,731,与Tian等[15]的结论相同,因此m/z287可以认定为矢车菊素;m/z449可以认定为失去一分子槐糖和一分子对羟基苯甲酸[M-324-120]+得到的碎片;m/z731可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分1可以认定为矢车菊素3-对羟基苯甲酰槐糖苷-5-葡糖苷。

图2 生紫薯花色苷出峰时间分布图

图3 组分1一级质谱图

图4 组分1二级质谱图
由图5、图6可知,组分2的保留时间为13.77 min,其分子离子m/z907二级质谱有3个碎片离子,分别为m/z301,463,745,与Tian等[15]的结论相同,因此m/z301可以认定为芍药素;m/z463可以认定为失去一分子槐糖和一分子对羟基苯甲酸[M-324-120]+得到的碎片;m/z745可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分2可以认定为芍药素3-对羟基苯甲酰槐糖苷-5-葡糖苷。

图6 组分2二级质谱图
由图7、图8可知,组分3的保留时间为16.37 min,其分子离子m/z935二级质谱有3个碎片离子,分别为m/z287,449,773,与Suda等[16]的结论相同,因此m/z287可以认定为矢车菊素;m/z449可以认定为失去一分子槐糖和一分子咖啡酸[M-324-162]+得到的碎片;m/z773可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分3可以认定为矢车菊素3-咖啡酰槐糖苷-5-葡糖苷。
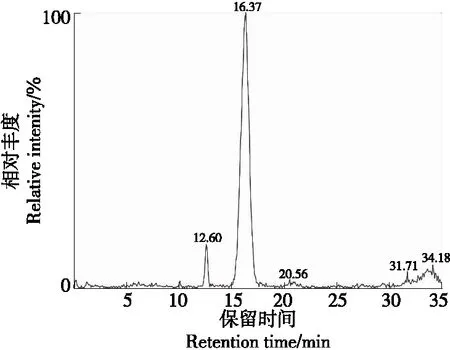
图7 组分3一级质谱图
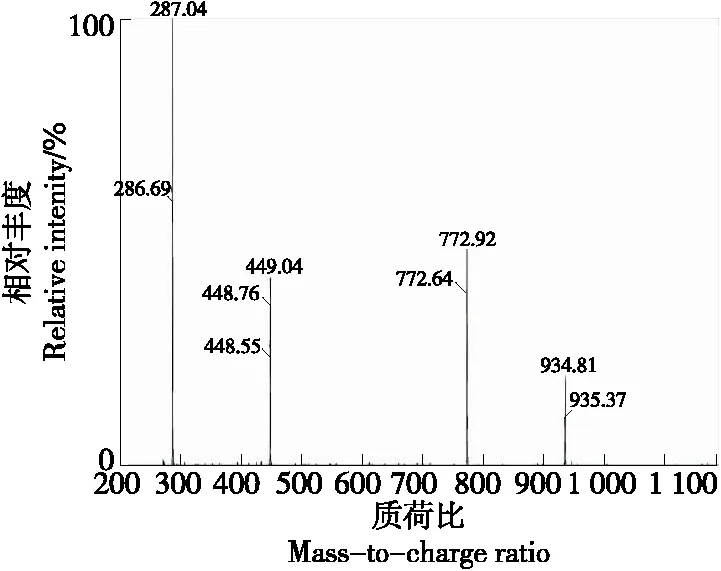
图8 组分3二级质谱图
由图9、图10可知,组分4的保留时间为18.31 min,其分子离子m/z949二级质谱有3个碎片离子,分别为m/z301,463,787,与Tian等[15]的结论相同,因此m/z301可以认定为芍药素;m/z463可以认定为失去一分子槐糖和一分子咖啡酸[M-324-162]+得到的碎片;m/z787可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分4可以认定为芍药素3-咖啡酰槐糖苷-5-葡糖苷。

图9 组分4一级质谱图

图10 组分4二级质谱图
由图11、图12可知,组分5的保留时间为22.11 min,其分子离子m/z1 069二级质谱有3个碎片离子,分别为m/z301,463,907,与Islam等[17]的结论相同,因此m/z301可以认定为芍药素;m/z463可以认定为失去一分子槐糖、一分子咖啡酸和一分子对羟基苯甲酸[M-324-162-120]+得到的碎片;m/z907可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分5可以认定为芍药素3-咖啡酰-对羟基苯甲酰槐糖苷-5-葡糖苷。

图11 组分5一级质谱图

图12 组分5二级质谱图
由图13、图14可知,组分6的保留时间为17.76 min,其分子离子m/z1 097二级质谱有3个碎片离子,分别为m/z287,449,935,与Tian等[15]的结论相同,因此m/z287可以认定为矢车菊素;m/z449可以认定为失去一分子槐糖和两分子咖啡酸[M-324-162×2]+得到的碎片;m/z935可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分6可以认定为矢车菊素3-(6″,6‴-双咖啡酰槐糖苷)-5-葡糖苷。

图13 组分6一级质谱图

图14 组分6二级质谱图
由图15、图16可知,组分7的保留时间为20.87 min,其分子离子m/z1 111二级质谱有3个碎片离子,分别为m/z287,449,949,与Suda等[16]的结论相同,因此m/z287可以认定为矢车菊素;m/z449可以认定为失去一分子槐糖、一分子阿魏酸和一分子咖啡酸[M-324-176-162]+得到的碎片;m/z949可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分7可以认定为矢车菊素3-(6″-咖啡酰-6‴-阿魏酰槐苷)-5-葡糖苷。
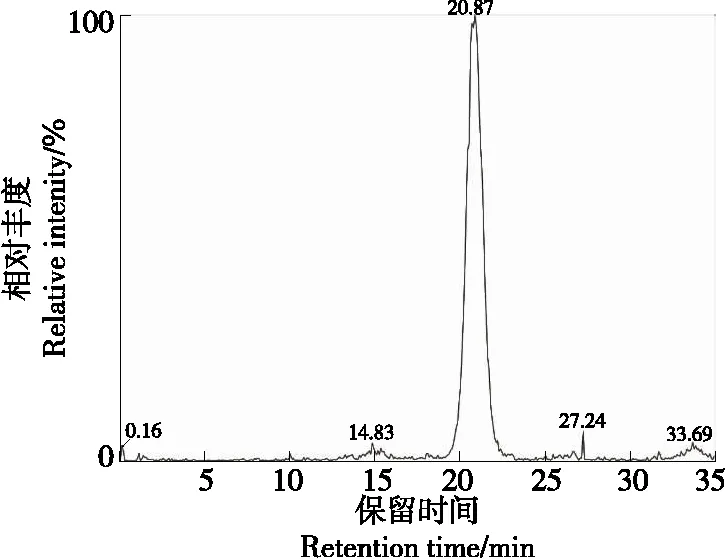
图15 组分7一级质谱图
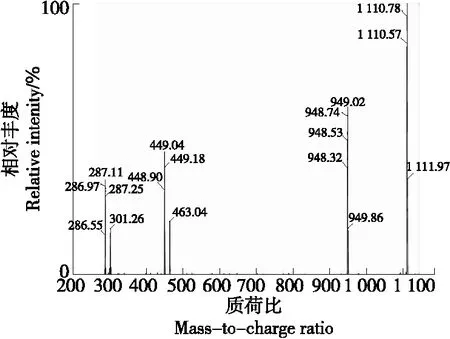
图16 组分7二级质谱图
由图17、图18可知,组分8的保留时间为25.15 min,其分子离子m/z1 125有3个碎片离子,分别为m/z301,463,963,与Suda等[16]的结论相同,因此m/z301可以认定为芍药素;m/z463可以认定为失去一分子槐糖、一分子阿魏酸和一分子咖啡酸[M-324-176-162]+得到的碎片;m/z963可以认定为失去一分子葡萄糖[M-162]+得到的碎片。组分8可以认定为芍药素3-(6″-咖啡酰-6‴-阿魏酰槐苷)-5-葡糖苷。

图17 组分8一级质谱图

图18 组分8二级质谱图
由表1可知,在酰化基团和糖基相同或类似的情况下,矢车菊素花色苷的保留时间小于芍药素花色苷的,与Truong等[18]的结果一致,符合花色苷在UPLC图谱中的分配规律。此外,Tian等[15-17]还检测出了m/z773矢车菊素3-槐糖苷-5-葡糖苷等多种花色苷,而试验未检测到,可能与品种、产地等差异有关[4]。

表1 花色苷指认汇总表
2.2 花色苷含量变化
由图19可知,紫薯发酵为紫薯酒后有8种花色苷发生了变化,组分1矢车菊素3-对羟基苯甲酰槐糖苷-5-葡糖苷最终得率为33%;组分2芍药素3-对羟基苯甲酰槐糖苷-5-葡糖苷最终得率为31%;组分3矢车菊素3-咖啡酰槐糖苷-5-葡糖苷最终得率为31%;组分4芍药素3-咖啡酰槐糖苷-5-葡糖苷最终得率为45%;组分5芍药素3-咖啡酰-对羟基苯甲酰槐糖苷-5-葡糖苷最终得率为28%;组分6矢车菊素3-(6″,6‴-双咖啡酰槐糖苷)-5-葡糖苷最终得率为26%;组分7矢车菊素3-(6″-咖啡酰-6‴-阿魏酰槐糖苷)-5-葡糖苷最终得率为28%;组分8芍药素3-(6″-咖啡酰-6‴-阿魏酰槐糖苷)-5-葡糖苷最终得率为28%。
由图19还可知,经高温蒸煮工艺,紫薯中花色苷种类未发生变化,但花色苷含量减少,可能是部分花色苷受热分解。其中减少得最多的为组分4芍药素3-咖啡酰槐糖苷-5-葡糖苷,表明其热稳定性较差;减少得最少的为组分3矢车菊素3-咖啡酰槐糖苷-5-葡糖苷,表明其热稳定性较好。刘海英等[19]研究表明,紫薯花色苷的热降解符合一级反应动力学模型,随着温度的升高,紫薯花色苷降解速率明显加快。此外,蒸煮后部分花色苷提取率有所升高,具体原因有待进一步研究。紫薯发酵为紫薯酒后,8种花色苷得率约为总量的30%,与梁敏等[20]的结果相近。发酵后紫薯酒中提取量最多的花色苷为组分4芍药素3-咖啡酰槐糖苷-5-葡糖苷,提取量最少的为组分6矢车菊素3-(6″,6‴-双咖啡酰槐糖苷)-5-葡糖苷。

图19 花色苷峰面积变化趋势图
3 结论
采用超高效液相色谱—串联四极杆质谱法对紫薯酒发酵前后的花色苷种类及含量进行了分析。结果表明:紫薯酒中共鉴定出8种花色苷,高温蒸煮会使部分花色苷受热分解,而酿造紫薯酒可以有效从紫薯中提取花色苷;经高温蒸煮和7 d发酵后,8种花色苷最终得率为26%~45%。此外,发酵后花色苷未完全提取,这可能与浸提时间不足、花色苷易分解以及酵母菌的吸附作用等因素有关,具体原因有待进一步研究。
