真菌次级代谢产物可皆霉素的抗炎活性研究
2021-07-05郭继倩尹震花张娟娟郭庆丰
巩 芳,郭继倩,尹震花,张娟娟,郭庆丰,陈 林*
(1.河南医学高等专科学校附属医院药剂科,郑州 451191;2.郑州市天然产物合成生物学重点实验室,河南省小分子新药研发国际联合实验室,黄河科技学院,郑州 450063)
天然产物是寻找天然活性成分的重要资源之一。真菌因其资源丰富、代谢产物结构新颖等特点,越来越受到学者的关注[1-2]。可皆霉素为苯醌类化合物,分子式为C32H30N2O4,相对分子质量为506.22,结构式见图1,是一种从球壳科毛壳属狭旋毛壳菌种(来自美国模式培养物集存库,菌种编号:ATCC No.56725)中分离得到的一种天然次生代谢产物,质量分数高达98.76%。研究表明,目前可皆霉素仅在毛壳属(Chaetomiumglobosum,C.cochliodes)中分离得到,具有抗菌[3-4]、抗癌[5]和抗凝血[6]等作用。目前未见对其抗炎作用的研究。
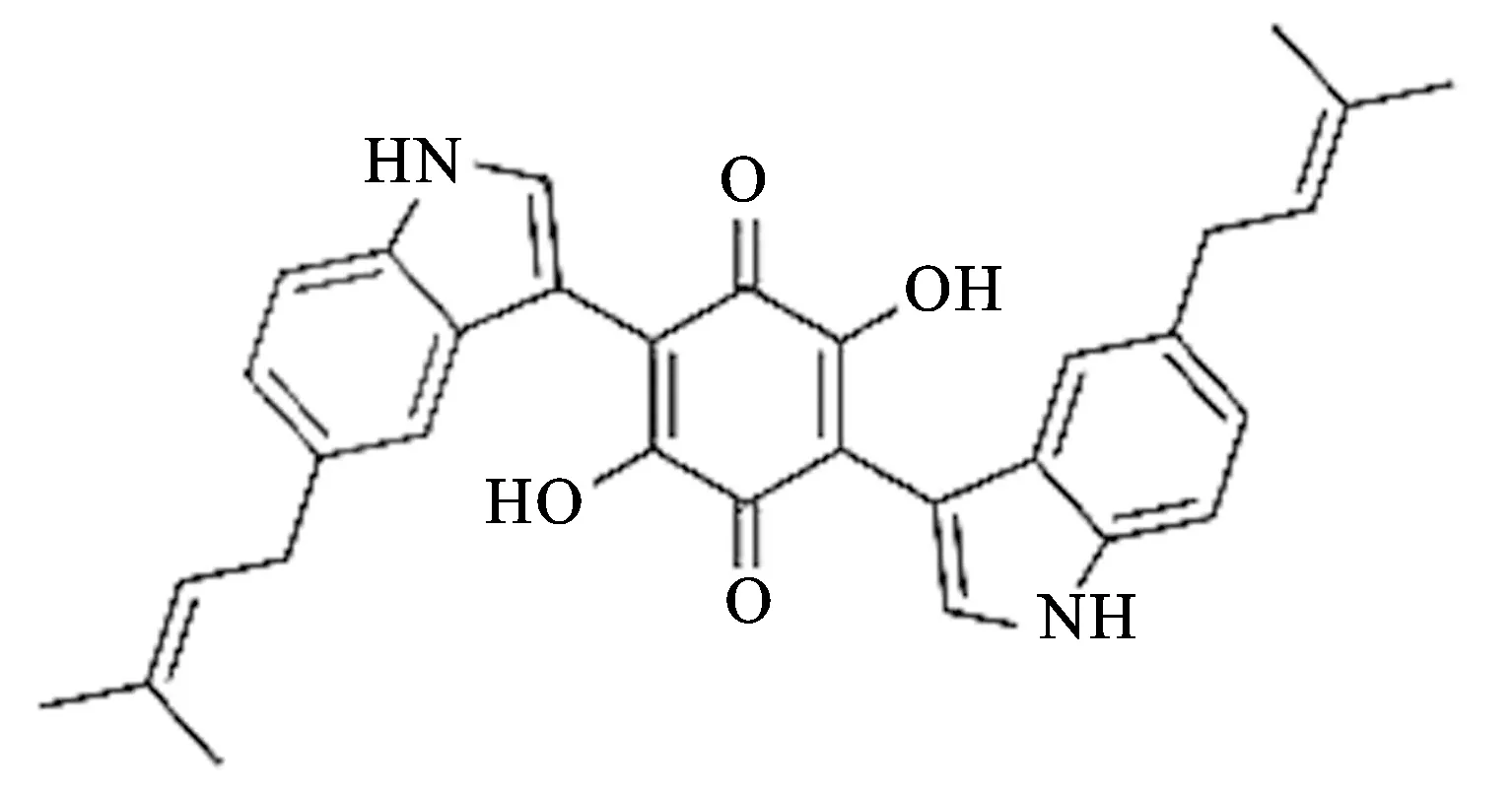
图1 可皆霉素的结构式
一氧化氮(NO)是炎症和炎症性疾病的化学指标[7],不但在血管反应中起主要作用,而且还参与免疫系统反应和血小板的调节反应,作为细胞因子在炎症反应中扮演了重要角色。因此,抑制NO在体内的分泌可有效抑制炎症反应。本文采用CCK-8法测定可皆霉素对RAW264.7细胞NO分泌量的影响,评价可皆霉素的抗炎活性,为其今后的研发提供参考。
1 仪器与材料
1.1仪器 SW-CJ-2FD型超净工作台(浙江苏净净化设备有限公司);GPJ9-TS100-F型倒置显微镜(日本尼康公司);3599型细胞培养板(康宁公司);BB15型二氧化碳(CO2)细胞培养箱,1510型全自动酶标仪,均购自赛默飞世尔科技(中国)有限公司;TGL-16G型离心机(常州市金坛友联仪器研究所);AR1140型电子分析天平(赛多利斯科学仪器有限公司)。
1.2试药 可皆霉素(质量分数为98%),黄河科技学院纳米功能材料研究所;RPMI-1640培养基(北京华工科创生物公司);青链霉素混合液(双抗,Solarbio公司);内毒素脂多糖,二甲基亚砜(DMSO)(Sigma公司);一氧化氮(NO)试剂盒,CCK-8试剂盒(南京建成生物工程研究所);地塞米松片(南国药业有限公司);磷酸盐缓冲液(PBS,实验室自制);乙醇(体积分数为75%,山东安捷高科消毒科技有限公司);澳洲胎牛血清(FBS,Gibco公司)。
1.3材料 小鼠单核巨噬细胞RAW264.7,购自中国科学院上海生命科学研究院细胞资源中心。
2 实验方法
2.1溶液的制备
2.1.1细胞培养液 将胎牛血清(0.1 mL·mL-1)和青链霉素混合液(青霉素为100 u·mL-1,链霉素为100 μg·mL-1)加到RPMI-1640培养基中,混匀,保存在4 ℃冰箱中。
2.1.2细胞冻存液 将2.1.1项下制备的细胞培养液、胎牛血清和高压灭菌的DMSO以7∶2∶1混匀,密封,4 ℃保存。
2.1.3脂多糖(LPS)溶液 用DMSO溶解LPS,再用2.1.1项下制备的细胞培养液稀释,配成质量浓度为100 μg·mL-1的溶液。将上述溶液用0.22 μm微孔滤膜过滤除菌,保存在4 ℃冰箱中,实验前用2.1.1项下制备的细胞培养液稀释成所需的质量浓度,用微孔滤膜过滤后使用。
2.1.4对照品溶液 将可皆霉素、地塞米松片和LPS分别用DMSO溶解,再用2.1.1项下制备的细胞培养液稀释,将可皆霉素及地塞米松片配成质量浓度为50 μg·mL-1的母液,用0.22 μm微孔滤膜过滤除菌,4 ℃保存。实验前用2.1.1项下制备的细胞培养液稀释成所需的质量浓度,用微孔滤膜过滤后使用。在实验中DMSO的质量浓度均小于1 μg·mL-1,以保证对实验结果无明显影响。
2.2细胞培养
2.2.1细胞培养与传代 将细胞置于细胞培养皿中,加入2.1.1项下制备的细胞培养液10 mL,在 37 ℃、体积分数为5%的CO2培养箱中孵育,隔天换液1次。当细胞长满培养皿底的80%以上时对细胞进行传代;用移液枪吸弃培养液,用PBS 3 mL冲洗2~3遍,再加入细胞培养液3 mL,用无菌细胞刮刀刮取,置于倒置显微镜下观察。用移液枪吹打使细胞混匀,按照1传3接种到新的培养皿中。
2.2.2细胞冻存 置于倒置显微镜下观察,若细胞处于对数期且状态良好,可以对其进行冻存。离心收集细胞,加入2.1.2项下制备的细胞冻存液1 mL,吹打成悬浮细胞后吸入冻存管中。于4 ℃冰箱中放置30 min,-20 ℃冰箱中放置30 min,-80 ℃冰箱中放置过夜,最后放入液氮罐中保存。
2.2.3细胞复苏 从液氮罐中取出细胞冻存管后,放入37 ℃的水浴中快速振摇使其迅速溶解,移至离心管中,以1 000 r·min-1离心5 min,将细胞转入细胞培养皿中,加入2.1.1项下制备的细胞培养液10 mL,并用移液枪吹打混匀,置于CO2细胞培养箱中培养,待细胞贴壁后,更换培养液。
2.2.4细胞计数 取出细胞计数板,把细胞计数板和盖玻片用酒精棉球擦拭干净,晾干,用镊子将盖玻片盖于计数板上。用无菌细胞刮刀使细胞脱壁,离心后加入新的细胞培养液5 mL,吹打使细胞混匀,取出200 μL稀释成细胞悬液1 mL,吹打均匀后,吸取10 μL,沿着盖玻片边缘滴加,使其充满细胞计数板和盖玻片之间的空隙,不能有气泡;置于倒置显微镜下,计数4个大格内的细胞总数(若细胞压线,只计压上线和左线者,细胞团按单个细胞计数)。按照公式计算:细胞总数(个·mL-1)=(4大格细胞总数÷4)×104×稀释倍数。
2.3LPS刺激RAW264.7细胞构建炎症细胞模型并确定最佳剂量 取处于对数生长期的RAW264.7细胞,以105个·mL-1的单细胞悬液接种于96孔细胞培养板(每孔100 μL),将培养板置于37 ℃、体积分数为5%的CO2培养箱中孵育24 h后用LPS进行诱导。实验分为饥饿组和无饥饿组,饥饿组在加LPS之前将旧的细胞培养液弃去换成无FBS的培养液。LPS的终质量浓度分别为0、0.01、0.10、1.00、10.00、100.00 μg·mL-1,各质量浓度设5个复孔,每孔100 μL,置于培养箱中培养。24 h后终止培养,按照NO试剂盒说明书操作,在550 nm 波长处测定吸光度值A,计算细胞的NO分泌量。以确定LPS 刺激的最佳质量浓度。
2.4可皆霉素和LPS对RAW 264.7细胞活力的影响 (1)取处于对数生长期的RAW264.7细胞,以105个·mL-1的单细胞悬液接种于96孔细胞培养板(每孔100 μL),将培养板置于37 ℃、体积分数为5%的CO2培养箱中孵育24 h。(2)实验分为空白组、正常对照组和药物组。空白组:只加入2.1.1项下制备的细胞培养液;正常对照组:只加入细胞;药物组:可皆霉素稀释到不同质量浓度(5.00、12.50、25.00 μg·mL-1),LPS稀释至不同质量浓度(0.01、0.10、1.00、10.00、100.00 μg·mL-1),每孔加入100 μL,各质量浓度设5个复孔。将培养板置于培养箱中孵育48 h。(3)每孔加入CCK-8试剂10 μL,然后置于培养箱中培养1~4 h。(4)用酶标仪在450 nm 波长处测定其吸光度值A。细胞存活率=(A药物组-A空白组)÷(A正常对照组-A空白组)×100%。
2.5可皆霉素对LPS刺激RAW264.7细胞分泌炎症介质NO分泌量的影响 (1)取处于对数生长期的RAW264.7细胞,以105个·mL-1的单细胞悬液接种于96 孔细胞培养板(每孔100 μL),将培养板置于37 ℃、体积分数为5%的CO2的培养箱中孵育24 h。(2)实验分为空白组、LPS模型组、可皆霉素组和地塞米松组。空白组只加入2.1.1项下制备的细胞培养液;LPS模型组加入含有1 μg·mL-1LPS的细胞培养液;可皆霉素组在LPS模型组的基础上,将可皆霉素设置3个质量浓度梯度(5.00、12.50、25.00 μg·mL-1);地塞米松组在LPS模型组的基础上,将地塞米松片设置3个质量浓度梯度(5.00、12.50、25.00 μg·mL-1)。每孔加入100 μL,各质量浓度设3个复孔。将培养板置于培养箱中孵育,24 h后终止培养,按照NO试剂盒的说明书操作,在550 nm波长处测定吸光度值A,计算NO的分泌量。

3 实验结果
3.1可皆霉素对RAW 264.7细胞存活率的影响 见表1和表2。
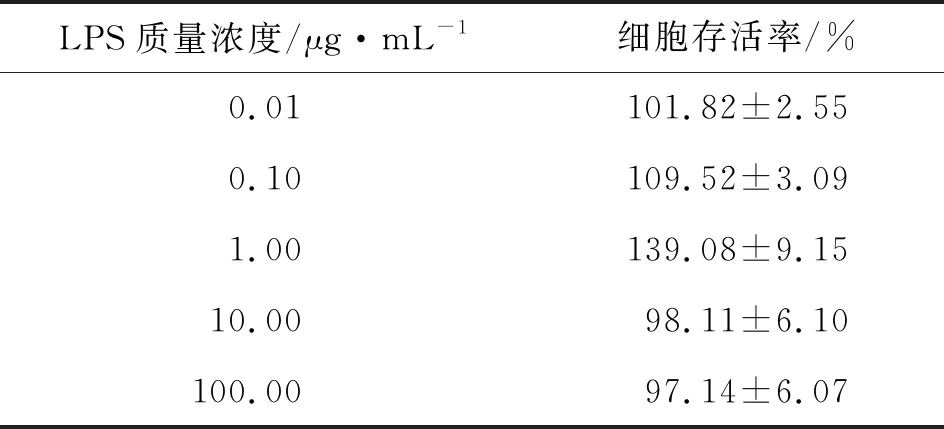
表1 不同质量浓度的LPS作用后的RAW 264.7细胞存活率
由表1可知,LPS质量浓度为0.01~100.00 μg·mL-1时,细胞存活率为97.14%±6.07%~139.08%±9.15%,表明在此质量浓度范围内LPS无明显细胞毒性作用。而且1.00 μg·mL-1LPS作用于RAW 264.7细胞48 h后,细胞活力增加到139.08%±9.15%,且细胞多由圆形变为梭形等不规则形态,并出现细长伪足。由此可知,LPS刺激RAW 264.7细胞后,细胞形态发生明显变化,说明RAW264.7 细胞受到1.00 μg·mL-1LPS 作用48 h后,活力增强。
由表2可见,当可皆霉素质量浓度为12.5 μg·mL-1及以上时,细胞存活率较低,细胞毒性较大,半数抑制质量浓度(IC50)为11.51 μg·mL-1。

表2 不同质量浓度的可皆霉素作用后的RAW 264.7细胞存活率
3.2LPS和可皆霉素对刺激RAW264.7细胞NO分泌量的影响 见表3和表4。由表3可知,不同质量浓度的LPS 对RAW264.7细胞NO分泌量具有促进作用,但饥饿条件较无饥饿条件下作用明显,且作用强度与剂量有关。由此表明,LPS可促进RAW264.7细胞分泌NO,且LPS刺激RAW264.7细胞构建炎症细胞模型的最佳方法和质量浓度为:饥饿处理,即在加LPS之前将旧的细胞培养液弃去换成无FBS的培养液,LPS质量浓度为1.00 μg·mL-1。
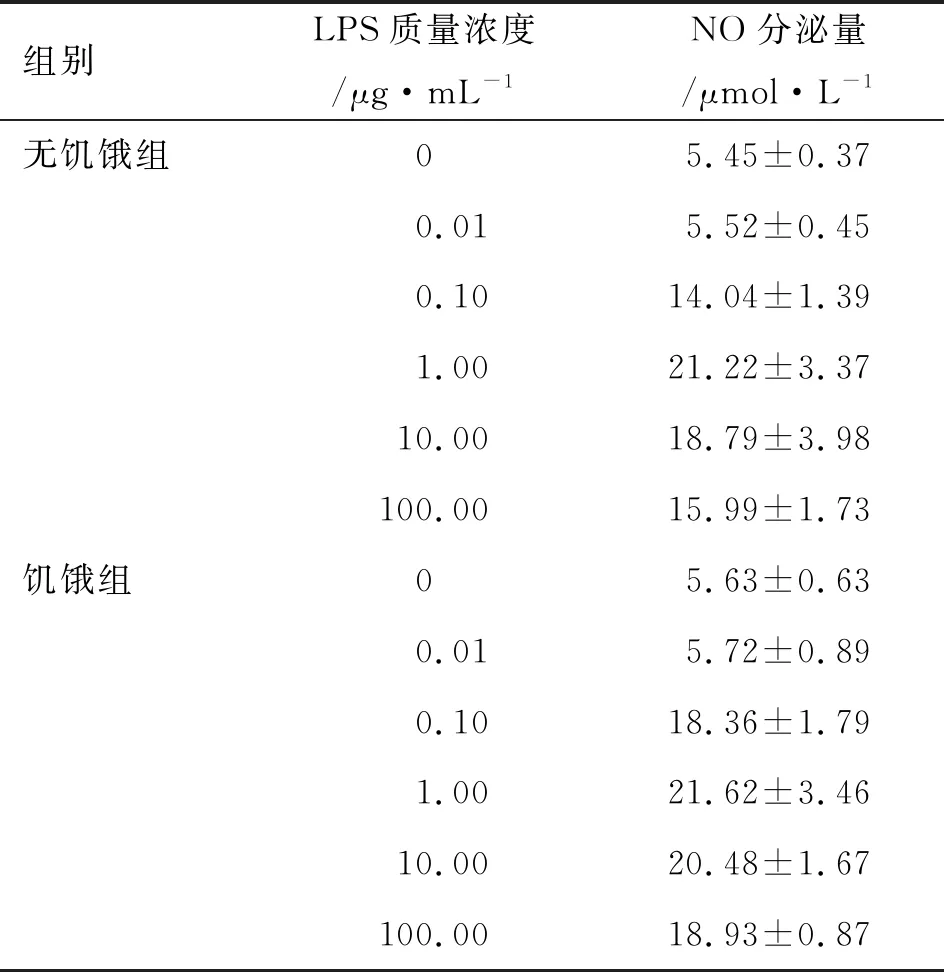
表3 不同质量浓度的LPS刺激RAW264.7细胞分泌NO的量
由表4可知,与空白组相比,LPS模型组RAW264.7细胞NO的分泌量明显增加(P<0.01)。与LPS模型组相比,可皆霉素各剂量组和地塞米松各剂量组NO分泌量均明显减少,差异具有统计学意义(P<0.01)。由分析抑制率可知,地塞米松对LPS 刺激 RAW264.7细胞分泌的炎症介质NO抑制作用显著,且呈剂量依赖性。可皆霉素对LPS 刺激RAW264.7细胞分泌的NO有抑制作用,但与地塞米松组相比抑制作用较弱,且无明显剂量依赖性。在质量浓度为12.50 μg·mL-1时,可皆霉素对NO的抑制率达到96.88%,抑制作用显著强于质量浓度为12.50 μg·mL-1的地塞米松片(91.71%)。
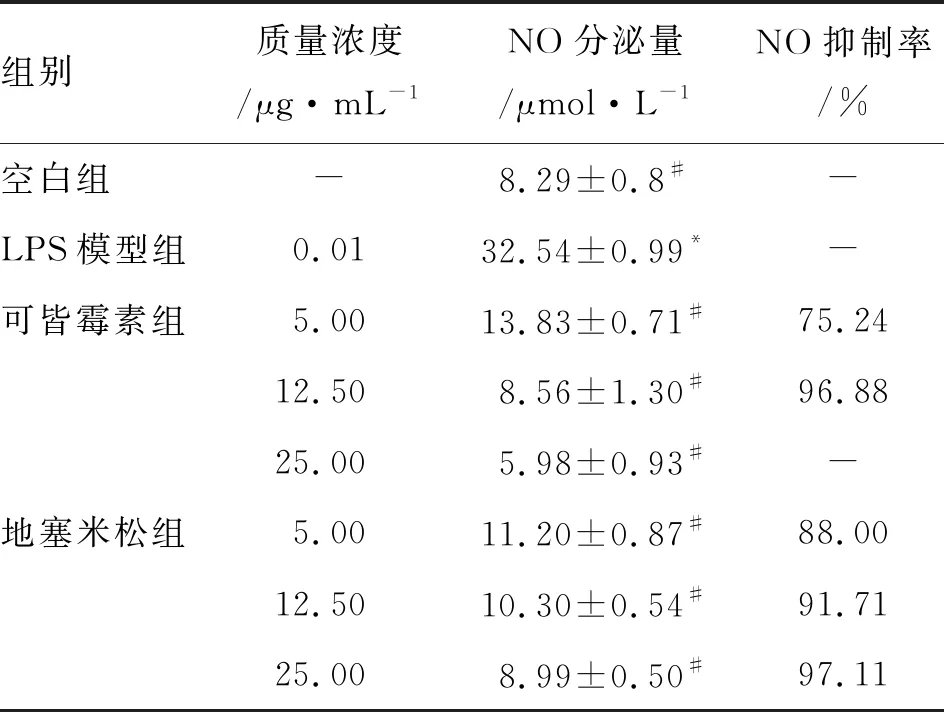
表4 不同质量浓度的可皆霉素作用后细胞的NO分泌量及抑制率
4 讨论
炎症是一种复杂的生理现象,是一种以感染、组织损伤、创伤或有害刺激为特征的积极反应[8]。然而过度的炎症反应会对宿主细胞和组织造成灾难性后果,引发各种自身免疫性疾病,包括动脉粥样硬化、糖尿病、心血管疾病和癌症[9-10]。利用LPS刺激巨噬细胞炎症已被用来探索抗炎化合物[11-13]。本文采用LPS刺激RAW 264.7小鼠巨噬细胞作为炎症细胞模型,研究可皆霉素对RAW264.7细胞NO分泌量的影响,评价可皆霉素的抗炎活性。
巨噬细胞经LPS刺激后可产生大量的炎性因子,如NO、肿瘤坏死因子、白细胞介素等[14-15]。NO是机体内重要的信号分子,是由神经型、内皮型和诱导型3种一氧化氮合成酶(NOS)催化生成,在机体循环、神经、免疫系统及细胞凋亡等过程中都起着十分重要的作用[16-17]。研究表明,组织中的诱导型一氧化氮合成酶(iNOS)在炎症反应中被诱导产生,生成大量NO,促进炎症反应发生,因此若样品能够降低炎性反应中NO的含量,即被认为具有抗炎作用[18-20]。本研究发现,可皆霉素具有良好的NO分泌抑制活性,抑制率可达96.88%,抑制作用显著强于地塞米松片。本实验初步研究了可皆霉素的抗炎作用,为其进一步开发利用提供了参考。
